Описание
МЕТОДЫ И ЛЕЧЕНИЕ НЕКОТОРЫХ ДЕМИЛИНАЦИОННЫХ И ДИСМИЕЛИНАЦИОННЫХ НАРУШЕНИЙ И / ИЛИ СОДЕЙСТВИЯ
ремиелинизацию
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам и композициям для лечения причин дисмиелинизации и / или демиелинизации нейронов и / или предотвращения развития заболеваний, связанных с миелином и аксонами, и / или стимулирования ремиелинизации путем введения субъекту, нуждающемуся в этом, эффективного количества (или терапевтического или профилактическое средство) и концентрацию элементарной наночастицы золота и в предпочтительном варианте осуществления раскрытую здесь поверхностно-чистую суспензию нанокристаллов на основе золота.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Демиелинизирующее заболевание представляет собой любое заболевание центральной нервной системы («ЦНС») и / или периферической нервной системы («ПНС»), при котором миелиновые оболочки нейронов становятся поврежденными. Повреждение миелиновой оболочки обычно отрицательно влияет на проводимость сигналов в пораженных нервах и / или приводит к некоторому типу ненормальной или плохой работы нижележащего нейрона (ов). Связанное с этим повреждение миелина приводит к дефициту любого из или всех: ощущений, познания, двигательных навыков или других функций, в зависимости от того, какие нейроны / миелиновые оболочки повреждены или не являются нормальными.
Точные механизмы демиелинизации и дисмиелинизации не совсем понятны. Известно, что миелин является жизненно важным белковым покрытием для нейронов в каждой из центральной нервной системы и периферической нервной системы. Этот жизненно важный белок создает оболочки, обычно называемые «миелиновыми оболочками» вокруг многих нейронов млекопитающего. Миелиновые оболочки, которые являются здоровыми и не имеют дефектов, будут вызывать быстрые и полные нервные сигналы, поскольку здоровые миелиновые оболочки позволяют быстро передавать электрические потенциалы с помощью нейронных аксонов; и / или способствуют здоровой структуре и / или функции нижележащих нейронов, включая, например, потерю трофической и метаболической поддержки. Когда миелин удален, частично или полностью из аксонов (например, демиелинизация),
Кроме того, миелиновая оболочка образована так называемой плазмалеммой глиальных клеток (например, олигодендроцитами в центральной нервной системе и клетками Шванна в периферической нервной системе), также известной как плазматическая мембрана. Миелиновые оболочки образуются относительно быстрыми темпами во время активной фазы миелинизации. В частности, олигодендроциты в центральной нервной системе должны продуцировать достаточное количество миелина, чтобы привести к естественному
«ремиелинизация» при нормальном, здоровом функционировании. Таким образом, вновь синтезированный миелин важно производить на регулярной основе.
Ремиелинизация включает в себя образование новых миелиновых оболочек вокруг оголенных аксонов во взрослой ЦНС. Непосредственным следствием ремиелинизации является правильное перераспределение ионных каналов в узлах Ранвье, а также восстановление солевой проводимости. Таким образом, ремиелинизация частично разрешает повышенную потребность в энергии, которая наблюдается при уменьшении содержания митохондрий в аксонах. Кроме того, ремиелинизация приводит к восстановлению функциональных дефицитов, вызванных демиелинизацией. Данные также свидетельствуют о том, что демиелинизированные аксоны лучше защищены от последующей травмы, когда они становятся ремиелинизированными. Такая ремиелинизация может восстановить правильную передачу сигналов фактора роста между олигодендроцитом и аксоном. Существует также доказательство того, что симбиотические отношения между аксоном и олигодендроцитом активны, и роль миелина заключается не просто в электрической изоляции. В частности, аксоны могут сильно повреждаться, когда тела олигодендроцитов направляются на абляцию даже при отсутствии какой-либо наблюдаемой демиелинизации. Такой процесс может привести к дисмиелинизации или дисфункции.
Демиелинизация или дисмиелинизация связаны с большим количеством как приобретенных нарушений, так и наследственных состояний центральной нервной системы и периферической нервной системы.
Экспериментальные системы, которые создают набор условий, которые пытаются получить результат у животного, который коррелирует или имитирует, по меньшей мере, некоторые механизмы / результаты, ответственные или связанные с заболеваниями человека, хорошо известны. Одна из этих систем известна как купризоновая модель животного 15 . Эта «модель токсической демиелинизации» приводит к изменению морфологии митохондрий, и предполагается, что нейротоксичные свойства этого соединения, хелатирующего медь, обусловлены нарушением клеточного дыхания. 9 Демиелинизация, вызванная купризоном, является результатом дегенерации поддерживающих олигодендроцитов, а не прямой атаки на миелиновые оболочки. 10 ‘ у ‘ 12
Более того, механизмы, ответственные за олигодендроглиальную смерть при поражениях РС, не ясны. Сомнительно, что сходные патомеханизмы ответственны за потерю олигодендрогий при поражениях рассеянным склерозом («МС») и в купризоновой модели 9 . В настоящее время РС рассматривается как расстройство с множеством различных аспектов и особенностей. Эксперты в данной области оспаривают, моделирует ли индуцированная купризоном демиелинизацию потерю миелина у пациентов с РС 9 . Специфический патогенез РС остается неизвестным.
Кроме того, расстройства и заболевания, которые включают демиелинизацию, которая может быть связана с моделями токсической демиелинизации, такими как модель животных с купризоном, включают
Прогрессирующий супрануклеарный паралич, болезнь Александера, болезнь Краббе, метахроматический
Лейкодистрофия, болезнь Канвана, лейкодистрофии, энцефаломиелит, миелолиз центральной части понты (CPM), болезнь Anti-MAG, болезнь Пелизеуса-Мерцбахера, болезнь Refsum, синдром Коккейна, синдром Зеллвегера, синдром Гийена-Барре, синдром Гиллез-Барре (синдром Гиллена-Барре) (хронический воспалительный синдром), синдром Гиллена-Барре (синдром Гиллена-Барре) демиелинизирующая полинейропатия (CIDP), мультифокальная моторная невропатия (MMN), Neuromyelitis Optica (NMO), прогрессивная мультифокальная
Лейкоэнцефалопатия (ПМЛ), дегенерация валерианы и некоторые наследственные заболевания, такие как
Адренолейкодистрофия, болезнь Александра, легкое когнитивное нарушение (MCI), также известное как возрастное снижение когнитивных функций и болезнь Пелизея Мерцбахера (PMZ). Для многих из этих вышеупомянутых расстройств мало или вообще нет лекарств и очень мало эффективных методов лечения, если таковые имеются.
Neuromyelitis Optica (NMO) также иногда называют болезнью Девича.
НМО — это расстройство центральной нервной системы (ЦНС), которое преимущественно поражает зрительный нерв и спинной мозг пациентов. НМО является одним из основных нейроиммунологических заболеваний в Азии.
НМО-иммуноглобулин G (IgG) был обнаружен в сыворотке пациентов с НМО, который связывается с гематоэнцефалическим барьером или вблизи него в мозге мыши. Эпитоп NMO-IgG был идентифицирован как аквапорин-4 (AQP4), водный канал, плотно экспрессируемый в астроцитарных отростках стопы на гематоэнцефалическом барьере.
NMO характеризуется возникновением тяжелого неврита зрительного нерва и миелита, чаще всего наблюдаемого как продольно расширенный поперечный миелит (LETM), иногда оба возникают одновременно, а иногда последовательно. Большинство пациентов с НМО имеют аутоантитела против AQP4 в своей сыворотке. Таким образом, диагностические критерии NMO требуют наличия как неврита зрительного нерва, так и миелита и выполнения, по крайней мере, двух из трех поддерживающих критериев: МРТ-свидетельство смежного поражения спинного мозга, распространяющегося на три или более сегмента позвонка; отрицательные результаты для диагностических критериев рассеянного склероза на МРТ головного мозга, проведенного в начале; и NMO-IgG (или антитело против AQP4) серопозитивность.
Таким образом, в настоящее время NMO рассматривается как астроцитопатия, опосредуемая антителами против AQP4, и отличается от демиелинизирующего расстройства, такого как MS. Тем не менее, млекопитающие, имеющие НМО, ясно показывают патологические результаты демиелинизации или дисмиелинизации. Сравнение регенерации в ПНС и ЦНС
Исторически считалось, что регенерация нерва гораздо более эффективна в ПНС, чем в ЦНС. Исследователи однажды подумали, что нейроны ЦНС просто обладают меньшей внутренней способностью к регенерации, но эта парадигма была поставлена под сомнение открытием, что нейроны ЦНС могут расти через трансплантат периферического нерва. Сравнение этих двух систем установило, что ингибирующая среда ЦНС представляет собой наибольшую проблему для регенерации аксонов ЦНС, и привело к открытию нескольких факторов, которые стимулируют рост PNS или ингибируют рост в ЦНС. Например, миелин олигодендроцитов и миелин клеток Шванна оба содержат ингибирующие молекулы. В ЦНС разрастание аксонов также блокируется в месте повреждения глиальным рубцом, который состоит из реактивных астроцитов и микроглии. В отличие от этого, в PNS не образуются глиальные рубцы, и полосы Бунгнера, образованные клетками Шванна, фактически помогают наведению и регенерации аксонов. Понимание этих важных различий в регенерации ЦНС и ПНС может помочь сформировать стратегии для улучшения регенерации в непермиссивных средах, а именно в ЦНС и хронически денервированных ПНС.
Остается значительная потребность в материалах и / или обработках, чтобы помочь остановить или замедлить демиелинизацию или дисмиелинизацию и / или способствовать ремиелинизации и / или сохранить или восстановить функционирование миелина и / или аксона.
ОПРЕДЕЛЕНИЯ
В данном описании и формуле изобретения слово «содержать» или варианты, такие как «содержит» или «содержащий», указывают на включение любого приведенного целого числа или группы целых чисел, но не исключение какого-либо другого целого числа или группы целых чисел. Термин «содержащий» является включающим или открытым, и не исключает дополнительных, не процитированных элементов или этапов способа. Фраза «состоящий по существу из» обозначает включение указанных материалов или этапов, а также тех, которые не оказывают существенного влияния на основные и новые характеристики заявленного изобретения. Используемый здесь термин «состоящий» относится только к указанному материалу или способу шаги.
Используемый здесь термин «терапевтически эффективное количество» относится к количеству, эффективному при концентрациях нанокристаллов золота и объеме суспензии, а также в течение необходимых периодов времени и / или дозирования для достижения желаемого терапевтического результата. Желаемый терапевтический результат может включать, но не ограничиваться ими, уменьшение симптомов, длительную выживаемость, улучшенную подвижность или функцию, сниженную степень рецидивов, длительные периоды ремиссии или тому подобное. «Терапевтически эффективное количество» может достигать любого из желаемых терапевтических результатов или любой комбинации множества желательных терапевтических результатов. Терапевтический результат не обязательно должен быть «лекарством». Терапевтический результат также включает измеренные различия в количестве (количествах) повреждения миелина, снижении миелиновой демиелинизации и / или увеличении ремиелинизации.
Используемый здесь термин «профилактически эффективное количество» относится к количеству, эффективному при концентрациях нанокристаллов золота и объеме суспензии, а также в течение необходимых периодов времени и / или дозирования для достижения желаемого профилактического результата. Как правило, поскольку профилактическая доза используется у субъектов до или на более ранней стадии заболевания, профилактически эффективное количество может быть меньше, чем терапевтически эффективное количество. Профилактический результат также включает измеренные различия в количестве (количествах) повреждения миелина, уменьшении демилинирования миелина и / или увеличении ремиелинизации.
Используемый здесь термин «обработка» или «обработка» относится к введению наночастицы на основе элементарного золота и в предпочтительном варианте осуществления новой суспензии нанокристалла на основе золота, обозначенной здесь как «CNM-Au8», млекопитающему для того, чтобы улучшить или уменьшить симптомы заболевания. Кроме того, термины «лечение» или «лечение» относятся к введению вышеупомянутых наносуспензий на основе золота млекопитающему для предотвращения прогрессирования заболевания. Профилактика прогрессирования заболевания также включала измеренные различия в количестве (количествах) повреждения миелина, уменьшении демилинирования миелина и / или увеличении ремиелинизации.
Под «субъектом», «индивидуумом», «животным», «пациентом» или «млекопитающим» подразумевается любой субъект, в частности субъект млекопитающего, для которого желательны диагноз, прогноз, терапия и / или профилактика. Субъекты млекопитающих включают, но не ограничиваются ими, людей, домашних животных, сельскохозяйственных животных, животных зоопарка, спортивных животных, домашних животных, таких как собаки, кошки, морские свинки, кролики, крысы, мыши, лошади, крупный рогатый скот, коровы; приматы, такие как обезьяны, обезьяны, орангутаны и шимпанзе;
клыки, такие как собаки и волки; кошачьи, такие как кошки, львы и тигры; лошади, ослы и зебры; корма для животных, такие как коровы, свиньи и овцы; копытные, такие как олени и жирафы; грызуны, такие как мыши, крысы, хомяки и морские свинки; и так далее. В определенных
В воплощениях млекопитающее представляет собой человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В предпочтительном варианте осуществления новые нанокристаллы золота суспендируют в воде высокой чистоты, и нанокристаллы золота имеют нанокристаллические поверхности, которые по существу не содержат (как определено в настоящем документе) органических или других примесей или пленок, но остаются стабильно суспендированными в воде. В частности, поверхности являются «чистыми» по сравнению с поверхностями, полученными с использованием процессов химического восстановления, которые требуют химических восстановителей и / или поверхностно-активных веществ для выращивания наночастиц золота из ионов золота в растворе. Большинство выращенных нанокристаллов золота имеют уникальные и идентифицируемые характеристики поверхности, такие как пространственно расширенный низкий индекс, кристаллические плоскости {111}, {110} и / или {100} и группы таких плоскостей (и их эквиваленты). Получающиеся в результате нанокристаллические суспензии или коллоиды золота, которые имеют желательные диапазоны рН, такие как 4,0-9,5, но более типично 5,0-9.
Формы и распределения формы этих нанокристаллов золота, полученных в соответствии с процессом изготовления, описанным ниже, включают, но не ограничиваются ими, треугольники (например, тетраэдры), пятиугольники (например, пятиугольные бипирамиды или декаэдры), шестиугольники (например, шестиугольные бипирамиды, икосаэдры) , октаэдры), алмаз (например, октаэдры, различные удлиненные бипирамиды, плавленые тетраэдры, виды сбоку бипирамид) и «другие». Распределение (я) формы нанокристаллов, содержащих вышеупомянутые пространственно вытянутые кристаллические плоскости с низким индексом (которые формируют вышеупомянутые формы) и имеющих «чистые» поверхности, является уникальным.
Может быть обеспечен любой желаемый средний размер нанокристаллов золота ниже 100 нм. Наиболее желательные диапазоны размеров кристаллов золота включают в себя те, которые имеют средний размер кристаллов или «моду» (как измерено и определено с помощью конкретных методик, подробно описанных в настоящем документе и обозначенных как «средний диаметр ПЭМ»), которые преимущественно составляют менее 100 нм, и более типично менее 50 нм, еще более типично менее 30 нм, и во многих предпочтительных вариантах осуществления, раскрытых в данном документе, режим распределения нанокристаллов по размерам составляет менее 21 нм и находится в еще более предпочтительном диапазоне 8-18 нм.
В соответствии с изобретением можно обеспечить любую концентрацию наночастиц золота для достижения терапевтически эффективного количества или профилактически эффективного количества.
В предпочтительном варианте осуществления предложен новый способ получения этих уникальных нанокристаллов золота с чистой поверхностью, стабильно суспендированных в воде. Процесс включает в себя рост нанокристаллов золота в воде. В предпочтительном варианте осуществления вода содержит добавленный «усилитель процесса», который существенно не связывается с образующимися нанокристаллами, а скорее способствует росту зародышей / кристаллов во время электрохимически стимулированных процессов роста. Усилитель процесса играет важную роль в процессе, включая обеспечение заряженных ионов в электрохимическом растворе, чтобы позволить кристаллам быть выращенными. Эти новые электрохимические процессы могут происходить в периодическом, полунепрерывном или непрерывном процессе. Эти процессы приводят к контролируемым концентрациям нанокристаллов золота, контролируемые размеры нанокристаллов и контролируемые диапазоны размеров нанокристаллов; а также контролируемые формы нанокристаллов и контролируемые распределения формы нанокристаллов. Новые производственные сборки предназначены для производства этих нанокристаллов золота. Новые методы фильтрации в тангенциальном потоке («TFF») используются для получения более высоких ppm золота и обеспечения стабильности (т. Е. Суспензий со значениями дзета-потенциала, по меньшей мере, -20 мВ, а более типично, по меньшей мере, -40 мВ и даже более типично, по меньшей мере, -50 мВ для представляющие интерес диапазоны pH) в концентрациях до 3000 ч / млн (т.е. 3000 мкг / мл).
Предоставляются фармацевтические композиции, которые подходят для системного применения, включая пероральное, внутривенное, подкожное, внутриартериальное, буккальное, ингаляционное, аэрозольное, пропеллентное или другое подходящее жидкое средство и т.д., как описано далее в настоящем документе.
Фармацевтические композиции включают терапевтически эффективное количество или
также обеспечивается профилактически эффективное количество нанокристаллов золота для лечения, улучшения или предотвращения любых медицинских / патологических состояний, описанных в настоящей заявке. В предпочтительном варианте осуществления нанокристаллы золота вводят в перорально доставленной жидкости, где нанокристаллы золота остаются в воде производства, которая может быть сконцентрирована или восстановлена, но предпочтительно не высушена до такой степени, что поверхности нанокристаллов золота становятся полностью высушите или имейте их поверхности иначе, чем их первоначальное состояние производства.
Важно признать, что в фармацевтических продуктах цель состоит в том, чтобы установить минимальную дозу, необходимую для достижения эффективности, минимизируя таким образом потенциальную токсичность или осложнения. Новый перорально вводимый продукт со значительно большей эффективностью может достигать эффективности при уровнях дозы ниже, чем у продуктов предшествующего уровня техники, и / или может достигать
существенно большая эффективность при эквивалентных уровнях дозы. Клинические испытания необходимы для подтверждения, например, терапевтически эффективного количества. Однако титрование до клинического эффекта может быть достигнуто, например, путем варьирования концентрации, объема, времени и / или частоты дозирования.
Предлагаются фармацевтические композиции, которые подходят для системного применения, включая пероральное, внутривенное, подкожное, внутриартериальное, буккальное, ингаляционное, аэрозольное, пропеллентное или другое подходящее жидкое средство и т.д., как описано далее в настоящем документе.
Подходящие количества доз и режимы дозирования могут быть определены лечащим врачом или ветеринаром и могут зависеть от желаемого уровня ингибирующей и / или модифицирующей активности, конкретного состояния, подвергаемого лечению, тяжести состояния, является ли доза терапевтически эффективным количеством или профилактически эффективное количество, а также общий возраст, здоровье и вес субъекта.
Нанокристаллы золота, содержащиеся в водной среде, могут вводиться в виде однократной дозы или серии доз. Хотя водную среду, содержащую нанокристаллы на металлической основе, можно вводить отдельно, например, в коллоидной форме, может быть приемлемым включение смеси активных ингредиентов с другими композициями и / или терапиями. Кроме того, различные фармацевтические композиции могут быть добавлены к активным
ингредиент (ы) / подвеска (ы) / коллоидный (ы).
Соответственно, в предпочтительном варианте осуществления изобретения суспензии или коллоиды нанокристаллов золота по изобретению (например, содержащие водный металл на основе золота) можно вводить в сочетании со вторым терапевтическим агентом. Второе терапевтическое средство может включать глюкокортикоид.
Суспензии нанокристаллов золота в соответствии с настоящим изобретением, подходящие для перорального введения, обычно представлены в виде стабильного раствора, коллоида или частично стабильной суспензии в воде. Однако такие нанокристаллы золота также могут быть включены в неводную жидкость в виде отдельных единиц, таких как жидкие капсулы, пакеты-саше или даже таблетки (например, высушивающие суспензии или коллоиды для получения нанокристаллов на основе золота активного ингредиента до тех пор, пока таковые имеются). обработка не оказывает вредного влияния на функциональность поверхностей нанокристаллов первичного золота, каждая из которых содержит заранее определенное количество, например, активного ингредиента нанокристалла золота; в виде порошка или гранул; в виде раствора, коллоида или суспензии в водной или неводной жидкости; или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Активный ингредиент нанокристалла золота также может быть объединен в болюс, электуарий или пасту. Следует понимать, что в качестве материала для обработок, обсуждаемых в данном документе, могут быть использованы различные элементарные наносуспензии золота.
Композиции, подходящие для перорального введения в полость рта, включают пастилки, содержащие суспензии или коллоиды, содержащие один или несколько активных ингредиентов нанокристалла золота в ароматизированной основе, такой как сахароза и акация или трагакантовая камедь; пастилки, содержащие нанокристаллический активный ингредиент золота в инертной основе, такой как желатин и глицерин, или сахароза и камедь акации; и жидкости для полоскания рта, содержащие активный ингредиент нанокристалла золота в подходящем жидком носителе.
Суспензии или коллоиды нанокристаллов золота также можно вводить интраназально или путем ингаляции, например, с помощью распылителя, аэрозоля или распылителя, чтобы заставить один или несколько компонентов в растворе или коллоиде (например, нанокристаллы золота), например, содержаться в туман или спрей.
Композиции для ректального введения могут быть представлены в виде суппозитория с подходящей основой-носителем, содержащей, например, масло какао, желатин, глицерин или полиэтиленгликоль. Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или составов спрея, содержащих в дополнение к активному ингредиенту такие носители, которые, как известно в данной области техники, являются подходящими.
Композиции, подходящие для парентерального введения, включают водные и неводные изотонические стерильные инъекционные суспензии или коллоиды, которые могут содержать антиоксиданты, буферы, бактерициды и растворенные вещества, которые делают композицию изотонической с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции могут быть представлены в герметичных контейнерах с единичными или многократными дозами, например, в ампулах и флаконах, и могут храниться в лиофилизированных (лиофилизированных) условиях, требующих только добавления стерильного жидкого носителя, например воды для инъекции, непосредственно перед использованием. Инъекционные растворы, коллоиды и суспензии для немедленного введения могут быть приготовлены из стерильных порошков, гранул и таблеток ранее описанного типа.
Предпочтительными единичными дозированными композициями являются те, которые содержат суточную дозу или единицу, суточную субдозу, как описано здесь выше, или соответствующую ее долю активного ингредиента.
Следует понимать, что в дополнение к активным ингредиентам нанокристалла золота, в частности, упомянутым выше, композиции по данному изобретению могут включать другие агенты, обычные в данной области техники, с учетом типа рассматриваемой композиции, например, те, которые подходят для перорального введения, могут включать такие дополнительные агенты, как связующие, подсластители, загустители, ароматизаторы, дезинтегрирующие агенты, покрывающие агенты, консерванты, смазывающие вещества, агенты, замедляющие время, и / или агенты, снимающие положение. Подходящие подсластители включают сахарозу, лактозу, глюкозу, аспартам или сахарин. Подходящие разрыхлители включают кукурузный крахмал, метилцеллюлозу, поливинилпирролидон, ксантановую камедь, бентонит, альгиновую кислоту или агар. Подходящие ароматизаторы включают масло мяты перечной, масло грушанки, вишни, апельсина или малины. Подходящие покрывающие агенты включают полимеры или сополимеры акриловой кислоты и / или метакриловой кислоты и / или их сложных эфиров, восков, жирных спиртов, зеина, шеллака или глютена. Подходящие консерванты включают бензоат натрия, витамин Е, альфа-токоферол, аскорбиновую кислоту, метилпарабен, пропилпарабен или бисульфит натрия. Подходящие смазывающие вещества включают стеарат магния, стеариновую кислоту, олеат натрия, хлорид натрия или тальк. Подходящие агенты задержки времени включают глицерилмоностеарат или глицерилдистеарат. хлорид натрия или тальк. Подходящие агенты задержки времени включают глицерилмоностеарат или глицерилдистеарат. хлорид натрия или тальк. Подходящие агенты задержки времени включают глицерилмоностеарат или глицерилдистеарат.
Эти нано-суспензии элементарного золота и в предпочтительном варианте осуществления, по существу, поверхностно-чистые или поверхностно-чистые нанокристаллы золота, суспендированные в воде высокой чистоты, можно использовать для лечения любого расстройства, описанного выше в предшествующем уровне техники. Кроме того, фраза «наносуспензии элементного золота» или «наноструктуры элементарного золота» или тому подобное, следует понимать как означающие наносуспензии CNM-Au8, которые в явном виде раскрыты в данном документе, но также следует понимать, что они включают другие наносуспензии элементарного золота, изготовленные совершенно другими методами. до тех пор, пока общие физические свойства, включая размер наночастиц, концентрацию (и), pH и т. д., находятся в тех же пределах, что и физические свойства наносуспензий CNM-Au8, подробно описанных здесь,
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
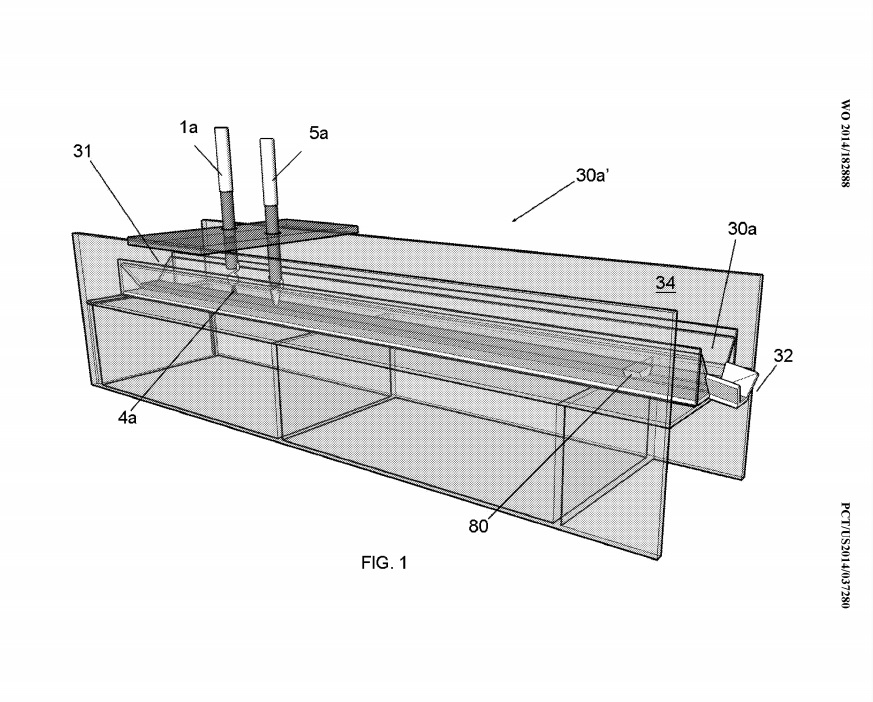
Фиг. На фиг.1 показан первый впадинный элемент 30а ‘, в котором создана одна плазма 4а. Выход этого первого лоткового элемента 30a ‘течет во второй лотковый элемент 30b’.
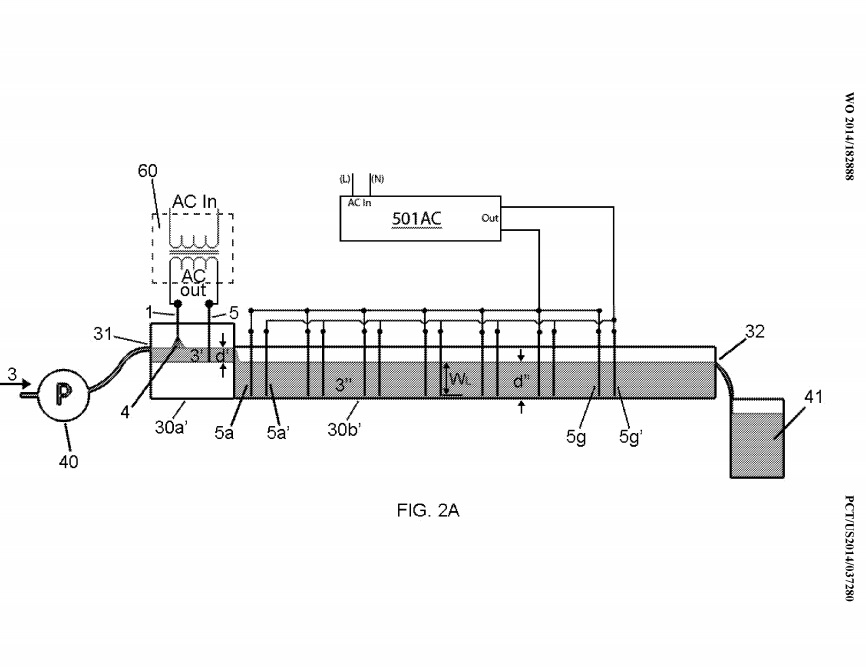
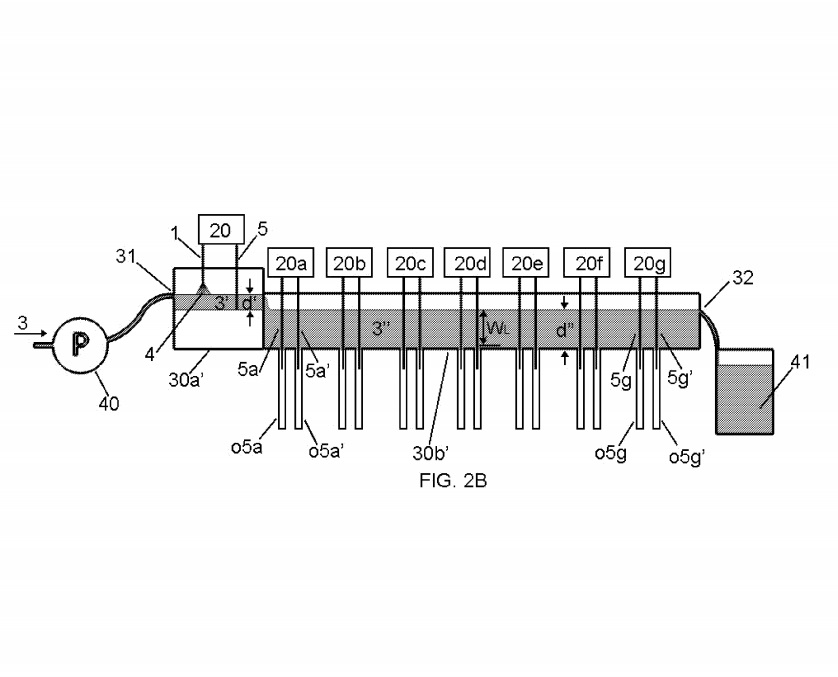
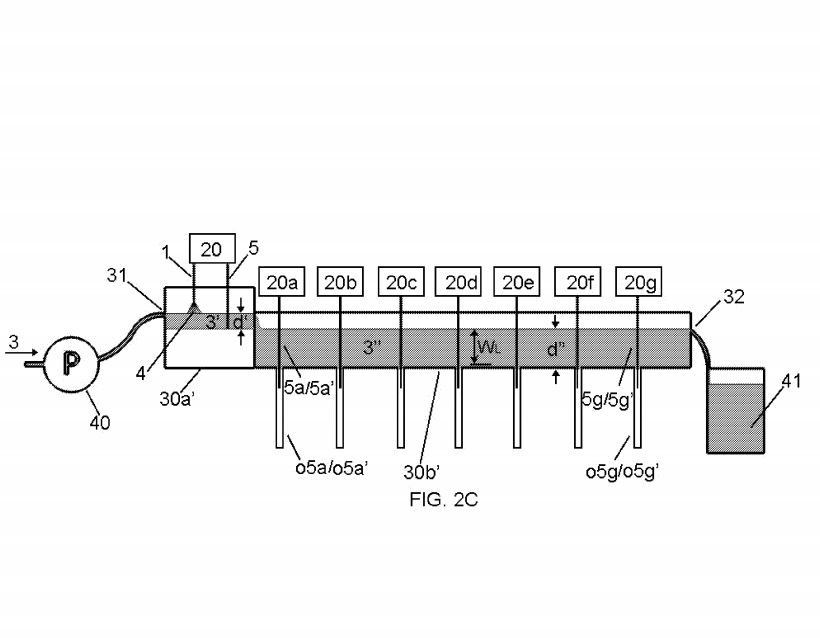
ФПГ. 2А-2С показана альтернативная конструкция лоткового элемента 30b ‘, в которой части 30а’ и 30b ‘лоткового элемента являются смежными.
РИСУНОК. 3 показывает желобчатый элемент 30b ‘, используемый в связи с фиг. 2А-2С и пример 1 в настоящем документе.
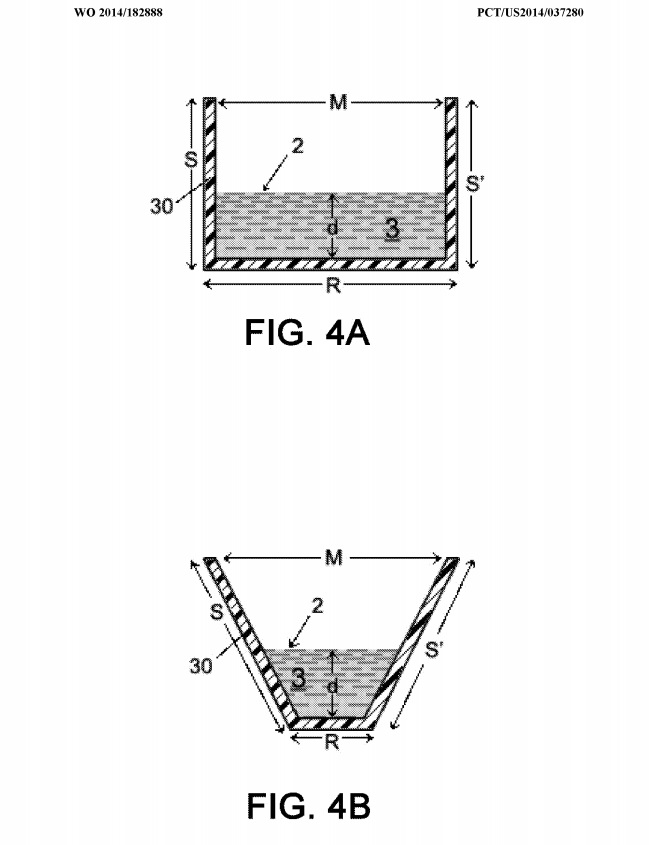
ФПГ. 4А-4В показаны два вида поперечного сечения двух желобчатых элементов 30.
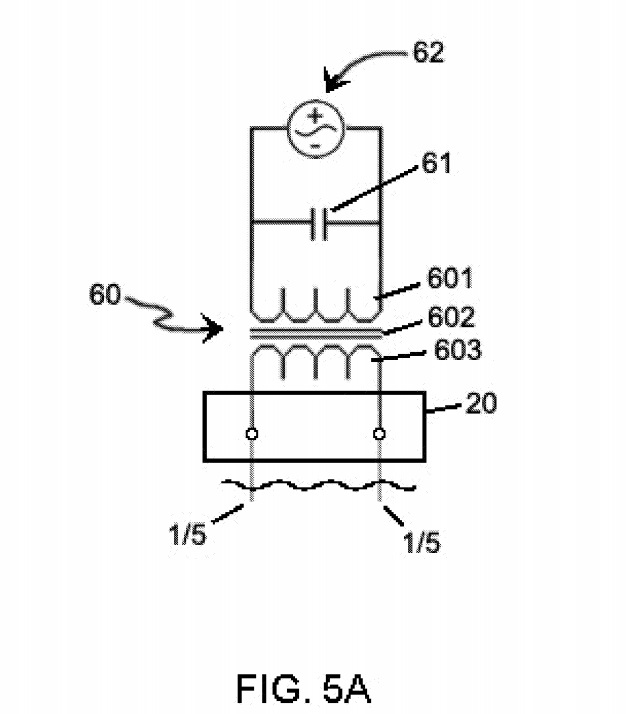
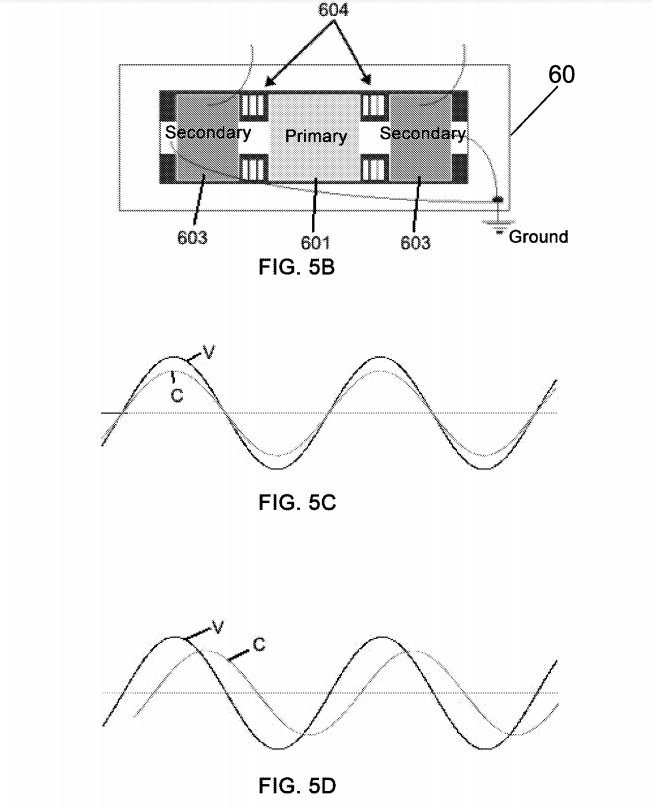
РИСУНОК. На фиг.5А показана схема электрических соединений трансформатора переменного тока для использования при изготовлении плазмы 4, используемой для изготовления нанокристаллической суспензии, описанной в примере 1. На фиг. 5В показан схематический вид трансформатора 60, а на фиг. 5C и 5D показывают схему
представления двух синусоидальных волн в фазе и в противофазе, соответственно.
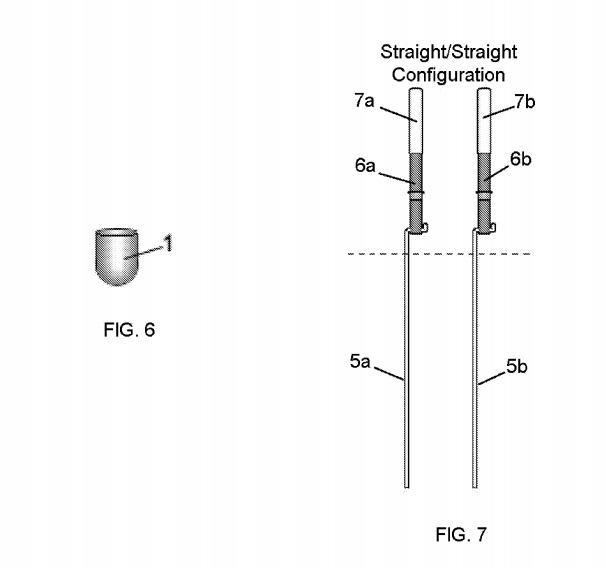
РИСУНОК. 6 показывает типичный вариант осуществления одной из конфигураций для электрода
1.
РИСУНОК. На фиг.7 показан вид золотых проводов 5а и 5b, использованных в примере 1.
РИСУНОК. 8 является схемой электрической установки источника питания, используемой для создания суспензий нанокристаллов золота, обсуждаемых в примере 1.
РИСУНОК. На фиг.9 схематично показано поперечное сечение набора управляющих устройств 20, расположенных на элементе 30 желоба с жидкостью 3, протекающей через него в контейнер 41 для хранения.
РИСУНОК. На фиг.10А представлена типичная микрофотография ПЭМ высушенных нанокристаллов золота, полученных в связи с примером 1.
РИСУНОК. На фиг.10В показана гистограмма распределения частиц по размерам из измерений ПЭМ для высушенных нанокристаллов золота, сформированных в связи с примером 1.
РИСУНОК. МОК показывает спектральные характеристики УФ-видимого спектра золотой суспензии, полученной в соответствии с примером 1. На фиг. 11 представляет собой схематическое изображение устройства TFF, используемого для концентрирования наносуспензий золота.
РИСУНОК. На фиг.12 показан вид в перспективе устройства и процесса, используемых для изготовления срезов коронкового мозга, описанных в примере 2.
РИСУНОК. 13 представляет столбчатую диаграмму, которая показывает относительное количество окрашивания миелина, присутствующего в мышиной группе 1-4 примера 2.
ФПГ. 14А-14D показаны изображения ПЭМ репрезентативных частей мозолистого тела для одной мыши из каждой группы мышей 1-4 соответственно из примера 2.
РИСУНОК. 15 показывает гистограмму G-соотношений, измеренных / откалиброванных по наблюдению около 100 аксонов на каждом изображении ПЭМ тела мозолистого тела, полученном от одной мыши из каждой из групп 1-4, соответственно, из примера 2.
РИСУНОК. 16 показаны диаграммы разброса данных, связанные с вычислениями отношения G для одной мыши из каждой из групп 1-4 соответственно из примера 2.
ФПГ. 17A-D показаны гистограммы фактических данных G-отношения по сравнению с сгенерированными колоколообразными кривыми для одной мыши из каждой группы мышей 1-4, соответственно, из примера 2.
РИСУНОК. 18 показывает серию графиков, соответствующих среднему количеству жидкости, потребляемой каждой из групп мышей 1-4 из примера 2 на протяжении всего исследования.
РИСУНОК. 19 показывает серию графиков, соответствующих среднему весу каждой из групп мышей 1-4 из примера 2, измеренному на протяжении всего исследования.
ФПГ. 20А-20F показывают несколько схематических изображений участков мозга, которые подвергаются методам подготовки образца, обсуждаемым в примере 3.
ФПГ. 21А-21В показано устройство для удержания и разрезания срезов мозга, используемое для получения тонких срезов для изображений ПЭМ, обсужденных в примере 3.
РИСУНОК. 22 показывает серию графиков, соответствующих среднему приросту веса каждой мыши в группах 1-7, начиная с возраста 8 недель, как обсуждалось в примере 3.
ФПГ. 23A-23C соответствуют изображениям ПЭМ, первоначально снятым при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 1, пример 3.
ФПГ. 24A-24E соответствуют изображениям ПЭМ, первоначально снятым при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 2, пример 3.
ФПГ. 25A-25G соответствуют изображениям ПЭМ, первоначально снятым при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 3, пример 3.
ФПГ. 26A-26E соответствуют изображениям ПЭМ, первоначально сделанным при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 4, пример 3. Области наблюдаемого ремиелинирования указаны стрелками 201.
ФПГ. 27A-27D соответствуют изображениям ПЭМ, первоначально снятым при 4000х и 5000х репрезентативных участков мозолистого тела для мышей из группы 5, пример 3. Области наблюдаемого ремиелинирования указаны стрелками 201.
ФПГ. 28A-28G соответствуют изображениям ПЭМ, первоначально сделанным при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 6, пример 3. Области наблюдаемого ремиелинирования указаны стрелками 201.
ФПГ. 29A-29D соответствуют изображениям ПЭМ, первоначально сделанным при 4000-кратном увеличении репрезентативных участков мозолистого тела для мышей из группы 7, пример 3. Области наблюдаемого ремиелинирования указаны стрелками 201.
ФПГ. 30A-30C показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16000-кратном увеличении, показывающие типичные части мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные черным ящиком и стрелками 202S на фиг. 30A, (и только стрелки 202 на фиг. 30B и фиг. 30C) относительно контрольного аксона, отмеченного звездой 203, для мышей из группы 1, пример 3.
ФПГ. 31A-31B показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16 000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 2, пример 3.
ФПГ. 32A-32B показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 3, пример 3.
ФПГ. 33A-33B показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16 000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 4, пример 3.
ФПГ. 34A-34B показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16 000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 5, пример 3.
ФПГ. 35A-35B показывают репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16 000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 6, пример 3.
ФПГ. 36A-36B показаны репрезентативные изображения ПЭМ, первоначально сделанные при приблизительно 16 000-кратном увеличении, показывающие репрезентативные участки мозолистого тела, где аксоны указаны как поврежденные, демиелинизированные и / или дисмиелинизированные стрелками 202 относительно эталонного аксона, отмеченного звездой 203, для мышей из группы 7, пример 3.
ФПГ. 37A-37K показывают репрезентативные изображения ПЭМ, первоначально сделанные в 16000 или 40000 раз, которые соответствуют репрезентативным частям мозолистого тела мышей в группе
4. Области наблюдаемой ремиелинизации указаны стрелками 201M.
ФПГ. 38A-38L показывают репрезентативные изображения ПЭМ, первоначально сделанные с разрешением 16000x или
40000x, что соответствует репрезентативным частям мозолистого тела мышей в группе
5. Области наблюдаемой ремиелинизации указаны стрелками 201M.
ФПГ. 39A-39J показывают репрезентативные изображения ПЭМ, первоначально сделанные при 16 000 или 40000 х, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 6. Области наблюдаемого ремиелинирования указаны стрелками 201M.
ФПГ. 40A-40G показаны репрезентативные изображения ПЭМ, первоначально полученные при 16 000 или 40000 х, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 7. Области наблюдаемого ремиелинирования указаны стрелками 201M.
ФПГ. 41А-41С показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 1, пример 3. Эти изображения представляют собой изображения с большим увеличением, 40000-кратное, показывающие, что внутренний (2041) и внешний (204О) периметры миелин был помечен на каждом аксоне на нем.
ФПГ. 42A-42D показывают репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 2, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40000-кратное, показывающие, что внутренний (2041) и внешний (204O) периметры миелин был помечен на каждом аксоне на нем.
ФПГ. 43A-43C показывают репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 3, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 44A-44B показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 4, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 45А-45С показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 5, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 46А-46В показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 6, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 47A-47E показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 7, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 48A, 48B и 48C содержат модифицированные гистограммы в виде гистограммы, на которых представлены данные о соотношении G, соответствующие мышам в группе 1 (положительный контроль), группе 2 (2-недельный отрицательный контроль) и группе 3 (5-недельный отрицательный контроль) соответственно. Эти три измененные гистограммы гистограммы были объединены для сравнения.
ФПГ. 49A, 49B и 49C содержат модифицированные гистограммы гистограммы, на которых представлены данные G-соотношения, соответствующие мышам в группе 3 (5-недельный отрицательный контроль), группе 5 и группе 7 соответственно. Эти три измененные гистограммы гистограммы были объединены для сравнения.
ФПГ. 50A, 50B и 50C также содержат модифицированные гистограммы в виде гистограммы, на которых представлены данные о соотношении G, соответствующие мышам в группе 3 (5-недельный отрицательный контроль), группе 4 и группе 6 соответственно. Эти три измененные гистограммы гистограммы были объединены для сравнения.
ФИГ. 51 содержит гистограммы модифицированной гистограммы, на которых представлены данные G-соотношения, соответствующие мышам для всех групп 1-7.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Производство золотых (CNM-Au8) наносуспензий
В предпочтительном варианте осуществления элементарные нанокристаллы золота суспендируют в воде высокой чистоты, и нанокристаллы золота имеют нанокристаллические поверхности, которые по существу не содержат (как определено в настоящем документе) органических или других примесей или пленок. В частности, поверхности являются «чистыми» по сравнению с поверхностями, полученными с использованием процессов химического восстановления, которые требуют химических восстановителей и / или поверхностно-активных веществ для образования наночастиц золота из ионов золота в растворе. Предпочтительные нанокристаллы золота получают с помощью новых производственных процедур, подробно описанных здесь. Процедуры изготовления исключают предварительное использование добавленных химических восстановителей и / или поверхностно-активных веществ (например, органических соединений) или других агентов, которые обычно переносятся в частицах или на них или покрываются на поверхности химически восстановленных частиц;
В предпочтительном варианте осуществления способ включает зародышеобразование и рост нанокристаллов элементарного золота в воде, которая содержит «усилитель процесса» или «усилитель обработки» (обычно неорганический материал или карбонат или тому подобное), который существенно не связывается с сформированными нанокристаллами , но скорее облегчает зарождение / рост в процессе электрохимически стимулированного роста. Усилитель процесса играет важную роль в процессе, включая обеспечение заряженных ионов в электрохимическом растворе, чтобы позволить кристаллам быть выращенными. Усилитель процесса является критически важным соединением (ями), которое остается в растворе и / или не образует покрытие (например, органическое покрытие), и / или не оказывает неблагоприятного воздействия на сформированные нанокристаллы или образованную суспензию (и), и / или разрушается, испаряется, или иным образом теряется во время электрохимического процесса. Предпочтительным усилителем процесса является бикарбонат натрия.
Примерами других усилителей процесса являются карбонат натрия, бикарбонат калия, карбонат калия, тринатрийфосфат, динатрийфосфат, мононатрийфосфат, фосфаты калия или другие соли угольной кислоты или тому подобное. Дополнительными усилителями процесса могут быть соли, в том числе натрия или калия, бисульфита или сульфита. Другими усилителями процесса для изготовления нанокристаллов золота для использования в качестве медицинского лечения могут быть другие соли, включая натрий или калий, или любой материал, который помогает в процессах электрохимического роста, описанных здесь; который по существу не входит в состав или на поверхность нанокристаллов золота; и не придает нежелательной токсичности нанокристаллам или суспензионной среде, содержащей нанокристаллы.
Желательные диапазоны концентраций для усилителя обработки включают обычно 0,01-20 г / галлон (0,0026-2,1730 мг / мл), более типично 0,1-7,5 г / галлон (0,0264-1,9813 мг / мл) и наиболее типично 0,5-2,04 г / мл. галлон (0,13210-0,54 мг / мл).
Поскольку выращенные нанокристаллы золота имеют «голые» или «чистые» поверхности металлического золота (например, в состоянии нулевого окисления), поверхности являются высокореактивными или высоко биокаталитическими (а также высоко биодоступными). Нанокристаллы по существу окружены водяной рубашкой. Эти признаки обеспечивают повышенную эффективность in vivo по отношению к поверхностям наночастиц, которые содержат, например, органический материал, присутствующий в процессах химического восстановления. «Чистые» поверхности могут также или, альтернативно, уменьшить нежелательную токсичность нанокристаллов по сравнению с
наночастицы, которые содержат покрытые или «одетые» поверхности. Повышенная эффективность этих «чистых» нанокристаллов золота может обеспечить повышенный терапевтический индекс за счет более низкой дозы, необходимой для достижения желаемого терапевтически эффективного количества или желаемого профилактически эффективного количества у субъекта.
Существуют и другие важные преимущества использования новых нанокристаллов для лечения субъекта, которые включают относительную токсичность и / или относительную скорость появления преимуществ у субъекта.
В соответствии с описанными здесь способами предпочтительные нанокристаллы золота могут быть выращены таким образом, чтобы обеспечить уникальные и идентифицируемые характеристики поверхности, такие как пространственно расширенный низкоиндексный, кристаллические плоскости {111}, {110} и / или {100} и группы таких плоскостей. (и их эквиваленты). Формы нанокристаллов золота, полученных в соответствии с описанными здесь процессами, включают, но не ограничиваются ими, треугольники (например, тетраэдры), пятиугольники (например, пятиугольные бипирамиды или декаэдры), шестиугольники (например, шестиугольные бипирамиды, икосаэдры, октаэдры), алмаз (например, октаэдры, различные удлиненные бипирамиды, плавленые тетраэдры, виды сбоку бипирамид) и «другие». Процент нанокристаллов (т.е. выращенный в соответствии с различными вариантами осуществления, изложенными в настоящем документе), содержащие вышеупомянутые пространственно расширенные кристаллические плоскости с низким индексом и имеющие «чистые» поверхности, является еще одной новой особенностью изобретения. Кроме того, процент тетраэдров и / или пятиугольных бипирамид, образованных или присутствующих в нанокристаллических суспензиях, также является / уникальным.
Может быть обеспечен любой желаемый средний размер нанокристаллов золота ниже 100 нм. Наиболее желательные диапазоны размеров кристаллов для обработок включают в себя те, которые имеют средний размер кристаллов или «режим» (как измерено и определено с помощью конкретных методик, подробно описанных в настоящем документе и обозначенных как «средний диаметр ПЭМ»), которые преимущественно составляют менее 100 нм и более обычно менее 50 нм, еще более типично менее 30 нм, и во многих из раскрытых здесь предпочтительных вариантов осуществления режим распределения нанокристаллов по размерам составляет менее 21 нм и в еще более предпочтительном диапазоне 8-18 нм.
Полученные нанокристаллические суспензии золота для обработки могут быть обеспечены, которые имеют или отрегулированы так, чтобы иметь целевые диапазоны рН. При получении, например, с усилителем процесса бикарбоната натрия, в количествах, подробно описанных здесь, диапазон рН обычно составляет 8-9, который можно регулировать по желанию. Природа и / или величина поверхностного изменения (т.е. положительного или отрицательного) на сформированных наночастицах или нанокристаллах может оказывать большое влияние на поведение и / или эффекты наночастиц / суспензии или коллоида. Например, белковые короны, такие как альбуминные короны, образованные in vivo у субъекта, могут зависеть от поверхностного заряда или характеристик поверхности наночастицы. Такие поверхностные заряды обычно называют «дзета-потенциалом». Известно, что чем больше дзета-потенциал (положительный или отрицательный), чем выше стабильность наночастиц в растворе (т.е. суспензия более стабильна). Управляя природой и / или количеством поверхностных зарядов сформированных наночастиц или нанокристаллов, можно контролировать характеристики таких суспензий наночастиц.
Дзета-потенциал известен как мера электрокинетического потенциала в коллоидных системах, а также называется поверхностным зарядом на частицах. Дзета-потенциал — это разность потенциалов, которая существует между неподвижным слоем жидкости и жидкостью, в которой диспергирована частица. Дзета-потенциал часто измеряется в милливольтах (то есть мВ). Значение дзета-потенциала приблизительно 20-25 мВ является произвольным значением, которое было выбрано для определения того, является ли дисперсная частица устойчивой в дисперсионной среде. Таким образом, когда здесь делается ссылка на «дзета-потенциал», следует понимать, что упомянутый дзета-потенциал представляет собой описание или количественную оценку величины электрического заряда, присутствующего в двойном слое.
Дзета-потенциал рассчитывается из электрофоретической подвижности по уравнению Генри:
_2ezf (ka) где z — дзета-потенциал, UE — электрофоретическая подвижность, ε — диэлектрическая проницаемость, η — вязкость, flka) — функция Генри. Для приближения Смолуховского (а) = 1,5.
Дзета-потенциалы («ZP») для нанокристаллов золота, полученных в соответствии с описанными здесь способами, обычно имеют ZP, по меньшей мере, -20 мВ, более типично, по меньшей мере, примерно -30 мВ, еще более типично, по меньшей мере, примерно -40 мВ, и еще более типично, по меньшей мере, примерно -50mV.
Суспензии могут быть сконцентрированы до более высоких уровней м.д. (например, до 5000 м.д., но более типично до 3000 м.д.) с использованием методов TFF, обсуждаемых в примере 1 в настоящем документе.
Пример 1
Изготовление золотой наносуспензии «CNM-Au8» для лечения
Тема
В целом, наноспуски CNM-Au8, используемые для целей обработки в примерах 2 и 3, представляют собой концентрированные «аккуратные» наносуспензии CNM-Au8, причем чистый продукт получают с использованием определенных вариантов осуществления изобретения, связанных с устройствами, обычно показанными на фиг. 1, 2C и 3. Все желобчатые элементы 30a ‘и 30b’ на вышеупомянутых фиг. были изготовлены из поликарбоната толщиной 1/8 дюйма (около 3 мм) и поликарбоната толщиной около 1/4 дюйма (около 6 мм) соответственно. Опорная конструкция 34 (не показанная на многих из фиг., Но показанная на фиг. 1) также была изготовлена из оргстекла, толщина которого составляла около 1/4 дюйма (толщина около 6-7 мм). Каждый элемент 30a ‘желоба был неотъемлемой частью элемента 30b лотка. «. Форма поперечного сечения желобчатого элемента 30a», описанная в настоящем документе, соответствует той форме, которая показана на фиг. 4B (то есть был сечение трапециевидной формы). Соответствующими размерами для 30a ‘были «S, S»‘, которые измеряли примерно 1,5 «(примерно 3,81 см),» M «, которые измеряли примерно 2,5» (примерно 6,35 см), «R» измеряли примерно 3/4 «(примерно 1,9 см). ) и «d», который измеряется около ½ дюйма (около 1,3 см).
Каждая часть 30b ‘лоткового элемента имела форму поперечного сечения, соответствующую фиг. 4A. Соответствующие размеры для части 30b ‘желоба указаны в таблице 1 как «М» (т.е. внутренняя ширина желоба у входа и точная часть элемента 30b’ желоба), «LT» (то есть поперечная длина или поток длина желоба 30b ‘), «S» (то есть высота желоба 30b’) и «d» «(то есть глубина жидкости 3» внутри желоба 30b ‘). Толщина каждой части боковой стенки желоба 30b ‘также измеряется толщиной около 1/4 дюйма (около 6 мм).
Вода 3, используемая в качестве входного сигнала в лотковый элемент 30a ‘(то есть используемая в комбинации с усилителем обработки NaHCO3), была получена в процессе деионизации (упоминаемом здесь как деионизированная вода). Использовали деионизационный фильтр со смешанным слоем. Общее количество растворенных растворителей («TDS») после обработки деионизацией составило около 0,2 ч / млн, как измерено измерителем pH / проводимости Accumet® AR20.
Таблица 1
Идентификатор прогона: CNM-Au8
Расход: В (мл / мин) 215
I Set # 1 750
Set #’s 2-8 220
Частота установки 1 -8, Гц 60
ПЭ / концентрация (мкг / мл) 0,54
Диаметр проволоки (мм) 1 .0
^ Контакт «W L » (дюйм / мм) 1 / 25,4
Разделение электродов
«у» (в / мм)
Электрод Конфиг. РИСУНОК. я 7J3

Таблица 1 показывает, что количество усилителя обработки (РЕ) (NaHCCb), которое было добавлено к очищенной воде, составляло примерно 0,54 мг / мл. Следует понимать, что другие количества этого усилителя обработки также действуют в пределах предпочтительного варианта осуществления изобретения. Смесь очищенной воды / NaHCCb использовали в качестве жидкости 3, вводимой в желоб 30а ‘. Глубина «d» ‘жидкости 3’ в элементе 30a ‘желоба (то есть там, где образуется плазма (и) 4) составляла от 7/16 «до примерно 1/2» (от 11 до 13 мм) в различных точках. вдоль желоба 30а ‘. Глубина «d» ‘частично контролировалась с помощью плотины 80 (показанной на фиг. 1). В частности, плотина 80 была расположена рядом с выходным концом 32 желобчатого элемента 30a ‘и помогала в создании глубины «d»‘ (показанный на фиг. 4B как «d»), чтобы иметь глубину около 7/6 «-1 / 2» (около 1-13 мм). Высота плотины 80 составляет около 1/4 дюйма (около 6 мм), а продольная длина составляет около 1/2 дюйма (около 13 мм). Ширина была полностью поперек нижнего размера «R» желобчатого элемента 30a ‘. Соответственно, общий объем жидкости 3 ‘в лотковом элементе 30a’ во время его работы составлял около 2,14 дюйма.От 3 (около 35 мл) до около 0,89 дюйма 3 (около 14,58 мл).
Скорость потока жидкости 3 ‘в лотковый элемент 30a’, а также в лотковый элемент 30b ‘составляла около 215 мл / мин, а скорость вытекания из лоткового элемента 30b’ в точке 32 составляла около 215 мл. / мин. Другие приемлемые скорости потока должны рассматриваться как находящиеся в пределах объема производства предпочтительных нанокристаллических суспензий золота.
Такой поток жидкости 3 ‘был получен при использовании привода насоса Masterflex® L / S 40 с номинальной мощностью 0,1 лошадиных сил, 10-600 об / мин. Номер модели насоса 40 Masterflex® был 7523-80. Привод насоса имел головку насоса, также изготовленную Masterflex®, известную как модель Easy-Load № 77201-60. В общем, напор для насоса 40 известен как перистальтический напор. Точные настройки насоса были 215 миллилитров в минуту. Трубка Tygon® диаметром 1/4 «(т.е. размером 06419-25) была помещена в перистальтическую головку. Трубка была изготовлена компанией Saint Gobain для Masterflex®. Один конец трубки был доставлен на первый конец 31 желоб 30 ‘а.
Из таблицы 1 видно, что был один набор электродов la / 5a. Источником питания для каждого набора электродов 1/5 был трансформатор 60 переменного тока. В частности, фиг. На фиг.5А показан источник 62 мощности переменного тока, подключенный к трансформатору 60. Кроме того, был предусмотрен конденсатор 61, чтобы, например, коэффициенты потерь в цепи можно было регулировать. Выход трансформатора 60 был подключен к электроду (электродам) 1/5 через устройство 20 управления. Предпочтительным трансформатором для использования с устройством примера 1 является трансформатор, в котором используется переменный ток, протекающий в первичной катушке 601, для создания переменного тока. магнитный поток в сердечнике 602, который легко проводит поток.
Когда вторичная катушка 603 расположена рядом с первичной катушкой 601 и сердечником 602, этот магнитный поток связывает вторичную катушку 603 с первичной катушкой 601. Это связывание вторичной катушки 603 индуцирует напряжение на вторичных клеммах. Величина напряжения на вторичных клеммах напрямую связана с отношением витков вторичной катушки к виткам первичной катушки. Больше витков на вторичной катушке 603, чем на первичной катушке 601, приводит к повышению напряжения, а меньшее количество витков приводит к снижению напряжения. Предпочтительные трансформаторы (ы) 60 для использования в процедурах, описанных в настоящем документе, имеют намеренно плохое регулирование выходного напряжения, что стало возможным благодаря использованию магнитных шунтов в трансформаторе 60. Эти трансформаторы 60 известны как трансформаторы с неоновыми знаками. Эта конфигурация ограничивает протекание тока в электрод (ы) 1/5.
Трансформатор 60 рассчитан на его вторичное напряжение холостого хода и ток вторичного короткого замыкания. Напряжение разомкнутой цепи (OCV) появляется на выходных клеммах трансформатора 60 только при отсутствии электрического соединения. Аналогично, ток короткого замыкания поступает от выходных клемм только в том случае, если на этих клеммах имеется короткое замыкание (в этом случае выходное напряжение равно нулю). Однако когда нагрузка подключена к этим же клеммам, выходное напряжение трансформатора 60 должно упасть где-то между нулем и номинальным OCV. Фактически, если трансформатор 60 загружен должным образом, это напряжение будет составлять примерно половину номинального OCV.
Трансформатор 60 известен как сбалансированная средняя точка с привязкой (например, также ранее известная как сбалансированная средняя точка с заземлением). Это чаще всего встречается в трансформаторах среднего и высокого напряжения и в большинстве трансформаторов 60 мА. Это единственный тип трансформатора, приемлемый в системе с обратной связью в средней точке. «Сбалансированный» трансформатор 60 имеет одну первичную катушку 601 с двумя вторичными катушками 603, по одной на каждой стороне первичной катушки 601 (как показано в целом на схематическом виде на фиг. 5B). Этот трансформатор 60 может во многих отношениях работать как два трансформатора. Так же, как несбалансированные сердечник и катушка со средней точкой, один конец каждой вторичной катушки 603 присоединяется к сердечнику 602, а затем к корпусу трансформатора, а другой конец каждой вторичной катушки 603 присоединяется к выходному проводу или клемме. Таким образом,
В цепях переменного тока (AC), имеющих линейный коэффициент мощности 1 (или 100%), напряжение и ток начинаются с нуля, поднимаются до гребня, падают до нуля, переходят к отрицательному гребню и возвращаются к нулю. Это завершает один цикл типичной синусоидальной волны. Это происходит 60 раз в секунду в типичном американском приложении. Таким образом, такое напряжение или ток имеет характеристическую «частоту» 60 циклов в секунду (или 60 герц) мощности. Коэффициент мощности относится к положению формы волны напряжения относительно формы волны тока. Когда оба сигнала проходят через ноль вместе, а их гребни находятся вместе, они находятся в фазе, и коэффициент мощности равен 1 или 100%. РИСУНОК. 5C показывает две формы волны «V» (напряжение) и «C» (ток), которые находятся в фазе друг с другом и имеют коэффициент мощности 1 или 100%; тогда как фиг. 5D показывает две формы волны «
Нормальный коэффициент мощности большинства таких трансформаторов 60 в значительной степени обусловлен влиянием магнитных шунтов 604 и вторичной катушки 603, которые эффективно добавляют индуктор в выходной сигнал цепи 60 трансформатора для ограничения тока на электродах 1/5. Коэффициент мощности может быть увеличен до более высокого коэффициента мощности путем использования конденсатора (ов) 61, размещенного на первичной обмотке 601 трансформатора 60, который приводит входные напряжения и волны тока в большую фазу.
Ненагруженное напряжение любого трансформатора 60, предназначенного для использования в настоящем изобретении, имеет важное значение, а также его внутренняя структура. Желательные ненагруженные трансформаторы для использования в настоящем изобретении включают в себя те, которые имеют напряжение около 9000 вольт, 10000 вольт, 12000 вольт и 15000 вольт. Однако эти конкретные измерения ненагруженного вольт-трансформатора не должны рассматриваться как ограничивающие объем приемлемых источников питания в качестве дополнительных вариантов осуществления. Конкретный желательный трансформатор для использования в описанных здесь процедурах изготовлен Franceformer, каталожный № 9060-PE, который работает при: в основном 120 вольт, 60 Гц; и вторичные 9000 вольт, 60 мА.
Соответственно, трансформатор 60 может быть тем же трансформатором или может быть другим трансформатором (а также другой полярностью). Выбор трансформатора, коэффициента мощности, конденсатора (ов) 61, полярности, конструкции электрода, местоположения электрода, состава электрода, формы поперечного сечения лоткового элемента 30a ‘, локального или глобального состава электрода, атмосферы (ей), локальный или глобальный расход (ы) жидкости 3, локальные компоненты жидкости 3 ‘, объем жидкости 3’, локально подвергаемый воздействию различных полей в лотковом элементе 30a ‘, соседние (например, как выше по потоку, так и ниже по потоку) электроды, локальные концентрации поля, использование и / или положение и / или состав любой мембраны, используемой в элементе желоба и т. д., являются всеми факторами, которые влияют на условия обработки, а также на состав и / или объем компонентов, образующихся в жидкости 3 ‘, нанокристаллы и нанокристаллы / суспензии или коллоиды, полученные в соответствии с различными вариантами осуществления, раскрытыми в данном документе. Соответственно, множество вариантов осуществления может быть осуществлено на практике согласно подробному раскрытию, представленному здесь.
Плазма 4 создавалась с помощью электрода 1, по форме подобного показанному на фиг. 6, и весил около 9,2 грамма. Этот электрод имел чистое золото 99,995%) (4N5). Другой электрод 5а имел золотую проволоку толщиной около 1 мм (99,995%) и погруженный в жидкость около 3 мм примерно на 9 мм. Как показано на фиг. 2A и 2C, выход из лоткового элемента 30a ‘представлял собой кондиционированную жидкость 3’, и эта кондиционированная жидкость 3 ‘текла непосредственно во второй лотковый элемент 30b’. Второй желобчатый элемент 30b ‘, показанный на фиг. 2 A, 2C и 3 имели
результаты измерений приведены в таблице 1. Этот элемент 30b ‘желоба содержал около 885 мл жидкости 3 «. В таблице 1 представлена конфигурация электродов, как показано на фиг. 7 и 3, что означает семь комплектов электродов 5/5’ (показанных на фиг. 7) были расположены, как показано на фиг. 3 (то есть перпендикулярно направлению потока жидкости 3 «). Каждый из наборов электродов 5/5 ‘содержал проволоку из чистого золота 99,99%, диаметр которой составлял около 1,0 мм, как указано в таблице 1. Длина каждого проволочного электрода 5, который находился в контакте с жидкостью 3 «(обозначается как» WL «) в таблице 1) измерено около 1 дюйма (около 25,4 мм). Другие ориентации вписываются в рамки данного раскрытия.
Источник переменного тока (или трансформатор) 501 переменного тока, показанный на фиг. 8, был использован в качестве источника питания. Этот трансформатор 501 переменного тока представлял собой источник переменного тока (Chroma 61604), имеющий диапазон переменного напряжения 0-300 В, частотный диапазон 15-1000 Гц и максимальную номинальную мощность около 2 кВА. Что касается фиг. 2А, 2С и 3, каждый отдельный набор электродов 5/5 ‘(например, набор 2, набор 3 — набор 8 или набор 9) были электрически подключены к источнику питания 501 переменного тока, как показано на фиг. 2А. В частности, источник 501 переменного тока был электрически подключен к каждому набору электродов в соответствии с электрической схемой, показанной на фиг. 2 А.
Таблица 1 относится к каждому из наборов электродов с помощью «Set #» (например, «Set 1» — «Set 8»). Каждый электрод из комплектов электродов 1/5 или 5/5 был настроен на работу при определенном напряжении. Напряжения, указанные в таблице 1, являются напряжениями, используемыми для каждого набора электродов. Также сообщается расстояние «cc» (со ссылкой на фиг. 9) от центральной линии каждого набора электродов до соседнего набора электродов. Кроме того, также сообщается расстояние «х», связанное с каждым используемым электродом 1. Для электрода 5 расстояние «х» не сообщается. Другие соответствующие параметры также приведены в Таблице 1. Все материалы для электродов 1/5 были получены от Hi-Rel по адресу: улица Льюиса, 23, Форт-Эри, Онтарио, Канада, L2A 2P6. Со ссылкой на фиг. 2А, 2С и 3, каждый электрод 5/5 ‘ сначала был введен в контакт с жидкостью 3 «таким образом, что он только что вошел в охватывающую трубку приемника o5. Через определенное время процесса золотой металл удалялся с каждого проволочного электрода 5, что приводило к истончению электрода 5 (т.е. становилось меньше в диаметре), который изменял, например, плотность тока и / или скорость, с которой формировались наночастицы золота. Соответственно, электроды 5 перемещались по направлению к внутренним трубкам приемника o5, в результате чего свежие и более толстые электроды 5 входили в жидкость 3 «на часть его верхней поверхности. По сути, на электродах 5 сформировался эрозионный профиль или сужающийся эффект после того, как прошло некоторое количество времени обработки (т.е. участки проволоки у поверхности жидкости 3 «обычно были толще, чем участки около охватывающих трубок приемника o5) ,
Электроды 5/5 приводились в действие или перемещались со скоростью около 1 дюйма за 8 часов.
Образцы отбирались только из равновесной фазы. Фаза предравновесия происходит потому, что, например, концентрация нанокристаллов, образующихся в жидкости 3 «, увеличивается в зависимости от времени, пока концентрация не достигнет условий равновесия (например, по существу постоянных условий зародышеобразования и роста в устройстве), которые в условиях равновесия остаются по существу постоянными в течение оставшейся части обработки благодаря раскрытым здесь процессам контроля. Фаза предварительного равновесия длится около 30 минут и дает около 1,7 галлона.
Восемь комплектов электродов 1/5 и 5/5 были подключены к устройствам управления 20 через
20g, которая автоматически регулирует высоту, например, каждого электрода 1/5 или 5/5 в каждом наборе электродов. Две охватывающие трубки приемника o5a / o5a ‘- o5g / o5g’ были соединены с нижней частью лоткового элемента 30b ‘таким образом, чтобы электроды в каждом наборе электродов 5/5 можно было вставлять с возможностью съема в каждую охватывающую трубку приемника o5, когда и если желаемый. Каждая внутренняя трубка приемника o5 была изготовлена из поликарбоната и имела внутренний диаметр около 1/8 дюйма.
(около 3,2 мм) и был зафиксирован клеем для растворителя на нижней части лоткового элемента 30b ‘. Отверстия в нижней части лоткового элемента 30b ‘позволяли фиксировать в нем внешний диаметр каждой трубки o5 так, чтобы один конец трубки o5 был заподлицо с поверхностью нижней части лотка 30b’. Нижняя часть трубки o5 загерметизирована. Внутренние диаметры трубок o5 эффективно предотвращали попадание любых значительных количеств жидкости 3 «в охватывающую трубку приемника o5. Однако некоторое количество жидкости может протекать внутрь одной или нескольких охватывающих трубок приемника o5. Длина или вертикальная высота каждой трубки приемника с внутренней резьбой o5 было около 6 дюймов (около 15,24 см), однако более короткие или более длинные длины попадают в рамки и пределы этого раскрытия. при желании В описанном здесь прогоне использовался следующий усилитель обработки. В частности, около 2,04 г / галлон (то есть около 0,54 г / литр) гидрокарбоната натрия («соды»), имеющего химическую формулу NaHCCb, добавляли и смешивали с водой 3. Соду получали от Alfa Aesar и сода имела формулу массой 84,01 и плотностью около 2,159 г / см. при желании В описанном здесь прогоне использовался следующий усилитель обработки. В частности, около 2,04 г / галлон (то есть около 0,54 г / литр) гидрокарбоната натрия («соды»), имеющего химическую формулу NaHCCb, добавляли и смешивали с водой 3. Соду получали от Alfa Aesar и сода имела формулу массой 84,01 и плотностью около 2,159 г / см.3 .
В частности, частота синусоидального переменного тока при 60 Гц была использована для изготовления суспензий нанокристаллов золота в соответствии с изложенными здесь идеями. В источнике переменного тока 501 переменного тока использовался программируемый источник переменного тока Chroma 61604. Приложенное напряжение составляло около 220 вольт. Приложенный ток составлял от 6 до 6,5 А.
Таблица 1 суммирует ключевые параметры обработки, используемые в связи с фиг. 1, 2А и 2С. Кроме того, таблица 1 раскрывает: 1) «Произведенный Au PPM» (например, нанокристалл золота)
концентрации); 2) «Средний диаметр ПЭМ», который представляет собой режим, соответствующий диаметру нанокристалла золота, который встречается наиболее часто, определяемый анализом ПЭМ; и 3) «Гидродинамический радиус», измеренный Zetasizer ZS-90. Эти физические характеристики были выполнены, как обсуждено в другом месте здесь.
Трансмиссионная электронная микроскопия
В частности, образцы ПЭМ были приготовлены с использованием сетки с покрытием Formvar, стабилизированной углеродом, с размером ячеек 200. Сетки были предварительно обработаны плазменной обработкой в вакууме. Сетки помещали на предметное стекло микроскопа, выстланное прямоугольным кусочком фильтровальной бумаги, а затем помещали в вакуумный аппарат Denton с установленным необходимым аксессуаром плазменного генератора. Вакуум поддерживали при 75 мТорр, и плазму инициировали и работали в течение примерно 30 секунд. После завершения система была удалена и решетки удалены. Сетки были стабильными до 7-10 дней в зависимости от условий влажности, но во всех случаях использовались в течение 12 часов.
Приблизительно 1 из суспензии нанокристаллов CNM-Au8 помещали на решетки и оставляли сушиться на воздухе при комнатной температуре в течение 20-30 минут или до испарения капли. После полного испарения сетки помещали на пластину держателя до проведения анализа ПЭМ.
Для опроса всех подготовленных образцов использовался трансмиссионный электронный микроскоп Philips / FEI Tecnai 12. Прибор работал при ускоряющем напряжении 100 кВ. После выравнивания луча образцы были исследованы при различных увеличениях вплоть до 630 000х включительно. Изображения собирались с помощью прилагаемой боковой камеры Olympus Megaview III, которая передавала изображения непосредственно на ПК, оснащенный программным обеспечением iTEM и Tecnai User Interface, которое обеспечивало как управление камерой, так и TEM.
инструмент, соответственно.
РИСУНОК. На фиг.10А показана типичная микрофотография ПЭМ нанокристаллов золота, соответствующих высушенной суспензии CNM-Au8, сделанная в соответствии с процедурами, приведенными выше. РИСУНОК. 10B соответствует измеренному распределению размеров ПЭМ, используемому для расчета среднего диаметра ТЕА и указанному в таблице 1.
измерения pH
Измерения pH проводили с использованием измерителя pH / проводимости Accumet® AR20, в котором датчик pH помещали во флакон на 50 мл, содержащий образцы, представляющие интерес, и давали возможность стабилизироваться. Затем были проведены три отдельных измерения рН и усреднены по образцу. Наносуспензия CNM-Au8 имела измеренный pH около 9,08.
UV-VIS Спектроскопия
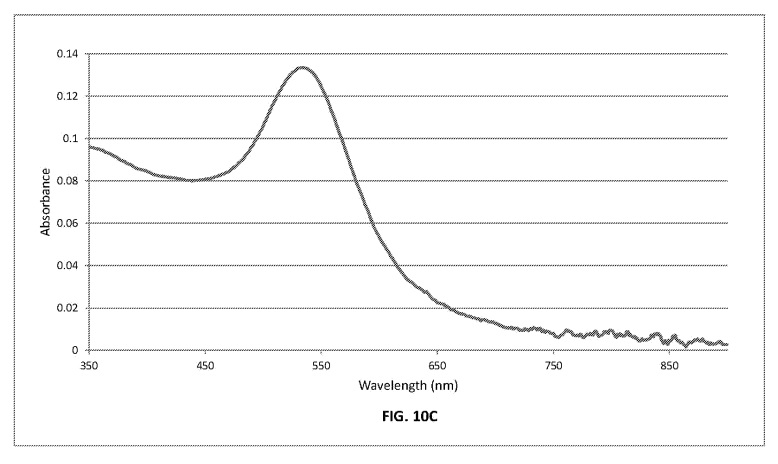
Спектры поглощения энергии были получены для образцов с помощью УФ-VIS-спектроскопии. Эта информация была получена с помощью спектрофотометра Thermo Fisher Evolution 201 UV-VIS, оборудованного двухлучевой монохроматорной системой Черни-Тернера и двойным кремнием.
фотодиоды. Было предоставлено оборудование для измерения жидких образцов с низкой концентрацией с использованием одного из нескольких держателей образцов из плавленого кварца или «кювет». Данные были получены в диапазоне длин волн от 300 до 900 нм со следующими параметрами: полоса пропускания 1 нм, шаг данных 0,5 нм. Ксеноновая импульсная лампа была основным источником энергии. Оптический путь спектрометра был устроен так, чтобы позволить лучу энергии проходить через центр каждой кюветы с образцом. Приготовление образца ограничивалось заполнением и укупоркой кювет, а затем физическим размещением образцов в держателе кюветы в полностью закрытом отсеке для образцов спектрометра. Оптическое поглощение энергии каждого образца было определено. Вывод данных измерялся и отображался в единицах поглощения (по закону Бера-Ламберта) в зависимости от длины волны.
РИСУНОК. МОК показывает спектральные диаграммы UV-Vis для суспензии CNM-Au8 для диапазона длин волн от 350 до 900 нм.
Динамический светорассеивающий Zetasizer
Измерения динамического рассеяния света (DLS) суспензии CNM-Au8 выполняли на приборе Zetasizer Nano ZS-90 DLS. В DLS, когда лазерный свет попадает на мелкие частицы и / или организованные структуры воды вокруг нанокристаллов (меньше, чем
длина волны), свет рассеивается во всех направлениях, что приводит к нестационарным колебаниям интенсивности рассеяния. Флуктуации интенсивности обусловлены броуновским движением комбинации рассеивающих частиц и структуры воды и содержат информацию о распределении кристаллов по размерам.
Прибору давали прогреться в течение не менее 30 мин до экспериментов. Измерения были выполнены с использованием квадратной стеклянной ячейки с длиной пути 1 см, PCS8501. Была использована следующая процедура:
1. Сначала в ячейку добавляли 1 мл деионизированной воды с использованием 1 мл микропипетки, затем воду выливали из ячейки в стакан для отходов и оставшуюся воду стряхивали из измерительной полости ячейки. Этот шаг был повторен еще два раза, чтобы тщательно промыть ячейку.
2. 1 мл образца добавляли в ячейку с использованием 1 мл микропипетки. После этого вся жидкость была удалена из ячейки с помощью той же пипетки с использованием того же наконечника пипетки и выброшена в стакан для отходов. 1 мл образца был добавлен снова, используя тот же наконечник.
3. Ячейка с образцом была помещена в блок с контролируемой температурой ячейки
Инструмент Zetasizer с выгравированной буквой, обращенной вперед. Новый эксперимент в программном обеспечении Zetasizer был открыт. Измерение начинали через 1 мин после уравновешивания температуры и ослабления мощности лазера до надлежащего значения. Результаты были сохранены после завершения всех прогонов.
4. Ячейка была извлечена из прибора, и образец был извлечен из ячейки с использованием той же пипетки и наконечника, который использовался при выполнении шага 2.
5. Шаги 2-4 повторяли еще два раза для каждого образца.
6. Для нового образца был взят новый наконечник для пипетки объемом 1 мл, чтобы избежать загрязнения предыдущим образцом, и шаги с 1 по 5 были повторены.
Сбор и обработка данных проводились с использованием программного обеспечения Zetasizor, версия 6.20. Для всех экспериментов были использованы следующие параметры: продолжительность прогона — 2o; Эксперименты — 10; Растворитель — вода, 0 ммоль; Вязкость — 0,8872 сП; Показатель преломления — 1,333; блок
температура — + 25 ° С. После сохранения данных для каждого эксперимента результаты просматривались на странице «Просмотр записей» программного обеспечения. Распределение частиц по размерам (т.е. гидродинамические радиусы) анализировали на графике «PSD интенсивности». Методы динамического рассеяния света были использованы для получения индикации размеров кристаллов (например, гидродинамических радиусов), полученных в соответствии с этой процедурой. Гидродинамический радиус представлен в таблице 1 как 19,43 нм. Кроме того, измеренный дзета-потенциал чистой наночастицы CNM-Au8 составлял -42,9 мВ. Атомно-абсорбционная спектроскопия
Значения AAS были получены из спектрометрической системы Perkin Elmer AAnalyst 400. Атомно-абсорбционная спектроскопия используется для определения концентрации видов, выраженной в «ppm» (частей на миллион).
Я) принцип
Техника пламенной атомно-абсорбционной спектроскопии требует аспирации жидкого образца, его аэрозолизации и смешивания с горючими газами, такими как ацетилен и воздух. Смесь зажигается в пламени, температура которого колеблется от примерно 2100 до примерно 2400 градусов С. Во время горения атомы интересующего элемента в образце восстанавливаются до свободных невозбужденных атомов основного состояния, которые поглощают свет на характерных длинах волн. Характерные длины волн являются специфическими для каждого элемента и имеют точность от 0,01 до 0,1 нм. Для обеспечения конкретных длин волн элемента световой луч от лампы с полым катодом (HCL), катод которой изготовлен из определяемого элемента, пропускают через пламя. Фотодетектор обнаруживает уменьшение интенсивности света из-за поглощения аналитом. Монохроматор используется перед фотоприемником, чтобы уменьшить фоновое окружающее освещение и выбрать конкретную длину волны из HCL, необходимого для обнаружения. Кроме того, дуговая дейтериевая лампа корректирует поглощение фона, вызванное неатомными веществами в атомном облаке.
II) пробоподготовка
10 мл образца, 0,6 мл 36% по объему соляной кислоты и 0,15 мл 50% по объему азотной кислоты смешивают вместе в стеклянном флаконе и инкубируют в течение примерно 10 минут на водяной бане при 70 ° С. Если ожидается, что концентрация золота в суспензии будет выше 10 ч / млн, образец разбавляют деионизированной водой перед добавлением кислот, чтобы довести конечную концентрацию золота в диапазоне от 1 до 10 ч / млн. Например, для концентрации золота около 100 млн -1 образец 0,5 мл разбавляют 9,5 мл деионизированной воды перед добавлением кислот. Аликвотирование выполняется с помощью регулируемых микропипеток, а точное количество образца, деионизированной воды и кислот измеряется микробалансом Ohaus PA313. Вес компонентов используется для корректировки измеренной концентрации для разбавления деионизированной водой и кислотами.
Каждый образец готовят в трех экземплярах и после инкубации в водяной бане дают возможность остыть до комнатной температуры перед проведением измерений. III) Настройка прибора
Для спектрометра Perkin Elmer AAnalyst 400 используются следующие настройки:
a) Головка горелки: однослотовый тип 10 см, выровненный по трем осям в соответствии с процедурой изготовления, чтобы получить максимальную поглощающую способность по стандарту Cu 2ppm.
б) Небулайзер: пластик с проставкой перед ударным валиком.
в) Расход газа: расход окислителя (воздуха) около 12 л / мин, расход топлива (ацетилена) около 1,9 мл / мин.
d) Лампа / монохроматор: Au лампа с полым катодом, рабочий ток 10 мА, щели 1,8 / 1,35 мм, длина волны 242,8 нм, коррекция фона (дейтериевая лампа) включена.
IV) Процедура анализа
a) Запустите лампу Au и пламя примерно на 30 минут, чтобы прогреть систему.
б) Откалибруйте прибор по стандартам lppm, 4ppm и lOppm Au в матрице из 3,7% об. / об. соляной кислоты. Используйте 3,7% по объему соляной кислоты в качестве бланка.
c) Проверьте калибровочную шкалу, измерив стандарт 4ppm в качестве образца. Измеренная концентрация должна составлять от 3,88 до 4,12 промилле. Повторите шаг б), если он находится за пределами этого диапазона.
г) Измерьте три копии образца. Если стандартное отклонение между репликами превышает 5%, повторите измерение, в противном случае переходите к следующему образцу.
e) Выполните этап проверки c) после измерения шести образцов или чаще. Если проверка не удалась, выполните шаги b) и c) и повторно измерьте все образцы, измеренные после последней успешной проверки.
V) Анализ данных
Измеренное значение концентрации для каждой реплики корректируется для разбавления водой и кислотой для расчета фактической концентрации образца. Сообщаемое значение Au ppm является средним из трех скорректированных значений для отдельной реплики.
Таблица 1 ссылается на результат концентрации AAS как «Произведенный Au PPM», с соответствующим значением около 7.2ppm.
Тангенциальная фильтрация потока (TFF)
Чтобы увеличить концентрацию нанокристаллов золота, полученных в чистой наночастице CNM-Au8 для использования в примерах 2 и 3, был использован процесс фильтрации в тангенциальном потоке (TFF). Концентрация в процессе TFF представляет собой процесс разделения, управляемый давлением, в котором используются мембраны для удаления преимущественно жидкости, содержащей суспензию, из нанокристаллов в суспензии. Таким образом, процесс TFF приводит к относительно более высокой концентрации нанокристаллов золота в жидкости на одной стороне мембраны. В процессе TFF суспензия CNM-Au8 тангенциально перекачивается вдоль поверхности мембраны. Схема простой системы TFF показана на фиг. 11.
Загрузочный резервуар 1001 подавал суспензию CNM-Au8 в питающий насос 1002 и в модуль 1003 фильтрации. Поток 1004 фильтрата отбрасывали. Ретентат отводили через ретентатный клапан 1005 и возвращали как 1006 в питающий резервуар 1001. Во время каждого прохода суспензии по поверхности мембраны в фильтрующем модуле 1003 приложенное давление пропускало порцию жидкости, содержащей суспензию, через мембрана и в поток фильтрата, 1004. Нанокристаллы золота слишком велики, чтобы проходить через мембрану, и, таким образом, удерживаются в верхнем потоке и перемещаются тангенциальным потоком в ретентат, 1006. Ретентат, имеющий более высокую концентрацию золота нанокристаллы, были возвращены обратно в питающий резервуар, 1001. Если в питающий резервуар не добавлен диафильтрационный буфер, то объем жидкости в питающем резервуаре,
В этом примере использовались кассеты Millipore Pellicon XL с целлюлозными мембранами MWCO 5 кДа и 10 кДа. Давление в ретентате было установлено равным 40 фунт / кв.дюйм с помощью клапана для ретентата, 1005. Мембрана 10 кДа позволила приблизительно в 4 раза повысить скорость потока фильтрата по сравнению с мембраной 5 кДа при том же трансмембранном давлении, что ожидается для большего размера пор. В то же время поры мембраны 10 кДа достаточно малы, чтобы удерживать все сформированные нанокристаллы золота в ретентате, тем самым концентрируя нанокристаллы золота в суспензии CNM-Au8. После прохождения суспензии CNM-Au8 через систему TFF была достигнута желаемая концентрация суспендированных нанокристаллов золота в суспензии CNM-Au8, которая увеличилась с примерно 7,2 ч / млн до примерно 51 ч / млн (для примера 2);
Сконцентрированная нанокристаллическая суспензия CNM-Au8 была охарактеризована как по гидродинамическому радиусу, так и по дзета-потенциалу, чтобы определить, влияла ли ступень концентрации на какое-либо значение. Для суспензий из Примера 2 измеренный дзета-потенциал концентрированной наносуспензии CNM-Au8 (51 ppm) составлял примерно -45,5 мВ, а измеренный гидродинамический радиус составлял примерно 18 нм. Для суспензий из примера 3 измеренный дзета-потенциал концентрированной наносуспензии CNM-Au8 (50 ppm) составлял примерно -43,6 мВ, а измеренный гидродинамический радиус составлял примерно 18,6 нм; и измеренный дзета-потенциал концентрированной наноподвески CNM-Au8 (100 м.д.) составлял примерно -47,2 мВ, а измеренный гидродинамический радиус составлял примерно 20,1 нм. Соответственно, этап концентрации не оказывал неблагоприятного воздействия ни на один из этих важных параметров физической характеристики.
Подробные методы получения и подробные физические характеристики чистых суспензий CNM-Au8 можно найти в международной заявке PCT / US2010 / 041427, опубликованной 3 октября 2013 г. и озаглавленной «Новые нанокристаллы на основе золота для медицинских процедур и электрохимических производственных процессов для них». весь предмет изобретения настоящим включен в качестве ссылки.
Способы использования наносуспензий золота (предпочтительно CNM-Au8) в качестве методов лечения
Один вариант осуществления настоящего изобретения предоставляет способы предотвращения
демиелинизация или дисмиелинизация и / или стимулирование миелинизации или ремиелинизации нейронов, включая нейроны ЦНС и / или нейроны ПНС. Для целей способов настоящего изобретения элементные наносуспензии кристаллов золота могут облегчать ингибирование ЦНС
миелинизация и / или стимулирование выживания нейрональных клеток ЦНС и / или уменьшение или ингибирование экспрессии некоторых антагонистов. В предпочтительном варианте осуществления нанокристаллические суспензии CNM-Au8 из примера 1 используются с такими способами.
Дополнительные варианты осуществления изобретения включают способ стимулирования миелинизации нейронов (включая нейроны ЦНС) у млекопитающего, включающий введение млекопитающему, при необходимости, эффективного количества (терапевтического или профилактического) композиции, включающей элементную наносуспензию кристаллов золота. В предпочтительном варианте осуществления CNM-Au8
нанокристаллические суспензии примера 1 используют с такими способами.
Дополнительный вариант осуществления настоящего изобретения обеспечивает способы лечения заболевания, расстройства, патологического состояния и / или повреждения, связанного с дисмиелинизацией или демиелинизацией, у животного (например, млекопитающего), страдающего от такого состояния, причем способ включает, по существу, состоящий из или состоящий из введения млекопитающему, нуждающемуся в этом, терапевтически эффективного количества наночастицы кристалла золота, и в предпочтительном варианте осуществления используются нанокристаллические суспензии CNM-Au8 из примера 1. Другие варианты осуществления изобретения включают в себя способы стимулирования выживания нейронов ЦНС и / или нейронов ПНС у млекопитающего, нуждающегося в этом, включающие введение эффективного количества наносуспензии кристалла золота. В предпочтительном варианте осуществления нанокристаллические суспензии CNM-Au8 из примера 1 используются с такими способами.
Дополнительные варианты осуществления изобретения включают в себя способы стимулирования дифференцировки олигодендроцитов у млекопитающего, включающие введение млекопитающему, нуждающемуся в этом, эффективного количества композиции, содержащей наносуспензию кристаллов золота. В предпочтительном варианте осуществления нанокристаллические суспензии CNM-Au8 из примера 1 используются с такими способами.
Дополнительные варианты осуществления изобретения включают способы уменьшения или ингибирования экспрессии поврежденного миелина, демиелинизации или дисмиелинизации относительно отсутствия обеспечения эффективного количества суспензии нанокристаллического золота, включающие модификацию миелинизации нейронов (ЦНС и / или ПНС) композицией содержащий эффективное количество (как профилактическое, так и терапевтическое) суспензии нанокристаллов золота. В предпочтительном варианте осуществления нанокристаллические суспензии CNM-Au8 из примера 1 используются с такими способами.
Дополнительные варианты осуществления изобретения включают в себя способы ингибирования или уменьшения нежелательных патологических событий, связанных с повреждением миелина, при отсутствии эффективного количества нанокристаллической суспензии CNM-Au8 из примера 1, включающей предоставление субъекту, нуждающемуся в этом, композиции, содержащей CNM. -Au8 наносуспензия.
В способах лечения по настоящему изобретению нанокристаллические суспензии, предпочтительно нанокристаллические суспензии CNM-Au8, можно вводить пероральным введением, инъекциями и / или назально.
В некоторых вариантах осуществления наносуспензия CNM-Au8 может вводиться путем болюсной инъекции или хронической инфузии. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить непосредственно в центральную нервную систему, например, путем интратекального или эпидурального введения. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить непосредственно в хроническое поражение, где выражено повреждение миелина. В некоторых вариантах осуществления наносуспензия CNM-Au8 может быть введена непосредственно в кровоток млекопитающего.
В определенных вариантах осуществления изобретения наночастицы золота и предпочтительно
Некристаллические суспензии CNM-Au8 вводят / применяют для лечения заболевания, которое включает в себя прогрессирующий надъядерный паралич, болезнь Александра, болезнь Краббе, метахроматическую лейкодистрофию, болезнь Канвана, лейкодистрофию, энцефаломиелит, миелолиз центральных понтийных желез (CPM), анти-MAG, анти-миелолиз (CPM), Болезнь Пелизея-Мерцбахера, болезнь Рефсума, синдром Кокейна, синдром Зеллвегера, синдром Гийена-Барре (GBS), синдром Ван-дер-Кнаппа, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), мультифокальная моторная невропатия (MMN), невротический невротический анамнез, неврологический синдром, невротический неврит, невралгия Мультифокальная
Лейкоэнцефалопатия (ПМЛ), дегенерация валерианы и некоторые наследственные заболевания, такие как
Адренолейкодистрофия, болезнь Александра, легкое когнитивное нарушение (MCI), также известное как возрастное снижение когнитивных функций и болезнь Пелизея Мерцбахера (PMZ). Золото
Нанокристаллическая суспензия может быть приготовлена и использована в качестве терапевтического агента, который останавливает, уменьшает, предотвращает или ингибирует способность повредить события, приводящие к дисмиелинизации, демиелинизации и / или тем событиям, которые негативно регулируют миелинизацию и / или выживание нейронов и / или увеличивают экспрессию хорошего миелина (например, ремиелинизация) или хороших взаимодействий миелин / аксон.
Один вариант осуществления настоящего изобретения обеспечивает способы лечения у субъекта заболевания, расстройства или повреждения, связанного с дисмиелинизацией или демиелинизацией (например, neuromyelitis optica у субъекта, страдающего от такого заболевания), причем способ включает, состоящий, по существу, или состоящий из введение субъекту терапевтически эффективного количества наносуспензии золота и, в предпочтительном варианте, наносуспензии CNM-Au8 путем титрования до клинического эффекта путем изменения концентрации, объема и / или частоты дозирования.
Кроме того, изобретение направлено на способ стимулирования миелинизации нейронов (включая ремиелинизацию) у млекопитающего, включающий, состоящий, по существу, или состоящий из введения эффективного количества (как терапевтического, так и профилактического) наносуспензии золота, и, предпочтительно, CNM- Наносуспензия Au8.
Дополнительный вариант осуществления настоящего изобретения обеспечивает способы лечения заболевания, расстройства или повреждения, связанного со смертью олигодендроцитов или отсутствием дифференцировки, например, neuromyelitis optica, болезнью Pelizaeus Merzbacher или лейкодистрофией глобоидных клеток (болезнь Краббе), у животного, страдающего от такого заболевания при этом способ включает, по существу, состоит из введения или состоит из введения эффективному количеству наносуспензии золота и, в предпочтительном варианте, наносуспензии CNM-Au8.
Другой аспект изобретения включает способ стимулирования пролиферации, дифференцировки и выживания олигодендроцитов у млекопитающего, включающий, состоящий, по существу, или состоящий из введения терапевтически эффективного количества наносуспензии золота и, в предпочтительном варианте, наносуспензии CNM-Au8. ,
Наносуспензия золота и, в предпочтительном варианте, наносуспензия CNM-Au8, предназначенная для использования в описанных здесь способах лечения, может быть приготовлена и использована в качестве терапевтического средства, которое останавливает, уменьшает, предотвращает или ингибирует способность патологических событий, которые негативно регулируют миелинизацию нейронов олигодендроцитами. Кроме того, наносуспензия золота и, предпочтительно, наносуспензия CNM-Au8, предназначенная для использования в описанных здесь способах лечения, может быть приготовлена и использована в качестве терапевтического средства, которое останавливает, уменьшает, предотвращает или ингибирует способность патологических явлений негативно регулировать олигодендроцит. дифференциация, распространение и выживание.
Дополнительные варианты осуществления изобретения включают способ индукции пролиферации или выживания олигодендроцитов для лечения заболевания, расстройства или повреждения, включающего разрушение олигодендроцитов или миелина, включающий доставку млекопитающему, в или около места заболевания, расстройства или повреждения, нанокристаллов золота из наносуспензии CNM-Au8 в количестве, достаточном для уменьшения ингибирования удлинения аксонов и / или стимуляции миелинизации и / или улучшения демиелинизации.
В способах лечения по настоящему изобретению наносуспензии золота можно вводить перорально, инъекциями и / или назально.
В некоторых вариантах осуществления изобретения наночастица золота и, предпочтительно, CNM-Au8
наносуспензия, может вводиться путем болюсной инъекции или хронической инфузии. В некоторых
В некоторых вариантах осуществления наносуспензия CNM-Au8 может быть введена непосредственно в центральную нервную систему, например, путем интратекального или эпидурального введения. В некоторых вариантах осуществления наносуспензию CNM-Au8 можно вводить непосредственно в хроническое поражение, где выражено повреждение миелина. В некоторых вариантах осуществления наносуспензия CNM-Au8 может быть введена непосредственно в кровоток млекопитающего
Заболевания или расстройства, которые можно лечить или облегчать способами по настоящему изобретению, включают заболевания, расстройства или травмы, которые связаны с дисмиелинизацией или
демиелинизация нейронов млекопитающих. В частности, такие заболевания и расстройства включают те, при которых миелин, окружающий нейрон, либо отсутствует, либо неполный, не сформирован должным образом или ухудшается. Такие заболевания включают, но не ограничиваются, прогрессирующим
Супрануклеарный паралич, болезнь Александера, болезнь Краббе, метахроматическая лейкодистрофия, болезнь канвана, лейкодистрофии, энцефаломиелит, миелолиз центрального понта (СРМ), болезнь анти-MAG, болезнь Пелизеус-Мерцбахнд-Синдром, синдром Баржелезного синдрома, синдром Баржелезного зоба, синдром Баржелезного синдрома, синдром Баржелезного синдрома, синдром Баржелезного зоба, синдром Баржелезного ореха, синдром Баржелезного ореха, синдром Барбариса, Синдром Баржума (GBS), синдром Ван дер Кнаппа, хроническая воспалительная демиелинизирующая полиневропатия (CIDP), многоочаговая моторная невропатия (MMN), нейромиелит зрительный (NMO), прогрессирующая мультифокальная лейкоэнцефалопатия (PML), легкое когнитивное нарушение (MCI), также известное как возрастная когнитивная когнитивная функция Wallerian Degeneration и некоторые наследственные заболевания, такие как Adrenoleukodystrophy, Alexander’s Disease и Pelizaeus Merzbacher Disease (PMZ).
Заболевания или расстройства, которые можно лечить или облегчать способами по настоящему изобретению, включают заболевания, расстройства или травмы, которые связаны со смертью или отсутствием пролиферации или дифференцировки олигодендроцитов. Такие заболевания включают, но не ограничиваются ими, прогрессирующий надъядерный паралич, болезнь Александра, болезнь Краббе, метахроматическую лейкодистрофию, болезнь канвана, лейкодистрофию, энцефаломиелит, миелолиз центральной части понты (СРМ), болезнь против MAG, болезнь пелизе, мербактериоз, мерзлоту кишечника Синдром Коккейна, синдром Зеллвегера, синдром Гийена-Барре (GBS), синдром Ван-дер-Кнаппа, хроническая воспалительная демиелинизирующая полинейропатия (CIDP), мультифокальная моторная невропатия (MMN), Neuromyelitis Optica (NMO), прогрессирующая мультифокальная лейкоэнцефалопатия, прогрессирующая мультифокальная лейкоэнцефалопатия
Дегенерация и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александра и болезнь Пелизея Мерцбахера (ПМЗ). ,
Заболевания или расстройства, которые можно лечить или облегчать способами по настоящему изобретению, включают нейродегенеративное заболевание или расстройства. Такие заболевания включают, но не ограничиваются ими, прогрессирующий сверхъядерный паралич, болезнь Александра, болезнь Краббе,
Метахроматическая лейкодистрофия, болезнь Канвана, лейкодистрофии, энцефаломиелит, миелолиз центрального понтона (CPM), болезнь Anti-MAG, болезнь Пелизеуса-Мерцбахера, болезнь Рефсума, синдром Коккейна, синдром Зеллвегера, синдром Зендвегера, синдром Вендрома, синдром Гиллеза, синдром Гиллеза, синдром Зелдегера, синдром Зелла-Генделла, синдром Зелл-Гендера, синдром Зелл-Гендера, синдром Зелль-Гендена, Гилла Легкое когнитивное нарушение (MCI), также известное как возрастное снижение когнитивных функций, хроническая воспалительная демиелинизирующая полиневропатия (CIDP), многоочаговая моторная невропатия (MMN), Neuromyelitis Optica (NMO), прогрессивный мультифокальный
Лейкоэнцефалопатия (ПМЛ), дегенерация Валлера и некоторые наследственные заболевания, такие как адренолейкодистрофия, болезнь Александера и болезнь Пелизея Мерцбахера (ПМЗ).
Примеры дополнительных заболеваний, расстройств или травм, которые можно лечить или облегчать способами по настоящему изобретению, включают, но не ограничиваются ими, повреждения спинного мозга, хроническую миелопатию или редикулопатию, травматическое повреждение головного мозга, болезнь двигательных нейронов, сдвиг аксонов, ушибы. , паралич, пострадиационное повреждение или другие неврологические
осложнения химиотерапии, инсульт, большие лакуны, окклюзии средних и крупных сосудов, лейкоариоз, острая ишемическая зрительная невропатия, дефицит витамина Е (синдром изолированного дефицита, АР, синдром Бассена-Комцвейга), B12, B6 (пиридоксин-пеллагра), тиамин, фолат дефицит никотиновой кислоты, синдром Marchiafava-Bignami, метахроматическая лейкодистрофия, невралгия тройничного нерва, паралич Белла или любое невральное повреждение, которое потребовало бы регенерации аксонов, ремиелинизации или выживания или дифференцировки / пролиферации олигодендроцитов.
Пример 2
Модель демиелинизации купризона — экспериментальное исследование на 16 мышах
Цель этого экспериментального исследования состояла в том, чтобы определить, могут ли нанокристаллические суспензии «CNM-Au8» концентрироваться до 51 ч / млн и потребляться ad libitum, влиять на количество или степень повреждения (или восстановления) миелиновой оболочки, которое обычно происходит во время индуцированной купризоном демиелинизации нейронов в Мышиный мозг. Модель мыши Cuprizone предназначена для имитации повреждения миелиновой оболочки у млекопитающих при множественных заболеваниях, которые патологически выражают себя как демиелинизацию или дисмиелинизацию.
В общей сложности 16 самцов мышей C57BL6 были разделены на 4 группы (по четыре на группу), как показано в таблице 2. Две дополнительные мыши были использованы в качестве резервного и не требовались в исследовании. Мышам было 8 недель в начале исследования.
В попытке вызвать демиелинизацию путем введения токсичного купризона и наблюдать возможное снижение демиелинизации и / или стимулирование ремиелинизации путем обработки наносуспензиями золота, две из четырех групп получали корм с купризоном в течение 5 недель. Наносуспензии CNM-Au8 (концентрация нанокристаллов золота 51 ppm) предоставлялись ad libitum (в качестве единственной питьевой жидкости для мышей) для всех мышей в группах 3 и 4 (как для лечения, так и для контроля), как показано в таблице 2. Все мыши были наблюдается во время исследования, и любое ненормальное поведение будет записано.
Всех мышей умерщвляли через 5 недель исследования, как показано в таблице 2. В каждой из четырех групп предварительно определенную область мозга у трех из четырех мышей фиксировали для иммуноокрашивания (например, для определения относительного количества миелина). настоящее время). В частности, площадь короны от брегмы-0,82 мм до брегмы-1,82 мм является областью, представляющей основной интерес для этой модели на животных. 1 ‘ 2 Эти участки головного мозга для трех из четырех мышей в каждой группе окрашивали на присутствие протеина липида миелина («PLP»), как обсуждалось в литературе. 3 Результаты окрашивания показаны на фиг. 13 А-13С. Мозг четвертой мыши в каждой группе был обработан по-разному и специально подготовлен для исследований с помощью просвечивающей электронной микроскопии («TEM»).
Область мозолистого тела мозга в большой степени заполнена аксонами, и эта область была областью внимания для исследований ТЕА. По меньшей мере, девять типичных изображений ПЭМ аксонов / миелиновых оболочек, взятых из области мозолистого тела, показаны на фиг. 14A-14D для одной мыши из каждой из групп 1-4 соответственно. По меньшей мере, девять изображений ПЭМ представлены на каждой из фиг. 14A-14D, чтобы показать наблюдаемые типичные изменения аксона / миелина в мозолистом теле для каждого мозга мыши. Результаты, показанные на фиг. 13 A-13C и 14A-14D из этого исследования показывают, что нанокристаллические суспензии CNM-Au8 благоприятно влияют на степень повреждения миелина и / или восстановления миелина в мозге мыши в наблюдаемых областях между брегмой-0,82 мм до брегмы-1,82 мм (например, сравните фиг.14B, группа 2 с фиг.14D, группа 4); и имеет большое значение,
Материалы и методы
Подготовка животных и индукция демиелинизации
Самцов мышей C57BL6 получали от Harlan Labs. Всех мышей наблюдали за 7-11 дней до начала 5-недельного исследования. Мышей подвергали обычному содержанию в клетке один раз в неделю, контролировали изменения поведения и взвешивали один раз в неделю как до, так и в течение 5-недельного исследования. РИСУНОК. 19 показывает среднее увеличение веса во время исследования на одну мышь для каждой из групп 1-4. Мышам во всех группах было разрешено есть и пить столько, сколько пожелали. В частности, все пищевые суспензии, вода и суспензии для обработки CNM-Au8 (51 млн. Долей золота) предоставлялись ad libitum. Количество потребляемой воды и суспензии для обработки CNM-Au8 регистрировали ежедневно. Среднее количество жидкости, потребляемой каждый день для мышей в каждой из групп 1-4, показано на фиг. 18. Ежедневно давали пресную воду и свежие наносуспензии CNM-Au8.
Демиелинизацию индуцировали путем скармливания 8-недельных кормовых гранул мышей C57BL6, содержащих 0,2% купризона (бис-циклогексанона оксалдигидразона) (в настоящем документе упоминается как
«Cuprizone Feed»), полученный от Harlan Labs (TD 06172) и предварительно смешанный в стандартные кормовые гранулы. Гранулы контрольного корма меняли еженедельно, в то время как корм Купризона меняли каждые 48 часов. Подача купризона обеспечивалась в течение пятинедельного периода времени для мышей в группах 2 и 4 в соответствии с таблицей 2. Для каждой из четырех групп использовался размер группы из четырех мышей, при этом на каждую клетку содержалось только 2 мыши. агрессивной природе этих самцов мышей.
В этом пилотном исследовании мышей анестезировали, используя пентобартитал натрия (80 мг / кг), вводя пентобартитал натрия в брюшину с помощью иглы диаметром 0,5 дюйма 27 калибра. Чтобы минимизировать ишемию головного мозга, этапы перфузии начинали сразу после того, как каждая мышь была без сознания. Использовали два разных набора перфузионных буферов, в зависимости от того, подвергался ли мозг мыши иммуноокрашиванию или микрофотографии с помощью ПЭМ. Для перфузии, связанной с иммуноокрашиванием, использовали всего 50 мл холодного солевого раствора (0,9% NaCl в дН 20), после чего в общей сложности 150 мл фиксатора (4% параформальдегида («PFA»)) при 4 ° C последовательно пропускали в циркуляцию мыши через перистальтический насос. При перфузии, связанной с просвечивающей электронной фотомикроскопией, аналогичным образом использовали 50 мл холодного солевого раствора, а затем всего 150 мл фиксатора (3,5% PFA, 1,5% глутаральдегид в 0,1 М какодилате). Перистальтический насос доставлял каждую жидкость со скоростью около 8-10 мл / мин. Были предприняты меры, чтобы избежать образования пузырьков воздуха в трубке перистальтического насоса на протяжении всего этапа перфузии.
Для достижения достаточной перфузии правое предсердие каждого сердца мыши разрезали маленькими ножницами. Затем в верхушку левого желудочка была вставлена игла-бабочка, и насос начал перекачивать вышеупомянутые жидкости, в то время как правую часть желудочка каждого сердца осторожно удерживали пинцетом. Мозг от трех мышей в каждой группе был подготовлен для установки парафиновых блоков (для иммуноокрашивания), в то время как один мозг мыши из каждой группы был подготовлен для микрофотоснимков ПЭМ. После того как каждый мозг мыши был удален, каждый после этого был зафиксирован в предварительно подготовленных холодных (4 ° C) буферах соответственно, и либо погружен в парафин для иммуноокрашивания, либо в смолу для фотомикроскопии ТЭМ, в соответствии с литературой. 4
Таблица 2
Питьевой

Рацион питания
Питьевой

Рацион питания

иммуногистохимия
Для иммуноокрашивания PLP были изготовлены серийные коронарные срезы головного мозга толщиной 7 мкм между брегма-0,82 мм и брегма-1,82 мм (согласно атласу мыши Paxinos и Franklin 3 ) с использованием специального держателя, показанного на фиг. 12A и 12B, и затем были проанализированы.
В частности, каждый мозг мыши сначала был встроен в агаровый блок. Около 40 г порошка агара (триптический соевый агар, REF 236950, BD) тщательно смешивали с примерно 1 литром очищенной воды, затем смесь нагревали при частом перемешивании и кипятили в течение примерно 1 минуты до полного растворения порошка. Форма 301 была установлена в основании 302, как показано на фиг. 12А. Мозг мыши затем помещали в форму для сидения 301. Когда температура нагретой смеси агара и воды остыла до чуть выше комнатной температуры, форму для сидения 301 заполняли. Приблизительно через 2-3 минуты форму 301 подняли с основания 302 и сформировали агаровый блок, содержащий мозг.
Блок агара затем помещали в держатель 303, и участок мозга, соответствующий головке каждой мыши, располагали так, чтобы он был обращен к режущей кромке 304. Как показано на фиг. 12B, держатель 303 затем перемещали в направлении положения мозга, соответствующего хвосту мыши, и располагали в положении, которое соответствовало bregma-0,82, и мозг разрезали вдоль режущей кромки 304 лезвием. Держатель 303 затем перемещали примерно на 1 мм в направлении хвостовой части мозга, а затем режущую кромку 304 устанавливали при брегме -1,82. Затем мозговой блок снова разрезали на режущей кромке 304 тем же лезвием, что приводило к срезу толщиной 1 мм между bregma-0,82 и -1,82.
В соответствии с методами, упомянутыми ранее 3 , погруженные в парафин срезы депарафинировали, повторно гидратировали, помещая в стеклянный контейнер, частично заполненный 10 мМ цитратным буфером (рН 6,0), и затем нагревали в микроволновой печи в обычной бытовой микроволновой печи мощностью 1,65 кВт до буфер начал кипеть. Затем срезы мозга гасили 0,3% H2O2, блокировали в течение примерно 1 часа. в PBS, содержащем 3% нормальной лошадиной сыворотки и 0,1% Triton X-100. Затем срезы головного мозга инкубировали при 4 ° С в течение ночи в контакте с первичным антителом против PLP, а именно с мышиным IgG (от AbD Serotec), с коэффициентом разведения около 1: 500. Мышиный IgG был выбран в качестве основного антитела, потому что в мозге мыши почти нет IgG, за исключением твердой мозговой части.
После промывания промывочным буфером (буфер PBS, рН 7,4) срезы коронкового мозга дополнительно инкубировали с биотинилированным вторичным антителом против мышиного IgG (приобретенным в Vector Laboratories) в течение примерно 1 часа с последующим воздействием связанного с пероксидазой комплекса авидин-биотин ( ABC Kit, Vector Laboratories) около 30 минут. Затем материал, который, как известно, реагирует с связанным с пероксидазой комплексом авидин-биотин, называемый диамино-3,3 ‘бензидин («DAB», Vector Laboratories), был приведен в контакт с срезами мозга, так что каждый из срезов изменился цвет где-то между светло-коричневым цветом до темно-коричневого цвета, в зависимости от степени реакции, которая произошла между связанным с пероксидазой комплексом авидин-биотина и DAB. Более темный коричневый цвет соответствовал присутствию большего количества миелина. РИСУНОК. 13B показывает типичное окрашенное миелином сечение коронкового мозга для мыши в каждой из групп 1-4. Для определения общего размера ареала каждого наблюдаемого среза мозга (т.е. общей площади поперечного сечения всего вещества мозга, присутствующего на каждом предметном стекле) дополнительные серийные образцы предметного стекла, расположенные рядом с окрашенными в коричневый цвет срезами, окрашивали обоими PLP. антитело (как обсуждалось выше), а также окрашивается гематоксилином, который окрашивает участки мозга в синий цвет (в дополнение к уже присутствующей коричневой окраске). РИСУНОК. 13C показывает типичные срезы головного мозга, окрашенные миелином + гематоксилином, для одной мыши в каждой из групп 1-4. общая площадь поперечного сечения всего вещества мозга, присутствующего на каждом слайде) дополнительные серийные образцы слайдов мозга, расположенные рядом с окрашенными в коричневый цвет срезами, окрашивали обоими антителами к PLP (как обсуждалось выше), а также окрашивали гематоксилином, который превращал мозг разделы синего цвета (в дополнение к уже присутствующей коричневой окраске). РИСУНОК. 13C показывает типичные срезы головного мозга, окрашенные миелином + гематоксилином, для одной мыши в каждой из групп 1-4. общая площадь поперечного сечения всего вещества мозга, присутствующего на каждом слайде) дополнительные серийные образцы слайдов мозга, расположенные рядом с окрашенными в коричневый цвет срезами, окрашивали обоими антителами к PLP (как обсуждалось выше), а также окрашивали гематоксилином, который превращал мозг разделы синего цвета (в дополнение к уже присутствующей коричневой окраске). РИСУНОК. 13C показывает типичные срезы головного мозга, окрашенные миелином + гематоксилином, для одной мыши в каждой из групп 1-4.
В частности, для количественного определения количества иммунопозитивного PLP в коронарной части каждого мозга мыши были исследованы коронарные срезы (т.е. между брегмой-0,82 мм и 1,82 мм). Вместо субъективного присвоения числа, связанного с визуально наблюдаемой степенью затенения (то есть от светло-коричневого до темно-коричневого), был использован уникальный метод, разработанный исследователями.
Во-первых, специально адаптированный Cannon Scanner (выходное разрешение 2400 dpi) сканировал каждый из окрашенных в коричневый цвет участков коронарного мозга, показанных на фиг. 13В. Каждый пиксель в скане затем оценивали и автоматически (в Photoshop) присваивали значение от 1 до 255, где «255» соответствует наиболее светлому оттенку и «1» соответствует наиболее темному оттенку. Затем данные были экспортированы в Excel. Общее количество пикселей, присвоенных числу от 1 до 255, затем было сведено в таблицу для получения гистограммы. Данные для каждой гистограммы затем анализировали и определяли количественное средневзвешенное значение количества «цвета» или «оттенка» в каждом окрашенном миелином коронном скольжении. Это количественное число (соответствующим образом скорректировано для
затенение фона) привело к возможности прямого сравнения количества цвета для равной области в каждом окрашенном миелином коронном предметном стекле. Чтобы учесть ввод фона в определении цвета или оттенка, в качестве отрицательного контроля использовали соседний последовательный срез короны. В частности, смежный серийный коронарный срез окрашивали без использования первичного антитела IgG. Кроме того, для того, чтобы провести содержательное научное сравнение количества присутствующего миелина (то есть, интенсивности цвета или оттенка), которое может коррелировать с некоторыми аспектами предотвращения демиелинизации и / или стимулирования ремиелинизации, в венечных срезах мозга, исследованных для каждого мыши в каждой группе мышей также было необходимо определить общее количество (т.е. площадь поперечного сечения) вещества мозга, присутствующего в каждом из венечных срезов. Таким образом, общая площадь вещества мозга на каждом корональном слайде, показанная на фиг. 13C, необходимо определить таким образом, чтобы можно было количественно определить и нормализовать общее количество площади цвета / площади вещества мозга. Количество цвета на единицу площади затем использовали для непосредственного сравнения относительного количества присутствующего миелина. Соответственно, гематоксилин использовали для окрашивания всего вещества головного мозга в другом, непосредственно прилегающем, последовательном срезе короны. Эти срезы головного мозга аналогичным образом определяли количественно, и общее «количество цвета» (то есть, яркость или темнота), определенное на первом коронарном слайде, сравнивали с общей площадью поперечного сечения имеющейся материи мозга (представленной как синей окраской, так и светом или интенсивность темно-коричневой окраски выше минимального порогового значения),
Как указано выше, было 4 группы мышей, и для целей окрашивания в каждой группе было 3 мыши. Поскольку интенсивность окрашивания может изменяться в зависимости от условий окружающей среды, которые могут варьироваться, когда этапы окрашивания выполняются для очень большого числа образцов, были предприняты большие усилия для нормализации изменений интенсивности окрашивания или цвета, чтобы результаты эксперимента не были искажены. Следующие этапы хорошо известных и установленных этапов были выполнены по существу в соответствии с литературой.
Вкратце, после определения количества цвета или оттенка на единицу площади вещества мозга из каждого результата вычитали отрицательный контроль (соответствующий интенсивности цвета или оттенка, который получается без использования вышеупомянутого первичного антитела).
Кроме того, для количественного определения были разработаны и использованы три отдельных набора окрашивания.
Каждый набор содержал четыре партии с одинаковыми характеристиками окрашивания. Каждая партия содержала один образец из каждой группы и один отрицательный контроль. Окрашивание каждого образца повторяли четыре раза, в результате чего получали четыре партии окрашивания. Наконец три образца из группы 1 и отрицательного контроля были окрашены в пятой партии.
Относительная плотность цвета или оттенка в каждой партии сначала была представлена как относительный процент к соответствующему образцу группы 1 в каждой партии. В трех образцах из группы 1 факторы нормализации были выражены как относительное соотношение образца 1 в соответствии с окрашиванием в пятой партии. Кроме того, относительная плотность по отношению к группе 1 — образец 1 была снова рассчитана как
умножение относительной плотности в каждой партии на их соответствующие (и рассчитанные) коэффициенты нормализации.
Наконец, в каждом образце было рассчитано среднее значение относительной плотности для группы 1 — образец 1 из четырех партий, которое было определено как «Относительная плотность PLP», которое затем было нанесено на график в виде гистограммы (см. Рис. 13 A). Все результаты окрашивания миелина показаны на фиг. 13А-13С.
Подготовка срезов мозга мыши для просвечивающей электронной микроскопии
После перфузии образцы пост-фиксировали в вышеупомянутом фиксаторе в течение 4-6 часов при 4 ° С, затем трижды промывали какодилатным буфером (0,1 М, рН 7,4) и хранили в том же буфере при 4 ° С в течение 2- 3 дня.
Корональное скольжение было вырезано из среза мозга между брегмой-0,82 мм и -1,82 мм с использованием специального держателя / процедуры, показанной на фиг. 12.
В частности, каждый мозг мыши сначала был встроен в агаровый блок. Около 40 г порошка агара (триптический соевый агар, REF 236950, BD) тщательно смешивали с примерно 1 литром очищенной воды, затем смесь нагревали при частом перемешивании и кипятили в течение примерно 1 минуты до полного растворения порошка. Форма 301 была установлена в основании 302, как показано на фиг. 12А. Мозг мыши затем помещали в форму для сидения 301. Когда температура нагретой смеси агара и воды остыла до чуть выше комнатной температуры, форму для сидения 301 заполняли. Приблизительно через 2-3 минуты форму 301 подняли с основания 302 и сформировали агаровый блок, содержащий мозг.
Блок агара затем помещали в держатель 303, и участок мозга, соответствующий головке каждой мыши, располагали так, чтобы он был обращен к режущей кромке 304. Как показано на фиг. 12B, держатель 303 затем перемещали в направлении положения мозга, соответствующего хвосту мыши, и располагали в положении, которое соответствовало bregma-0,82, и мозг разрезали вдоль режущей кромки 304 лезвием. Держатель 303 затем перемещали примерно на 1 мм в направлении хвостовой части мозга, а затем режущую кромку 304 устанавливали при брегме -1,82. Затем мозговой блок снова разрезали на режущей кромке 304 тем же лезвием, что приводило к срезу толщиной 1 мм между bregma-0,82 и -1,82.
Слайд-ткани пост-фиксировали в 1,5% фероцианиде калия и 1% тетроксиде осмия в какодилатном буфере в течение примерно 40 минут при 4 ° С. После трехкратной промывки в какодилатном буфере тканевые блоки снова пост-фиксировали в 1% тетроксиде осмия в какодилатном буфере в течение примерно 1 часа при 4 ° C, а затем трижды промывали в dH 2 0. Блоки окончательно пост-фиксировали в 1% уранилацетате в дН 20 в течение примерно 40 минут при комнатной температуре. Затем следуют этапы дегидратации с последующим погружением блоков в 30% этанол на 5 минут, 50% этанол на 5 минут, 70% этанол на 5 минут, дважды, 80% этанол на 5 минут, дважды, 95% этанол на около 5 минут. 10 минут, дважды, 100% этанол три раза каждый в течение примерно 10 минут, 20 минут и 30 минут, пропиленоксид в течение примерно 5 минут, дважды, пропиленоксид плюс смола (соотношение 1: 1) в течение примерно 60 минут и, наконец, помещают в смола в течение ночи при комнатной температуре. Образцы затем инкубировали со смолой при 37 ° С в течение около 1 часа, затем со смолой плюс катализатор DMP при 37 ° С в течение еще около часа и, наконец, помещали в смолу плюс катализатор DMP при температуре около 60 ° С в течение около 48 часов.
Ткань скольжения разрезали в средней сагиттальной плоскости мозга, а ультратонкие срезы вырезали вдоль поверхности, где расположена средняя сагиттальная плоскость. Срезы толщиной около 90 нм были получены с использованием ультрамикротома (Reichert Jung Ultracut, Capovani Brothers Inc .; Scotic, NY) и микрофотографии были получены с помощью просвечивающего электронного микроскопа (TEM, Zeiss Libra 120).
Измерение и количественная оценка
Используя предоставленное программное обеспечение TEM (Zeiss Libra 120), площади поперечного сечения как нейронных аксонов, так и общие площади (т. Е. Площади поперечного сечения аксонов и миелиновых оболочек вместе) из 100 случайно выбранных аксонов в каждой из четырех групп были измерены; и затем, используя специально адаптированное программное обеспечение, были оценены внутренний и внешний диаметры (то есть предполагаемые площади поперечного сечения покрытий аксон / миелиновая оболочка считались концентрическими окружностями). G-отношения были рассчитаны путем деления рассчитанного диаметра аксона на рассчитанный общий наружный диаметр аксонов и миелиновых оболочек, добавленных вместе. Распределение G-соотношений показано на фиг. 16 в виде точечной диаграммы с использованием программного обеспечения GraphPad.
Чтобы представить данные еще более четко, кривые нормального распределения G-отношений были построены в Excel. В частности, фиг. 17А-17D показывают гистограммы для каждой из групп 1-4. Набор случайных чисел был сгенерирован в соответствии со средним и стандартным отклонением, и была создана гистограмма под названием «Гистограмма-частота случайная»; затем реальные данные были использованы для построения другой гистограммы под названием «Оригинал гистограммы-частоты». Различия между кривой случайного распределения и исходной кривой распределения затем сравнивали в каждой группе. Количественная оценка иммуноокрашивания PLP
Как показано на фиг. 13А-13D, после 5 недель приема купризона мыши группы 2 показали заметную потерю миелина относительно миелина, присутствующего, например, в группах 1, 3 и 4, что позволяет предположить, что условия, изложенные в таблице 2 для группы 2 были успешны, чтобы вызвать демиелинизацию, по крайней мере, некоторых корональных аксонов. Конкретное сравнение между количеством миелина, присутствующего у мышей группы 1 (вода и контрольный корм) и мышей группы 2 (вода и корм купризоном) показало статистически значимую потерю миелина, p <0,01. Кроме того, мыши группы 4, которые потребляли корм с купризоном в течение всех 5 недель и получали лечение CNM-Au8 (51 ч / млн) ad libitum только в течение 3 из 5 недель, показали больше присутствующего миелина, что свидетельствует о сохранении миелина и / или ремиелинизации (сравните группу 2 против группы 4, р <0,005). Ссылка также делается на количество миелина, присутствующего, как показано, например, на изображениях ПЭМ на фиг. 14D, обсуждается в другом месте здесь.
Наблюдения за миелиновой оболочкой из исследований с помощью ПЭМ-микроскопии
ФПГ. 14А-14D показаны репрезентативные микрофотоснимки ПЭМ областей поперечного сечения репрезентативных участков областей мозолистого тела для четырех разных мышей, а именно областей от одной мыши из каждой из групп 1-4. Матричные условия для групп 1, 2, 3 и 4, представленные в таблице 2, по-видимому, приводят к данным, согласующимся с тем, на что можно надеяться в исследовании демиелинизации купризона, а именно с измеряемой потерей миелина в группе 2 в сроки, которые позволяют определение того, может ли лечение-кандидат (такое как наносуспензия золота CNM-Au8) показать какие-либо полезные терапевтические или профилактические результаты, такие как предотвращение или замедление демиелинизации и / или содействие ремиелинизации.
Репрезентативные образцы поперечного сечения ткани мозга мозолистого тела у этих четырех мышей первоначально наблюдали с помощью ПЭМ при увеличении примерно в 16000 раз (и на каждой микрофотографии присутствуют масштабные столбики, представляющие фактическое увеличение). Сотни областей внутри мозолистого тела каждой мыши были исследованы для получения репрезентативного набора микрофотоснимков ПЭМ. Таким образом, репрезентативные изображения площадей поперечного сечения, взятых из мозолистого тела четырех мышей, показаны на фиг. 14A-14D (то есть 9-10 изображений показаны на каждой фигуре). При использовании только невооруженного глаза толщина миелиновых оболочек и характеристики аксонов были очень похожи между двумя группами, получавшими контрольный диетический корм (то есть контрольную (Groupl) и только CNM-Au8 обработку (Группа 3)). В отличие, однако, группа мышей, которая получала корм с купризоном и воду (группа 2), явно показала меньшее общее количество присутствующего миелина (например, предполагая повреждение и / или демиелинизацию показанных аксонов) в частях наблюдаемых поперечных срезов в мозолистом теле. В соответствии с литературой, было обнаружено, что деградация миелина, вызванная кормом купризоном, оказывает неоднородное воздействие (то есть является неоднородным) на миелин / аксоны в рассматриваемых областях поперечного сечения мозолистого тела. В частности, в поперечных сечениях мозолистого тела, наблюдаемых в этом исследовании, оказалось, что где-то около 40% просматриваемых площадей поперечного сечения демонстрирует некоторую степень повреждения миелина, тогда как оставшиеся площади поперечного сечения, по-видимому, аналогичны контрольным. (то есть аналогично группе 1).
Микрофотографии ПЭМ площади поперечного сечения мозолистого тела мышей группы 4 представляют большой интерес. Эта мышь получала корм с купризоном в течение всех 5 недель исследования и обработку суспензией CNM-Au8 ad libitum в течение 3-5 недель исследования. ТЕА
микрофотографии на фиг. На фигуре 14D показано, что демиелинизированных аксонов было немного, если они вообще были, и что общее количество присутствующего миелина было сходным с общим количеством присутствующего миелина в контроле (группа 1). Эти наблюдения соответствуют общему количеству присутствующего миелина, что отражено в результатах иммуноокрашивания окрашенных срезов головного мозга для трех мышей в каждой из групп 1-4, как показано на фиг. 13A-13D. В частности, относительное количество окрашивания PLP, показанное на фиг. 13A-13D для срезов короны трех мышей в каждой из мышей групп 1, 3 и 4 выше (т.е. соответствует большему количеству присутствующего миелина), чем относительное количество окрашивания PLP для трех мышей в группе 2, которые потребляли корм с купризоном и вода.
Измерение G-отношения и распределение G-отношений
Измерение и количественное определение G-соотношения широко используются в качестве функционального и структурного показателя относительного количества миелинового покрытия, присутствующего на аксонах (то есть, аксональная миелинизация). Чем выше G-отношение, тем тоньше миелин относительно диаметра аксона; и наоборот, чем ниже отношение g, тем толще миелиновая оболочка относительно аксона. Таким образом, как правило, и в пределах нормы, чем ниже сообщаемый коэффициент G, тем лучше. В частности, сообщалось, что средние диапазоны G-отношения для миелинизированных аксонов в области мозолистого тела мозга находятся в диапазоне от 0,75 до 0,81 5 .
G-отношения, измеренные в этом исследовании, представлены на фиг. 15. Наибольшее зарегистрированное G-соотношение наблюдается в группе 2, а именно у тех мышей, которые потребляли корм с купризоном и воду. Указанный G-коэффициент для мышей Группы 2 был выше, чем сообщенный G-коэффициент других групп. Наименьшее зарегистрированное G-соотношение наблюдается у мышей группы 1, а именно у мышей, которых кормили контрольным кормом и водой.
Интересно, что сравнение отношения G между мышами группы 1 (вода и корм с купризоном) и мышами группы 3 (суспензия CNM-Au8 ad libitum и корм для контрольной диеты) показало очень небольшую разницу, что согласуется с изображениями ПЭМ на фиг. 14А и фиг. 14С соответственно. Эти дополнительные данные также свидетельствуют о том, что суспензии CNM-Au8 не имели каких-либо измеримых отрицательных побочных эффектов в отношении количества присутствующего миелина.
Для дальнейшего понимания сообщенных G-отношений были построены графики разброса данных для каждой из групп 1-4. Как показано на фиг. 16, мыши группы 2 (например, более высокое отношение G; которое может соответствовать менее здоровой или отрицательно модифицированной функции аксона) показали самый высокий разброс данных по сравнению с тремя другими группами мышей. Разброс данных в оставшихся трех группах мышей был очень похожим; при этом не было обнаружено эффективной разницы между Группой 1 и Группой 3.
Чтобы еще больше количественно оценить данные G-отношения, данные были представлены по-разному на фиг. 17A-17D. В частности, были сформированы колоколообразные кривые и нанесены на график, чтобы показать непрерывное распределение вероятности данных отношения G в каждой из четырех групп мышей. Четыре графика на фиг. 17A-17D, каждая включает в себя кривую, помеченную как «случайная гистограмма-частота», которая была сгенерирована из данных «среднее» для коэффициента G и стандартного отклонения данных для коэффициента G для этой группы (созданной эффективно в качестве внутреннего контроля). Кроме того, четыре графика на фиг. 17A-17D, каждая также включает в себя кривую, помеченную «Исходная гистограмма-частота», которая была сгенерирована из фактических данных G-отношения.
Данные, представленные на фиг. 17A-17D показано, что график «Случайно-частичная гистограмма» и график «Исходный по гистограмме» очень похожи для каждой из групп 1, 3 и 4. Напротив, мыши, которые потребляли корм с купризоном (т.е. группа 2 ) показывают два больших пика, связанных с исходными данными G-коэффициента. Кроме того, кривая «Исходная гистограмма-частота» весьма отличается от кривой распределения «Случайная гистограмма-частота». Представляет интерес, что суспензия для обработки CNM-Au8, предоставленная мышам ad libitum в группе 4, по-видимому, сводит к минимуму различия в кривых относительно мышей, на которых отрицательно влияет корм с купризоном. Для данных, связанных с мышами группы 4, «оригинальная» кривая распределения в основном похожа на ее «случайную» кривую распределения, только с очень маленьким пиком, появляющимся в конце кривой с более высоким отношением. Выводы
Данные предполагают:
1. У мышей, которым давали купризоновый корм и воду в течение 5 недель, развилась потеря или повреждение миелина (например, демиелинизация), которые исследователи искали (т.е. группа 2 из таблицы 2).
2. Мыши, которым давали контрольный диетический корм и ad libitum суспензию CNM-Au8 (то есть группу 3), не демонстрировали какого-либо ненормального поведения или измеренных различий миелина относительно мышей, которым давали контрольный диетический корм и воду (группа 1).
3. Суспензии для обработки CNM-Au8 обеспечивают ad libitum положительно влияющие на количество присутствующего миелина (например, уменьшенное повреждение миелина и / или ускоренное ремиелинизацию) у мышей в группе 4, которые подвергались воздействию купризона в течение всех 5 недель и суспензии CNM-Au8 (Концентрация золота 51 ppm) за последние 3 недели исследования.
Пример 3
Модель демиелинизации купризона — 2 недели / 5 недель — исследование на 105 мышах
Резюме
Цель этого исследования на 105 мышах состояла в том, чтобы определить, предоставлены ли наноспуски «CNM-Au8» мышам: (1) либо в качестве ad libitum обработки из бутылочек с водой с концентрацией золота около 50 ppm (в качестве единственной питьевой жидкости для мыши в течение последних 3 недель или всех 5 недель исследования); или (2) обработкой через желудочный зонд (в течение последних 3 недель или всех 5 недель исследования) с концентрацией золота около 1000 ч / млн (и вводится один раз в день через желудочный зонд, исходя из веса каждой мыши на объем около 10 мл наносуспензии CNM-Au8 / кг массы тела мыши (10 мл / кг) может действовать как терапевтически эффективное количество или профилактически эффективное количество и, таким образом, влиять на количество повреждения миелина, присутствующего в мозолистом теле, и / или способствовать ремиелинизации по крайней мере некоторых аксонов в мозолистом теле. Как в Примере 2,
В общей сложности 105 самцов мышей C57BL6 были разделены на 7 групп (по 15 мышей в группе), как показано в таблице 3. Мышам было около 8 недель в начале исследования.
В попытке вызвать повреждение миелина (например, отрицательную реакцию миелина и / или демиелинизацию) шесть из семи групп (т.е. группы 2-7) получали тот же корм с купризоном, который обсуждался в примере 2. Семь групп мышей и соответствующие условия, которым подвергались семь мышей, кратко изложены ниже, а также приведены в таблице 3.
Группа 1. 15 мышей в группе 1 потребляли регулярное питание в течение всех 5 недель исследования.
(то есть не получали корм с купризоном), а также пили воду в течение всех 5 недель исследования, а затем обрабатывали, как описано здесь.
Группа 2. 15 мышей в группе 2 кормили купризоновой пищей в течение двух недель и пили воду в течение тех же двух недель исследования, а затем обрабатывали через две недели, как описано здесь.
Группа 3. 15 мышей в группе 3 получали корм с купризоном в течение всех 5 недель и пили воду в течение всех 5 недель исследования, а затем обрабатывали, как описано здесь.
Группа 4. 15 мышей в группе 4 получали корм с купризоном в течение всех 5 недель исследования и получали через желудочный зонд в течение всех 5 недель один раз в день объем обработки около 10 мл / кг концентрированного CNM-Au8. суспензии с концентрацией кристаллов золота около 1000 ч / млн, и затем обрабатывали, как описано в настоящем документе, для определения того, является ли обеспеченная наносуспензия золота профилактически эффективным количеством.
Группа 5. 15 мышей в группе 5 кормили купризоном в течение всех 5 недель и пили воду в течение первых 2 недель исследования, а затем давали через желудочный зонд в течение следующих 3 недель, один раз в день, объем обработки около 10 мл / кг концентрированной суспензии CNM-Au8 при концентрации кристаллического золота около 1000 ч. / Млн затем обрабатывали, как описано в настоящем документе, для определения того, является ли обеспеченная наносуспензия золота терапевтически эффективным количеством.
Группа 6. 15 мышей в группе 6 кормили купризоновой пищей в течение всех 5 недель исследования и пили ad libitum из бутылочек с водой обработанную суспензию CNM-Au8 при концентрации кристаллического золота около 50 ч / млн в течение всех 5 недель исследования, и затем были обработаны, как описано в настоящем документе, чтобы определить, работала ли обеспеченная золотая наносуспензия как эффективная обработка.
Группа 7. 15 мышей в группе 7 кормили купризоновой пищей в течение всех 5 недель исследования и пили воду в течение первых 2 недель исследования, а затем пили ad libitum из бутылок с водой обработанную суспензию CNM-Au8 при концентрации золота около 50 частей на миллион в течение следующих 3 недель исследования, а затем обрабатывали, как описано здесь, чтобы определить, является ли золото
предоставленная наноподвеска работала как эффективное лечение (например, действовала как терапевтически эффективное количество). Материалы и методы
Подготовка животных и индукция повреждения миелина
Самцов мышей C57BL6 получали из Taconic Farms. Все мыши были акклиматизированы между 2-4 неделями до начала 2/5 недельного исследования. Мышей подвергали обычному содержанию в клетке и проводили мониторинг поведенческих изменений. Мышей взвешивали перед началом исследования, а затем два раза в неделю во время исследования. РИСУНОК. 22 показывает среднее увеличение веса на мышь для мышей в каждой из групп 1-7.
15 мышам в каждой из групп 1-7 было разрешено есть и пить столько или меньше, как желательно. В частности, все суспензии для обработки пищи, воды и CNM-Au8 (концентрация золота 50 ч / млн) обеспечивались ad libitum или обеспечивались через желудочный зонд (концентрация золота 1000 ч / млн), как указано выше. Пресная вода и свежие суспензии CNM-Au8 обеспечивались ежедневно.
Всех мышей анестезировали с использованием авертина (250-400 мг / кг) путем инъекции авертина в брюшину иглой диаметром 0,5 дюйма 27 калибра. Чтобы минимизировать ишемию головного мозга, этапы перфузии начинали сразу после того, как каждая мышь была без сознания. В перфузионных буферах использовалось до 50 мл холодного солевого раствора (0,9% NaCl в dFhO) до тех пор, пока печень не стала полностью прозрачной, что наблюдалось для каждой мыши с использованием луп (увеличительных стекол), а затем в общей сложности около 150-180 мл фиксатора (3,5%). PFA, 1,5% глутаральдегид в 0,1М какодилате). Перистальтический насос доставлял каждую жидкость со скоростью около 4-6 мл / мин. Были предприняты меры, чтобы избежать образования пузырьков воздуха в трубке перистальтического насоса на протяжении всего этапа перфузии.
Для достижения достаточной перфузии правое предсердие каждого сердца мыши разрезали маленькими ножницами. Затем в вершину левого желудочка была введена игла, и насос начал перекачивать вышеупомянутые жидкости. После того, как прошло по меньшей мере 150 мл PFA (глутаральдегида), перистальтический насос был остановлен. Используя ножницы, голова была удалена, небольшой разрез был сделан в череп, который затем отколол, пока мозг не мог быть легко удален. После того как каждый мозг мыши был удален, каждый мозг был подвергнут последующей фиксации в предварительно подготовленных холодных (4 ° C) буферах, соответственно, и в смолу для фотомикроскопии TEM, в соответствии с литературой. 4
Сырье для перфузии было получено из следующих источников:
(1) Тригидрат какодилата натрия (для EM): Sigma Aldrich, номер по каталогу: C0250-100G
(2) Параформальдегид EM класса, очищенный Prill, 1 кг: Ted Pella, номер по каталогу: 18501
(3) Глутаральдегид, 50% EM, 10 X 10 мл: Ted Pella, номер по каталогу: 18431
(4) Стерилизационные фильтрующие элементы: Fisher Scientific, кат. №: 09-740-2A Таблица 3
Группа 1 Н 2 0
мышь
1 2 3 4 5 №
1-15 <<<<Обычная диета>>>>






Подготовка срезов мозга мыши для просвечивающей электронной микроскопии
После перфузии образцы постфиксировали в вышеупомянутом фиксаторе в течение 4-6 часов при 4 ° С, затем трижды промывали какодилатным буфером (0,1 М, рН 7,4) и хранили в том же буфере при 4 ° С в течение 2- 3 дня.
Мозг извлекали из какодилатного буфера и помещали на тонкую бумагу. Бритвенное лезвие было сагиттально вставлено в срединную линию мозга. Мозг с лезвием бритвы, все еще расположенным в средней линии, помещали в матрицы 109 мозга сагиттальной мыши, показанные на фиг. 21А, и лезвие бритвы было направлено в центральную канавку 111 матриц 109 мозга сагиттальной мыши. Матрицы 109 мозга сагиттальной мыши состоят из тринадцати канавок, которые расположены на расстоянии 1 мм друг от друга. Не двигая мозг, второе лезвие было вставлено в канавку 110R на расстоянии 2 мм от центральной канавки на правой стороне, а третье лезвие было вставлено в канавку 110L на расстоянии 2 мм от центральной канавки на левой стороне. Два зеркальных слайда мозговой ткани 103a и 103b, как показано на фиг. 20B, 20 C и 20D были сделаны.
Цилиндрические блоки 104R и 104L ткани диаметром 2 мм затем разрезают с помощью однослойного сердечника Harris (Ted Pella, Prod # 15076), как показано на фиг. 20C и 20D. Положение цилиндрического тканевого блока 104R и 104L было выбрано там, где задняя часть (т.е. селезеночная часть) мозолистого тела 105R и 105L проходит через предметные стекла 103a и 103b. Поверхность тканевого блока, которая находится в средней сагиттальной плоскости мозга, была помечена, и на этой поверхности будут вырезаны ЭМ срезы.
Ткань блока пост-фиксировали в 1,5% фероцианиде калия и 1% тетроксиде осмия в какодилатном буфере в течение 40 минут при 4 ° С. После трехкратной промывки в какодилатном буфере тканевые блоки снова постфиксировали в 1% -ном тетроксиде осмия в какодилатном буфере в течение примерно 1 часа при 4 ° С, а затем трижды промывали в dFbO. Наконец, блоки пост-фиксировали в 1% уранилацетате в dFbO в течение примерно 40 минут при комнатной температуре. Затем следуют этапы дегидратации с последующим погружением блоков в 30% этанол на 5 минут, 50% этанол на 5 минут, 70% этанол на 5 минут дважды, 80% этанол на 5 минут дважды, 95% этанол на 10 минут. дважды, по 100% этанолу три раза каждый в течение примерно 10 минут, 20 минут и 30 минут, пропиленоксид в течение примерно 5 минут дважды, пропиленоксид плюс смола (1: 1 соотношение) в течение примерно 60 минут и, наконец, при комнатной температуре смолы в течение ночи. Образцы затем инкубировали со смолой при 37 ° С в течение примерно 1 часа, затем со смолой плюс катализатор DMP при примерно 37 ° С в течение еще одного часа и, наконец, помещали в смолу плюс катализатор DMP при примерно 60 ° С в течение примерно 48 часов. Срезы толщиной около 90 нм были получены с использованием ультрамикротома (Reichert Jung Ultracut, Capovani Brothers Inc .; Scotic, NY) и микрофотографии были получены с помощью просвечивающего электронного микроскопа («TEM», Zeiss Libra 120).
15 мышей в группе 2 были выведены из организма после 2 недель приема корризонового корма и питья только воды, чтобы оценить количество и тип повреждения аксонов миелином в мозолистом теле после 2 недель воздействия кормового купризона; и остальные 90 мышей в других шести группах были уничтожены через 5 недель, как указано в таблице 3.
В каждой из семи групп мышей предварительно определенная область мозга от каждой мыши была предназначена для экстракции. Область мозолистого тела головного мозга густо заселена аксонами, которые чувствительны к купризоновой обработке, и эта область была областью фокуса для всех исследований ТЕА. Несколько различных количественных и качественных методов оценки были затем использованы для наблюдения и количественной оценки многих полученных изображений ПЭМ.
/. Сравнение изображений ТЕМ Corpus Callosum, полученных при 4000x и 5000x. Первый набор изображений TEM был получен при минимальном увеличении, первоначально сделанном при
4000x — 5000x, и набор ТЕА представлен на фиг. 23-29. Каждое из этих изображений представляет небольшую часть всей области мозолистого тела каждого мозга мыши. Кроме того, эти изображения были выбраны не случайно, а скорее потому, что они соответствуют области (ам) мозолистого тела, которая показала наиболее обширное повреждение миелина.
Еще раз отмечается, что модель токсичного купризона не приводит к равномерному повреждению миелина по всему мозолистому телу, поэтому опытные операторы уделяли большое внимание выбору тех участков, которые демонстрируют наибольшее количество повреждений из-за подачи купризона.
ФПГ. 23А, 23В и 23С, все первоначально взятые в 4000х, соответствуют мозгу мышей от мышей группы 1. Микрофотографии ПЭМ на фигуре 23 показывают, относительно всех других микрофотоснимков ПЭМ на фиг. 24-29, наибольшее количество миелина присутствует на аксонах мозолистого тела. Никакие области обширной демиелинизации или дисмиелинизации не могли быть идентифицированы где-либо в пределах областей мозолистого тела этих мышей группы 1.
Микрофотографии ПЭМ, соответствующие мышам из группы 2, все первоначально взятые в 4000 раз, показаны на фиг. 24А-24Е. Эти репрезентативные изображения ПЭМ показывают области с меньшим количеством миелина, присутствующие относительно фиг. 23А-23С (т.е. контрольная группа 1). Следует отметить, что при просмотре мозга мыши, связанного с Группой 2, в мозге мыши Группы 2 были области, которые показали наличие нескольких областей с меньшим количеством миелина в мозолистом теле; и такие области не наблюдались на контрольных изображениях (группа 1), представленных на фиг. 23A-23C. Также следует отметить, что ряд аксонов, показанных на фиг. 24А-24Е
микрофотографии, по-видимому, имеют больший диаметр, чем любые аксоны, наблюдаемые и фотографируемые в контрольной группе 1. Наблюдаемый ненормальный более толстый миелин на некоторых аксонах, вероятно, является реакцией на токсичное питание купризона. Конкретная ссылка сделана на фиг. 24 А, 24D и 24E.
Микрофотографии ПЭМ, соответствующие мозгу мышей в группе 3 (т.е. мышей, которым давали купризоновый корм в течение 5 недель), показаны на фиг. 25А-25G. Эти репрезентативные изображения ПЭМ, все первоначально сделанные при 4000-кратном увеличении, показывают области мозолистого тела, где еще меньше миелина, по сравнению с мышами группы 2, которые потребляли корм с купризоном только в течение 2 недель. Кроме того, представляется, что имеется еще больше аксонов, имеющих больший диаметр и более тонкие миелиновые оболочки, чем любые аксоны, наблюдаемые и микрофотографированные у мышей из контрольной группы 1. Конкретная ссылка делается на фиг. 25D, фиг. 25E, фиг. 25F и фиг. 25G. Повреждение миелина является установленным открытием в течение 2-6 недель индуцированной купризоном демиелинизации 13, и ранее сообщалось о сфероидах аксонов, таких как наблюдаемые здесь. 14 Кроме того, большие наблюдаемые отеки аксонов могут быть реакцией на потерю миелина.
Изображения ПЭМ, соответствующие мозгу мышей из профилактического лечения
Группа 4 показана на фиг. 26A-26E, все изображения были первоначально сделаны в 4000x. Мышам из группы 4 давали купризоновый корм в течение 5 недель и один раз в день вводили через желудок с концентрацией золота 1000 ч / млн (1000 мкг / мл), присутствующей в наносуспензиях CNM-Au8, в количестве 10 мл наносуспензии на килограмм веса мыши ( т.е. 10 мл / кг). Нет областей повреждения миелина, как показано на фиг. 25A-25G (т.е. группа 3), можно найти на изображениях ПЭМ группы 4. Фактически, изображения ПЭМ из группы 4 были в некоторой степени аналогичны изображениям ПЭМ из контрольной группы 1 (см. Фиг. 23A-23C для сравнения).
Кроме того, белые стрелки 201, присутствующие на каждой из фиг. 26A-26E, соответствуют аксонам, которые в соответствии с литературой демонстрируют характеристики, соответствующие ремиелинизации 8 . В частности, эти маркированные аксоны 201 показывают тонкую и темную компактную миелиновую оболочку относительно других аксонов с аналогичными или большими площадями поперечного сечения.
Изображения ПЭМ, соответствующие мозгу мышей от мышей группы 5, показаны на фиг. 27A-27D. Эти изображения TEM были первоначально сделаны в 4000x и 5000x, как отмечено на шкалах масштаба на изображениях TEM. Эти изображения, подобные изображениям на фиг. 26A-26E, также не имеют областей с обширным повреждением миелина, таких как демиелинизированные области у мышей группы 3 (например, заметно уменьшены количества областей, демонстрирующих обширное повреждение или демиелинизацию миелина у мышей группы 5). Мышей группы 5 кормили купризоновой пищей в течение 5 недель и давали наносуспензии CNM-Au8 через желудочный зонд один раз в день в концентрации 1000 ч / млн (1000 мкМ / мл) и в количестве 10 мл / кг в течение 3 недель. -5 исследования в качестве терапевтического лечения. Очевидно, фиг. 27A-27D показано, что желудочный зонд вышеупомянутых наносуспензий CNM-Au8 оказывал терапевтическое действие (например,
Кроме того, белые стрелки 201, присутствующие на каждой из фиг. 27A-27D, соответствуют аксонам, которые, согласно литературе, считаются ремиелинизированными 8 . В частности, эти маркированные аксоны 201 показывают тонкую и темную компактную миелиновую оболочку относительно других аксонов с аналогичными или большими площадями поперечного сечения.
Изображения ПЭМ, соответствующие мозгу мышей от мышей группы 6, показаны на фиг. 28А-28G. Эти изображения ПЭМ также были первоначально сделаны с 4000-кратным увеличением, как отмечено на линейках масштаба на изображениях. Эти изображения, подобные изображениям на фиг. 26A-26E, также показывают заметно уменьшенные количества областей или областей, демонстрирующих обширное повреждение или демиелинизацию миелина, сходных с теми нежелательными областями, которые наблюдают у мышей группы 3. Мышей группы 6 кормили купризоновой пищей в течение 5 недель и давали профилактические наносуспензии CNM-Au8 ad libitum в концентрации 50 ppm золота (50 мкг / мл) в течение всех 5 недель исследования в качестве лечения. Очевидно, что ad libitum воздействие наносуспензий CNM-Au8 в концентрации 50 мкг / мл оказывало профилактическое и / или терапевтическое действие на миелин для мышей группы 6 по сравнению с миелином, наблюдаемым для мышей группы 3 ,
Кроме того, белые стрелки 201, присутствующие на каждой из фиг. 28A-28G, соответствуют аксонам, которые, согласно литературе, считаются ремиелинизированными. 8 В частности, эти отмеченные аксоны имеют тонкую и темную компактную миелиновую оболочку по сравнению с другими аксонами с аналогичными или большими площадями поперечного сечения.
Изображения TEM, соответствующие мышам группы 7, показаны на фиг. 29A-29D. Эти изображения TEM были первоначально сделаны в 4000x, как отмечено на линейках масштаба на изображениях. Эти изображения, подобные изображениям на фиг. 26A-26E также показано заметно уменьшенное количество областей, демонстрирующих обширное повреждение миелина или демиелинизацию, сходных с этими нежелательными областями у мышей группы 3. Мышей группы 7 кормили купризоновой пищей в течение 5 недель и давали наночастицы для обработки CNM-Au8 ad libitum в концентрации 50 ppm золота (50 мкг / мл) в течение 3-5 недель исследования в качестве лечения. Очевидно, что ad libitum воздействие наносуспензий CNM-Au8 в концентрации 50 мкг / мл оказывало профилактическое и / или терапевтическое воздействие на мышей группы 7 или на обоих по сравнению с мышами группы 3.
Кроме того, белые стрелки 201, присутствующие на каждой из фиг. 29A-29D, соответствуют аксонам, которые, согласно литературе, считаются ремиелинизированными. 8 В частности, эти отмеченные аксоны показывают тонкую и темную компактную миелиновую оболочку по сравнению с другими аксонами с аналогичными большими поперечными сечениями.
Эти данные свидетельствуют о том, что корм с купризоном приводил к образованию некоторых демиелинизированных аксонов в областях мозолистого тела мозга мыши и что нанокристаллические суспензии золота CNM-Au8 были эффективным лечением (как терапевтическим, так и профилактическим) для млекопитающих для уменьшения количества демиелинизации аксонов и / или приводят к ремиелинизации аксонов.
77. Количественная оценка количества демиелинизированных аксонов / единица площади
Другой метод определения того, есть ли какие-либо положительные эффекты воздействия суспензий нанокристаллов золота CNM-Au8 на величину повреждения миелина, вызванного подачей купризона, заключается в подсчете количества демиелинизированных аксонов и / или явно поврежденного миелина, присутствующего на аксонах, и сравнении количество демиелинизированных аксонов в каждой из групп мышей 1-7. Этот подход облегчается, наблюдая серию сходных увеличений (то есть, первоначально сделанных в 16000x) изображений ПЭМ, сделанных случайным образом из области мозолистого тела мышей мозга у мышей в каждой из групп 1-7. Детали исследования для групп 1-7 изложены в таблице 3, как обсуждалось ранее. Эта методология стремится отличить демиелинизированные аксоны от немиелинизированных аксонов, а затем сравнить количество демиелинизированных аксонов (на единицу площади) в каждой группе мышей.
Вкратце, в этом подходе наименьший полностью миелиновый аксон (то есть полностью миелинизированный аксон с наименьшей площадью поперечного сечения) идентифицируется в каждом изображении ПЭМ с белой звездой 203. Этот наименьший полностью миелинизированный аксон 203 служит стартовым ». Эталон «Аксон» в каждой отдельной микрофотографии ПЭМ. Затем все немиелинизированные аксоны и / или
демиелинизированные аксоны и / или аксоны, которые содержат явно поврежденный миелин, которые имеют примерно ту же площадь поперечного сечения или большую площадь поперечного сечения, чем эталонный аксон 203, классифицируются как «демиелинизированные» и затем идентифицируются с помощью соответствующий знак Отмеченные аксоны затем подсчитываются индивидуально и суммируются, как более подробно обсуждается ниже.
Размер эталонного аксона 203 может несколько изменяться на каждой микрофотоснимке ПЭМ, поскольку разные части неоднородного мозолистого тела могут несколько отличаться друг от друга. Как только для контрольной группы 1 определено среднее количество «демиелинизированных» аксонов, то это среднее число служит типом «фонового шума», и это среднее количество вычитается из числа «Средневзвешенного» числа демиелинизированных аксонов в каждой из групп. 2-7. Считается, что с использованием подхода контрольного аксона можно получить более точное понимание локальной окрестности мозолистого тела, что приводит к более точному подсчету и представлению поврежденных или демиелинизированных аксонов.
В частности, фиг. 30А показана репрезентативная микрофотография ПЭМ, первоначально взятая в 16 000 раз, случайно взятая из области мозолистого тела мыши из контрольной группы 1. На этой микрофотографии ПЭМ самая маленькая площадь поперечного сечения полностью миелинизированного аксона представлена белой звездой и пронумерован 203 S. Этот эталонный аксон 203 S, идентифицированный опытным оператором, становится эталонным аксоном на этой фиг. ТЕА 30А
микрофотография.
или миелин явно поврежден) помечается другим черным прямоугольным прямоугольником (показанным как черный прямоугольник на фиг. 30А) путем прикосновения к сенсорному экрану таким же образом. Когда оператор заканчивает отмечать все такие (1) и (2) аксоны, программа автоматически подсчитывает все прямоугольники на каждой микрофотографии (т.е.
соответствует всем аксонам (1) и (2), отмеченным квалифицированным оператором и оцененным квалифицированным оператором как поврежденные). РИСУНОК. 30A также имеет наложенные на него белые стрелки 202S, указывающие на каждый из черных ящиков. Эти белые стрелки 202S были добавлены, чтобы помочь читателю идентифицировать, какие аксоны (1) и (2) были отмечены черными ящиками (то есть те, которые были идентифицированы квалифицированным оператором для повреждения). Однако белые стрелки добавляются вручную после того, как произошло автоматическое суммирование (например, подсчет количества поврежденных или демиелинизированных аксонов (1) и (2)).
РИСУНОК. 30B является той же микрофотографией ПЭМ, показанной на фиг. 3 ОА, с белой звездой, обозначающей опорный аксон 203, и белыми стрелками 202, указывающими те аксоны, которые когда-то содержали черный ящик, однако черные ящики были удалены, и остались только белые стрелки 202. На всех оставшихся микрофотографиях ПЭМ, показанных на фиг. 30B — фиг. 36B, все черные ящики были удалены. Однако следует понимать, что белые стрелки 202, хотя и добавленные позже вручную, соответствуют тем аксонам (1) и (2), которые квалифицированный оператор оценил как поврежденные, как определено ссылкой на другой эталонный аксон 203 в каждом ТЕМ. микрофотография.
Таким образом, фиг. 3 OB показывает типичное поперечное сечение мозолистого тела мыши в контрольной группе 1. Фиг. 30B показывает одну белую звезду 203 в качестве эталонного аксона и 12 белых стрелок 202, соответствующих этим демиелинизированным аксонам (1) и (2), как определено квалифицированным оператором для повреждения.
Аналогично, фиг. 30C соответствует другому типичному поперечному сечению мозолистого тела мыши в контрольной группе 1. В этом случае эталонный аксон 203 также обозначается таким же образом с белой звездой 203 и каждым из этих демиелинизированных аксонов (1) и ( 2) также обозначены белой стрелкой с номером 202. На фиг. 30C показывает 11 демиелинизированных аксонов.
Аналогично, фиг. 31А и 3В показаны две репрезентативные микрофотоснимки ПЭМ, также снятые при 16000Х, взятые у репрезентативных мышей в группе 2, и также идентифицирующие сходный эталонный аксон 203 в каждом изображении ПЭМ с белой звездой и 15 демиелинизированными аксонами 202 на фиг. 31 А; и 17 демиелинизированных аксонов 202 на фиг. 3 IB.
Аналогичным образом, мыши из каждой из групп 3-7 также представлены двумя сходными репрезентативными микрофотографиями ПЭМ мозолистого тела, взятыми у мышей в каждой из этих групп.
ФПГ. 32A и 32B соответствуют репрезентативным изображениям ПЭМ мозолистого тела мышей из группы 3, показывающим эталонные аксоны 203 и 23 демиелинизированных аксона 202; и 20 демиелинизированных аксонов 202 соответственно.
ФПГ. 33A и 33B соответствуют репрезентативным изображениям ПЭМ мозолистого тела мышей из группы 4, показывающим эталонные аксоны 203 и 17 демиелинизированных аксонов 202; и 19 демиелинизированных аксонов 202 соответственно.
ФПГ. 34A и 34B соответствуют репрезентативным ПЭМ изображениям мозолистого тела мышей из группы 5, показывающим эталонные аксоны 203 и 13 демиелинизированных аксонов 202; и 15 демиелинизированных аксонов 202 соответственно.
ФПГ. 35A и 35B соответствуют репрезентативным ПЭМ изображениям мозолистого тела мышей из группы 6, на которых показаны эталонные аксоны 203 и 18 демиелинизированных аксонов 202; и 15 демиелинизированных аксонов 202 соответственно.
ФПГ. 36А и 36В соответствуют репрезентативным ПЭМ изображениям мозолистого тела мышей из группы 7, показывающим эталонные аксоны 203 и 15 демиелинизированных аксонов 202; и 14 демиелинизированных аксонов 202 соответственно.
Таблица 4

Таблица 4 показывает в сводной форме общее количество микрофотоснимков ПЭМ, сходных с показательными микрофотоснимками, показанными на фиг. 30-36, которые были рассмотрены аналогичным образом. В этом отношении, например, 45 общих микрофотоснимков ПЭМ были исследованы для мышей в группе 1. Кроме того, из этих 45 микрофотоснимков ПЭМ, исследованных для группы 1, было подсчитано в общей сложности 419 демиелинизированных аксонов. В четвертом столбце таблицы 4 перечислены «Средневзвешенное значение подсчитанных демиелинизированных аксонов на микрофотографию» и указано, что для группы 1 было «10». Следует отметить, что средневзвешенное значение было достигнуто следующим образом.
В каждой из групп 1-7 репрезентативные образцы мозолистого тела от каждой мыши были сфотографированы в нескольких местах. Для каждого образца мозолистого тела суммировали «Общее количество подсчитанных демиелинизированных аксонов» на всех микрофотографиях и определяли среднее количество демиелинизированных аксонов на микрофотографию для каждого образца (результаты не показаны). Из-за изменчивости некоторых стадий перфузии некоторые образцы мозолистого тела имели большее количество микрофотографий лучшего качества, которые можно было бы использовать для подсчета.
Поэтому среднему количеству демиелинизированных аксонов для каждого образца мозолистого тела был присвоен вес в соответствии с качеством набора микрофотоснимков этого образца. Веса были определены следующим образом. Для каждого образца мозолистого тела из группы мышей количество демиелинизированных аксонов, идентифицированных для этого образца, было разделено на общее количество демиелинизированных аксонов, идентифицированных для этой группы. Это вес образца. Массу каждого образца умножали на среднее значение по образцу демиелинизированных аксонов на микрофотографию. Эти средневзвешенные значения выборки были суммированы по каждой группе и представлены в таблице как «Средневзвешенные демиелинизированные аксоны на микрофотографию» в таблице 4.
В последнем столбце таблицы 4 приведено «Скорректированное средневзвешенное значение демиелинизированных аксонов на микрофотографию». Эти числа были определены путем вычитания «10» из предыдущего столбца, причем «10» фактически соответствует «фоновому шуму» в
микрофотографии.
Соответственно, наивысшее число для «Скорректированного средневзвешенного значения демиелинизированных аксонов на микрофотографию» происходит в группе 3, тогда как наименьшее значение для «Скорректированного средневзвешенного значения демиелинизированных аксонов на микрофотографию» происходит в группе 1 (то есть в контрольной группе).
В целом, 313 суммарных микрофотоснимков ПЭМ репрезентативных частей мозолистого тела были проанализированы для различного числа мышей в каждой из групп 1-7, в результате чего общее количество демиелинизированных аксонов насчитывалось около 4200. В таблице 2 приведены средневзвешенные значения демиелинизированных аксонов, подсчитанных для каждой группы мышей.
Следует понимать, что определение общего количества «демиелинизированных» аксонов на микрофотографию ПЭМ было выполнено таким образом, который должен был быть максимально объективным. В этом отношении случайно выбранные части мозолистого тела были отдельно микрофотографированы. Те микрофотоснимки (все они изначально были получены при 16000X), которые дали достаточно четкое различие между аксонами, были затем микрофотографиями-кандидатами для подсчета «демиелинизированных» аксонов. Отмечено, что некоторые из мышей мозга не подвергались полной перфузии во время этапов подготовки образца, которые некоторые изображения TEM были размытыми или содержали недопустимые артефакты.
Микрофотографии, которые были, например, слишком расплывчатыми для чтения и / или содержали слишком много артефактов, были удалены, затем каждая оставшаяся микрофотография ПЭМ была проанализирована, как обсуждалось выше, и суммирована в Таблице 4.
Таким образом, каждая из суспензий нанокристаллов золота CNM-Au8, использованных для мышей в каждой из групп 4-7, привела к тому, что (i) «скорректированное средневзвешенное значение демиелинизированных аксонов на микрофотографию» было меньше, чем «скорректированное средневзвешенное значение демиелинизированного» «Аксоны на микрофотографии» мышей в группе 3; и (ii) «Скорректированное средневзвешенное значение
Демиелинизированные аксоны на микрофотографию «должны быть больше, чем» Скорректированное средневзвешенное значение демиелинизированных аксонов на микрофотографию «мышей в контрольной группе 1.
Эти данные свидетельствуют о том, что корм с купризоном приводил к образованию некоторых демиелинизированных аксонов в областях мозолистого тела мозга мыши и что золотые нанокристаллические суспензии CNM-Au8 были эффективным средством (как терапевтическим, так и профилактическим) для млекопитающих для уменьшения количества демиелинизации аксонов.
/ Z7. Ремиелинизация аксонов, показанная в изображениях, сделанных в 16 000 и 40 000 раз
Еще один объективный метод определения, есть ли какие-либо положительные эффекты лечения
Суспензии нанокристаллов золота CNM-Au8 по количеству повреждения миелина, вызванного кормом купризоном, должны определить, можно ли наблюдать ремиелинизацию в областях мозолистого тела мозга мышей в каждой из групп 1-7. Детали исследования для групп 1-7 изложены в таблице 3, как обсуждалось ранее.
В этом отношении фиг. 37-40 показывают репрезентативные микрофотографии ПЭМ, снятые в любом из
16000x или 40000x, как отмечено на шкале масштаба на каждой микрофотографии, репрезентативных областей мозолистого тела мышей в группах 4-7. Отмечено, что репрезентативные изображения ПЭМ показывают только группы профилактического лечения 4 и 6 и группы терапевтического лечения 5 и 7, потому что аксоны, подобные аксонам, обозначенным «201M» на изображениях ТЕМ, не наблюдались в частях мозолистого тела мышей в Группы 1-3. В частности, стрелки 201M указывают на тонкие, темные и компактные миелиновые области, которые, согласно литературе, считаются ремиелинизированными аксонами 8 . Подобные тонкие, темные и компактные области на аксонах не были обнаружены на репрезентативных микрофотографиях, соответствующих мышам в группах 1-3.
ФПГ. 37A-37K соответствуют изображениям ПЭМ мышей в группе 4, снятым как в 16 000, так и в 40000 раз. Эти фиг. показать количество стрелок 201M. Эти стрелки 201M направлены на то, что в литературе рассматривается как ремиелинизированные аксоны 8 . Следует понимать, что более темные миелиновые области не являются артефактами подготовки образца или процесса визуализации ПЭМ, поскольку соседние или соседние аксоны могут использоваться в качестве опорных точек, и эти соседние аксоны не имеют более темных миелиновых областей.
ФПГ. 38A-38L соответствуют изображениям ПЭМ мышей в группе 5, снятым как в 16 000, так и в 40000 раз. Фиг. показать количество стрелок 201M. Эти стрелки 201M направлены на то, что в литературе рассматривается как ремиелинизированные аксоны 8 . Следует понимать, что более темные миелиновые области не являются артефактами подготовки образца или процесса визуализации ПЭМ, поскольку соседние или соседние аксоны могут использоваться в качестве опорных точек, и эти соседние аксоны не имеют аналогичных более темных миелиновых областей.
ФПГ. 39A-39J соответствуют снимкам ПЭМ из группы 6, снятым с разрешением 16000х и 40000х. Эти фиг. показать количество стрелок 201M. Эти стрелки 201M направлены на то, что в литературе рассматривается как ремиелинизированные аксоны 8 . Следует понимать, что более темные миелиновые области не являются артефактами подготовки образца или процесса визуализации ПЭМ, поскольку соседние или соседние аксоны могут использоваться в качестве опорных точек, и эти соседние аксоны не имеют аналогичных более темных миелиновых областей.
ФПГ. 40A-40G соответствуют снимкам ПЭМ из группы 7, снятым с разрешением 16000x и 40000x. Эти фиг. Также показывают количество стрелок 201M. Эти стрелки 201 M направлены на то, что в литературе рассматривается как ремиелинизированные аксоны 8 . Следует понимать, что более темные миелиновые области не являются артефактами подготовки образца или процесса визуализации ПЭМ, поскольку соседние или соседние аксоны могут использоваться в качестве опорных точек, и эти соседние аксоны не имеют аналогичных более темных миелиновых областей.
Наличие ремиелинизированных аксонов, как показано стрелками 201M, позволяет предположить, что
Суспензии нанокристаллов золота CNM-Au8 были эффективным средством лечения млекопитающих (как терапевтических, так и профилактических) для достижения ремиелинизированных аксонов (например, увеличения количества ремиелинизированных аксонов относительно аксонов в аналогичных областях мозолистого тела, наблюдаемых у мышей в группах 1-3). Внутривенно Измерение миелина по аксонам и количественное определение
Еще один объективный метод определения того, есть ли какие-либо положительные эффекты воздействия суспензий нанокристаллов золота CNM-Au8 на количество повреждений миелина, вызванных кормом купризоном, заключается в вычислении и сравнении коэффициентов G миелина на аксонах в областях мозолистого тела мозга мышей. в каждой из групп 1-7, в соответствии с литературой 5 ‘ 6 . Расчеты G-отношения являются еще одним признанным средством для оценки различных патологических эффектов.
В частности, измерение и количественное определение G-коэффициента широко используются в качестве функционального и структурного показателя относительного количества миелинового покрытия, присутствующего на аксонах (то есть миелинации аксонов). Чем выше G-отношение, тем тоньше миелин относительно диаметра аксона; и наоборот, чем ниже отношение g, тем толще миелиновая оболочка относительно аксона. Таким образом, как правило, и в пределах нормы, чем ниже сообщаемый коэффициент G, тем лучше. В частности, сообщалось, что средние диапазоны G-отношения для миелинизированных аксонов в области мозолистого тела мозга находятся в диапазоне от 0,75 до 0,81 5 .
ФПГ. 41-47 показаны репрезентативные микрофотоснимки ПЭМ, первоначально сделанные при 40000-кратном увеличении, как отмечено на линейках масштаба на изображениях, репрезентативных площадей поперечного сечения областей мозолистого тела у мышей из каждой из групп 1-7, соответственно. Детали исследования для групп 1-7, как обсуждалось ранее, приведены в таблице 3. Вкратце, внутренний и внешний диаметр миелина на репрезентативных аксонах взяты из
репрезентативные изображения TEM были отмечены путем отслеживания, затем измерены, суммированы, усреднены и использованы для определения G-соотношений, как обсуждалось в данном документе.
В частности, сначала были выбраны случайно выбранные участки поперечного сечения, содержащие нейронные аксоны мышей, соответствующие мышам в каждой из семи групп. Микрофотографии ПЭМ, первоначально сделанные при 40 000х, затем были сделаны из случайно выбранных областей. С использованием программного обеспечения Image J внутренний (2041) и внешний (204O) периметры большого количества аксонов, показанных на микрофотографиях ПЭМ, были впервые отслежены стилусом на сенсорном экране компьютера.
Затем были проведены измерения с использованием сгенерированных стилусом кривых внутреннего (2041) и внешнего (204О) периметров отслеживаемых аксонов. В соответствии с литературой, наблюдаемые площади поперечного сечения покрытий аксон / миелиновая оболочка считались концентрическими окружностями.
G-отношения затем рассчитывали путем деления определенного внешнего периметра аксона (2041) (также соответствующего внутреннему периметру миелина и обозначенного здесь обоими способами) на внешний периметр (204O) аксона и миелиновой оболочки, добавленных вместе.
ФПГ. 41-47 показаны некоторые из случайно выбранных репрезентативных изображений ПЭМ поперечных срезов нервных аксонов в мозолистом теле с трассировками, соответствующими внутреннему (2041) и внешнему (204O) периметру миелина, наложенному на них.
ФПГ. 41А-41С показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 1, пример 3. Эти изображения представляют собой изображения с большим увеличением, 40000-кратное, показывающие, что внутренний (2041) и внешний (204О) периметры миелин был помечен на каждом аксоне на нем.
ФПГ. 42A-42D показывают репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 2, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40000-кратное, показывающие, что внутренний (2041) и внешний (204O) периметры миелин был помечен на каждом аксоне на нем.
ФПГ. 43A-43C показывают репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 3, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 44A-44B показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 4, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом. ФПГ. 45А-45С показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 5, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 46А-46В показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 6, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
ФПГ. 47A-47E показаны репрезентативные микрофотоснимки ПЭМ, которые соответствуют репрезентативным частям мозолистого тела мышей в группе 7, пример 3. Эти изображения представляют собой изображения с высоким увеличением, 40 000-кратное изображение, показывающие, что внутренний и внешний периметры миелина были помечены на каждом Аксон на этом.
Таблица 5 содержит сводку результатов, полученных из вышеупомянутых
измерения. В частности, в таблице 5 показано общее количество аксонов, которые были отмечены, суммированы и измерены для расчета G-отношений. Измерения были сделаны на уровне 77 аксонов в группе 1; в то время как измерения были сделаны на максимуме 374 аксонов в группе 2.
«Стандартная ошибка среднего» («SEM»), указанная в столбце 4 таблицы 5, представляет собой стандартное отклонение оценки среднего значения выборки для популяции. (SEM также можно рассматривать как стандартное отклонение ошибки в среднем по выборке относительно истинного среднего, поскольку среднее по выборке является объективной оценкой). SEM оценивали путем оценки выборки стандартного отклонения популяции (стандартного отклонения выборки), деленного на квадратный корень из размера выборки.
Таблица 5

Как отмечалось ранее, было обнаружено, что деградация миелина, вызванная подачей купризона, оказывает неоднородное влияние на миелинизированные аксоны в различных частях областей поперечного сечения мозолистого тела, наблюдаемых с помощью ПЭМ. ,
В этом отношении фиг. 48-50 по-разному выражают измерения G-отношения, приведенные в таблице 5. Эти фиг. 48-50 — гистограммы гистограмм G-отношений, показывающие процентную долю аксонов G-отношений на оси Y; по сравнению с распределением G-отношения по оси X для каждой группы мышей.
Эти фиг. 48-50 также содержат столбец с меткой «NMY», который не является частью расчетов G-отношения для других столбцов гистограммы, а скорее представляет собой нормализованное по площади количество «демиелинизированных» аксонов в каждом группа мышей (то есть, как определено ранее и сообщается в разделе II, озаглавленном «Количественное определение количества
Демиелинизированные аксоны / единичная зона «). Из-за наличия бара NMY каждая диаграмма в дальнейшем называется» гистограмма модифицированной гистограммы «.
Модифицированные гистограммы гистограмм, содержащие данные G-отношения для групп мыши 1, 2 и 3, показаны на фиг. 48А, 48В и 48С соответственно.
Модифицированные гистограммы гистограмм, содержащие данные G-отношения для групп мыши 3, 5 и 7, показаны на фиг. 49А, 49В и 48С соответственно.
Модифицированные гистограммы гистограмм, содержащие данные G-отношения для групп мыши 3, 4 и 6, показаны на фиг. 50А, 50В и 48С соответственно. Кроме того, фиг. 48A показывает гистограмму модифицированной гистограммы, содержащую данные G-отношения для группы управления 1 мыши. Внимание направлено на числа в верхней части каждой гистограммы. Эти числа соответствуют проценту встречаемости на единицу площади аксонов, имеющих отмеченное на них G-отношение. В частности, процентное число было нормализовано для учета всех «демиелинизированных» аксонов на ту же единицу площади, которые были подсчитаны ранее (т. Е. Процентные числа включают значения NMY). Считается, что сообщение об обоих наборах чисел в гистограмме модифицированной гистограммы может дать более полное понимание некоторых лечебных эффектов наносуспензий CNM-Au8.
Дальнейшее внимание направлено на затененные области слева и справа от гистограммы измененной гистограммы. Эти заштрихованные области перекрываются, например, на фиг. 48B и 48C, и предназначены для того, чтобы обратить внимание на те части модифицированной гистограммы
Гистограммы, содержащие несколько разные или несколько похожие данные. Также следует отметить перекрестную штриховку на столбце 210 NMY. Такая же перекрестная штриховка имеет место для всех других столбцов «NMY» на каждой из гистограмм модифицированной гистограммы. Поскольку мышей контрольной группы 1 следует считать нормальными или здоровыми, гистограмму модифицированной гистограммы на фиг. 48A можно рассматривать как хорошую отправную точку (т. Е. «Положительный контроль») для сравнения между различными группами.
Аналогично, модифицированные гистограммы в виде гистограммы, соответствующие мышам, которым вводили купризон, показаны на фиг. 48В и 48С. Таким образом, модифицированная гистограмма гистограммы на фиг. 48C также можно рассматривать как хорошую отправную точку (т. Е. «Отрицательный контроль») для сравнения различных групп. Например, стержень 210b содержит такую же штриховку, соответствующую стержню 210 на фиг. 48А, но также содержит сплошную часть, показывающую большее количество «демиелинизированных» аксонов, как обсуждалось выше.
ФПГ. 49A, 49B и 49C содержат гистограммы модифицированной гистограммы, соответствующие мышам в группе 3 (отрицательный контроль), группе 5 и группе 7 соответственно. Эти три Модифицированные Бар
Гистограммы диаграммы были помещены вместе для сравнения. Особенности
Модифицированные гистограммы гистограммы довольно похожи.
ФПГ. 50A, 50B и 50C также содержат гистограммы модифицированной гистограммы, соответствующие мышам в группе 3 (отрицательный контроль), группе 4 и группе 6 соответственно. Эти три измененные гистограммы гистограммы были объединены для сравнения. Особенности, содержащиеся на фиг. 50B и 50C очень похожи друг на друга и также весьма отличаются от отрицательного контроля, показанного на фиг. 5 ОА. Для удобства сравнения все те же гистограммы модифицированной гистограммы представлены на фиг. 51. Следует отметить, что на фиг. 48 A, B и C, для размера отношения G 0,65, фиг. 48B показывает, что группа 2 имела 17% своих аксонов с размером G-коэффициента 0,65. Как обсуждалось в литературе,5 . Ожидаемый экспериментально наблюдаемый диапазон g-отношения для корональных аксонов с оптимальной эффективностью будет составлять от 0,76 до чуть более 0,80 5 . На фиг. 48B, небольшая популяция аксонов с размером G-коэффициента 0,65 была меньше, чем нормальная G-доля, и считалась ранней реакцией на корм с купризоном. Таким образом, не ожидается, что такие аксоны будут функционировать нормально или хорошо 5 .
Следует отметить, что аналогичные модифицированные гистограммы гистограммы, показанные на фиг. 50B и 50C соответствуют мышам, которые были из; (1) Группа 4 и кормили купризоном в течение всех 5 недель исследования и давали через желудочный зонд в течение всех 5 недель один раз в день объем обработки около 10 мл / кг концентрированной суспензии CNM-Au8 с золотом концентрация кристаллов около 1000 ч / млн, чтобы определить, является ли обеспеченная нанозуспензия золота эффективным количеством для обработки; и из (2) группы 6, которой давали корм с купризоном в течение всех 5 недель исследования и пили ad libitum из бутылок с водой обработанную суспензию CNM-Au8 при концентрации кристаллического золота около 50 ч / млн в течение всех 5 недель исследования, до определить, если золото
обеспеченная наносуспензия работала как эффективное количество обработки.
ФПГ. 50B и 50C, показывают, что как мыши группы 4, так и мыши группы 6 имеют около 5% своих аксонов при соотношении G 0,65. Это соотношение G обсуждается в литературе как представляющее аксоны / миелин, подвергающиеся процессу выздоровления от демиелинизирующего заболевания; где аксоны ЦНС проходят начальный период гипер-ремиелинизации во время восстановления и показывают увеличенный диаметр в течение некоторого времени, прежде чем в конечном итоге вернуться к нормальному g-соотношению 5 . Эти данные следует понимать как означающие, что может произойти сохранение миелина.
Хотя из этих данных трудно определить необходимые концентрации, количества и / или сроки обработки (а также все другие данные, приведенные в настоящем документе), ясно, что различные биологические (патологические) события происходят в зависимости от обеспечения лечения CNM-Au8. обсуждается здесь Выводы
Данные предполагают:
1. У мышей, которым давали купризоновый корм и воду в течение 5 недель, развивалась типичная демиелинизация, которую исследователи искали, как показано путем сравнения гистограмм модифицированной гистограммы на фиг. 48A с одной или обеими из модифицированной гистограммы.
Гистограммы диаграммы на фиг. 48B и 48C.
2. У мышей, которым давали нано-суспензии Cuprizone Feed и CNM-Au8 (через желудочный зонд или ad libitum) в течение всех 5 недель исследования, были похожие гистограммы модифицированной гистограммы (см. Фиг. 50B и 50C), обе из которых превосходили отрицательный контроль. (см. фиг.5 ОА).
3. Только данные по G-соотношению позволяют предположить, что наносуспензии CNM-Au8 положительно
затронутых (то есть, либо уменьшенных демиелинизации, либо вызванных ремиелинизацией) мышей в группах 4 и 6, которые подвергались воздействию купризонового корма и наносуспензий CNM-Au8 в течение всех 5 недель исследования.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Кортикальная демиелинизация характерна для мышиной купризонной модели и зависит от напряжения. Скрипулец Т., и соавт. (Апрель 2008 г.)
2. Нейротоксикант купризон как модель для изучения демиелинизации и ремиелинизации в центральной нервной системе. Мацусима Г.К. и соавт. (Январь 2001 г.) 3. Благотворное влияние миноциклина на индуцированную купризоном демиелинизацию коры.
Скрипулец Т., и соавт. (Сентябрь 2010 г.)
4. Подготовка ткани головного мозга мыши для иммуноэлектронной микроскопии. Tremblay ME et al. (Июль 2010)
5. Каково оптимальное значение G-отношения для миелиновых волокон в ЦНС крыс? Теоретический подход. Хомяк Т. и соавт. (Ноябрь 2009)
6. Реакция клеток NG2 на изменение аксонов в белом веществе спинного мозга у мышей с генетическим нарушением экспрессии субъединицы легких нейрофиламентов. Wu YJ et al. (Октябрь 2008 г.)
7. Ремиелинационная терапия рассеянного склероза. Keough, Michael B. и соавт. (Ноябрь 2012)
8. Спонтанная ремиелинизация после длительного ингибирования альфа-4-интегрина при хроническом EAE. Пирайно П.С. и др. (Июнь 2005 г.) 9. Модель животных купризона: новое понимание старой истории. Кипп Маркус и др. (Сентябрь 2009 г.)
10. Реакция мышей на хелатирующие агенты. Диэтилдитиокарбамат натрия, альфа-бензоиноксим и бисциклогексанон оксальдигидразон. Карлтон В.В. (1966)
11. Исследования по индукции гидроцефалии и губчатой дегенерации путем кормления купризоном и попытки противодействовать токсичности. Карлтон В.В. (1967)
12. Экспрессия мРНК карбоангидразы II и белка в олигодендроцитах при токсической демиелинизации у молодых взрослых мышей. Tansey FA, et al. ((1996)
13. Неинвазивное обнаружение индуцированного купризоном повреждения аксонов и демиелинизации в мозолистом теле мыши. Sun SWl и соавт. (2006)
14. GAS6 усиливает восстановление после индуцированной купризоном демиелинизации. Циперсон В. и др. (2010)
15. Глиальный ответ во время индуцированной купризоном де- и ремиелинизации в ЦНС: извлеченные уроки. Гуди Вл и др. (2014)