При ASCLEPIOS I и II офатумумаб (OMB157) достигал первичных конечных точек, чтобы снизить годовую частоту рецидивов по сравнению с Aubagio ® *(терифлуномидом) у пациентов с рецидивирующими формами РС.
- Ключевые вторичные конечные точки задержки времени для подтверждения прогрессирования инвалидности также были достигнуты; дополнительные вторичные конечные точки будут представлены на ECTRIMS
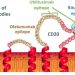
- Ofatumumab, мощное, полностью человеческое антитело, нацеленное на CD20-позитивные B-клетки, обеспечивает устойчивую эффективность с благоприятным профилем безопасности
- Novartis планирует начать подачу документов в органы здравоохранения к концу 2019 года. В случае одобрения офатумумаб потенциально станет лечением для широкой популяции RMS и первой B-клеточной терапией, которую можно будет проводить самостоятельно в домашних условиях.
Базель, 30 августа 2019 г. — Novartis, мировой лидер в области неврологии, сегодня объявил о положительных результатах применения офатумамаба (OMB157) в исследованиях III фазы ASCLEPIOS I и II. В обоих непосредственных исследованиях офатумумаб продемонстрировал превосходство над Aubagio ® * (терифлуномидом) у пациентов с рецидивирующими формами рассеянного склероза (RMS) [1]. В исследованиях ASCLEPIOS была изучена эффективность и безопасность ежемесячного подкожного введения 20 мг офатумумаб по сравнению с однократным ежедневным пероральным приемом Абаджио ® 14 мг у взрослых с RMS [2], [3].
Оба исследования соответствовали первичным конечным точкам, в которых офатумумаб показал очень значительное и клинически значимое снижение числа подтвержденных рецидивов, оцениваемых как годовой уровень рецидивов (ARR) [1]. Ключевые вторичные конечные точки задержки времени для подтверждения прогрессирования инвалидности также были выполнены [1]. Основные результаты исследований ASCLEPIOS Фазы III будут представлены на 35- м заседании.Конгресс Европейского комитета по лечению и исследованиям рассеянного склероза (ECTRIMS), проходящий 11–13 сентября 2019 г. в Стокгольме, Швеция. В целом офатумаб, сильное человеческое антитело, нацеленное на CD20-позитивные В-клетки, обеспечивало устойчивую эффективность с благоприятным профилем безопасности [1]. Профиль безопасности офатумумаба, как видно из исследований ASCLEPIOS, согласуется с результатами наблюдений, полученными на этапе II [1], [4]. Novartis планирует начать подачу документов в органы здравоохранения к концу 2019 года.
«Ясно, что раннее начало высокоэффективного лечения рассеянного склероза улучшает долгосрочные результаты, и существует высокая потребность в мощной, безопасной и удобной терапии, которую можно использовать для лечения рассеянного склероза с самого начала», — сказал профессор Стивен Л. Хаузер, директор Института нейронаук UCSF Вейля. «Результаты ASCLEPIOS являются прекрасной новостью для пациентов, которые хотели бы принять эффективную B-клеточную терапию с низкой потребностью в мониторинге, избегая посещений инфузионного центра».
«Офатумумаб, если он будет одобрен, может стать очень привлекательным вариантом лечения для широкого круга пациентов с СРК, включая раннюю стадию РС», — сказал Джон Цай, глава отдела разработки лекарственных препаратов в мире и главный врач Novartis. «Мощные результаты исследования являются отражением нашей приверженности переосмыслению лечения РС на всех стадиях заболевания».
Об ASCLEPIOS
Исследования ASCLEPIOS I и II (NCT02792218 и NCT02792231) являются двойными, идентичного дизайна, гибкой продолжительностью (до 30 месяцев), двойными слепыми, рандомизированными, многоцентровыми исследованиями фазы III, оценивающими безопасность и эффективность ежемесячного подкожного введения офатумумаб по 20 мг. инъекции по сравнению с пероральными таблетками Aubagio ® по 14 мг, принимаемыми один раз в день у взрослых с подтвержденным диагнозом RMS [2], [3]. В исследованиях приняли участие 1882 пациента с РС в возрасте от 18 до 55 лет с расширенной шкалой статуса инвалидности (EDSS) от 0 до 5,5 [2], [3]. Исследования проводились на более чем 350 участках в 37 странах.
Первичной конечной точкой обоих исследований было продемонстрировать, что офатумумаб превосходит Абаджио ® в снижении частоты подтвержденных рецидивов по оценке ARR у пациентов, получавших лечение до 30 месяцев [2], [3]. Вторичные конечные точки включали время до прогрессирования инвалидности, подтвержденное через три и шесть месяцев, соответственно, подтвержденное улучшение инвалидности через 6 месяцев, гадолиний-увеличивающие поражения T1, количество новых или увеличивающихся поражений T2, сывороточные уровни легкой цепи нейрофиламента (NfL) и скорость объема мозга потеря [2], [3]. Безопасность и фармакокинетические свойства офатумумаба также измерялись на протяжении всего периода лечения [2], [3].
Офатумумаб (OMB157) — это полностью человеческое моноклональное антитело против CD20 (mAb), которое вводится один раз в месяц подкожной инъекцией, которая находится в стадии разработки для РС. Офатумумаб работает, связываясь с молекулой CD20 на поверхности B-клеток и вызывая мощный лизис и истощение B-клеток. Положительные результаты фазы IIb у пациентов с РС были представлены в 2014 году и показали заметное значительное уменьшение числа новых поражений головного мозга в первые 24 недели после введения офатумумаба [4]. Novartis инициировала программу фазы III для офатумумаба в RMS в августе 2016 года. Novartis получила права на офатумумаб от Genmab по всем показаниям, включая РС, в декабре 2015 года.
О Новартис
Novartis переосмысливает медицину, чтобы улучшить и продлить жизнь людей. Как ведущая мировая фармацевтическая компания, мы используем инновационные научные и цифровые технологии для создания преобразующих методов лечения в областях, где есть серьезные медицинские потребности. В нашем стремлении найти новые лекарства мы неизменно занимаем место среди ведущих мировых компаний, инвестирующих в исследования и разработки. Продукты Novartis охватывают более 750 миллионов человек во всем мире, и мы находим инновационные способы расширения доступа к нашим новейшим методам лечения. Около 108 000 человек более 140 национальностей работают в Novartis по всему миру. Узнайте больше на www.novartis.com .