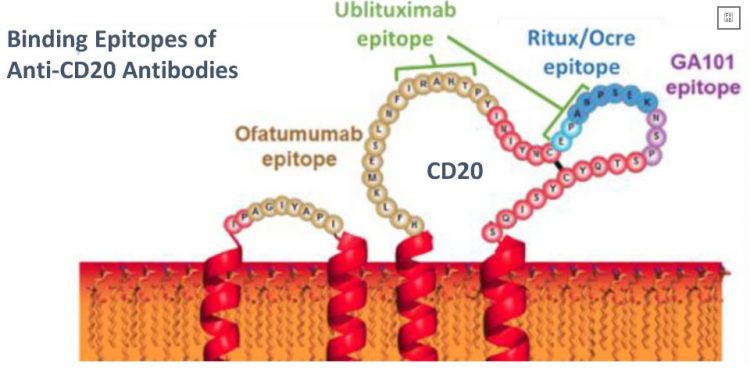
Ofatumumab — это антитело против белка, называемого CD20, который находится на поверхности определенных типов иммунных клеток, называемых B-клетками. Это исследуется как лечение ремиттирующего рассеянного склероза ( RRMS ).
офатумумаб был разработан датской биотехнологической компанией Genmab в рамках соглашения о совместной разработке и коммерциализации с Novartis . Он одобрен Управлением по контролю за продуктами и лекарствами США (FDA) под торговой маркой Arzerra для лечения хронического лимфолейкоза . Помимо RRMS, продолжаются клинические испытания его потенциала для лечения других заболеваний, таких как фолликулярная лимфома .
Как работает офатумумаб?
Рассеянный склероз (РС) — это аутоиммунное заболевание, при котором иммунная система организма по ошибке атакует и повреждает миелиновую оболочку, защитный слой белка, который изолирует нервные волокна.
Точный механизм действия, с помощью которого ofatumumabизменяет рецидив и ремиссию при MS, все еще остается неопределенным. Исследователи знают, что лечение нацелено на В-клетки, связываясь с белком CD20, обнаруженным на их поверхности. Считается, что это приводит к уменьшению количества этих иммунных клеток, которые атакуют миелиновую оболочку.
Офатумумаб в клинических испытаниях
Доклинические исследования на животных моделях дали многообещающие результаты, которые помогли разработчикам приступить к 1-й фазе клинических испытаний на здоровых добровольцах для проверки безопасности офатумумаба. Получив положительные результаты испытаний на безопасность и токсичность, компании перешли к этапам 2 и 3.
В 2011 году было проведено пилотное исследование фазы 2 ( NCT00640328 ) с небольшой группой из 38 пациентов с RRMS, в котором тестировались различные дозы офатумумаба в течение 48 недель. Было отмечено значительное снижение образования мозговых бляшек, наряду с меньшим количеством аутоиммунных В-клеток. Новое образование зубного налета также оказалось подавленным. Эти результаты были опубликованы в научном журнале Neurology .
Эти результаты открыли путь для второго более крупного многоцентрового двойного слепого плацебо-контролируемого исследования фазы 2 ( NCT01457924 ) под названием MIRROR с 232 пациентами с RRMS. Участники были рандомизированы в одну из пяти групп лечения: плацебо, 3 мг офатумумаба каждые 12 недель, 30 мг офатумумаба каждые 12 недель, 60 мг офатумумаба каждые 12 недель или 60 мг офатумумаба каждые четыре недели. Все участники продолжили исследование в течение 24 недель и до истощения (или разрушения) B-клеток.
Результаты показали, что офатумумаб способен быстро истощать В-клетки, в зависимости от дозы и частоты его приема, и эффективно снижает образование новых мозговых бляшек по сравнению с плацебо. Новые или неожиданные данные по безопасности не были зарегистрированы.
В двух рандомизированных двойных слепых исследованиях фазы 3, ASCLEPIOS I ( NCT02792218 ) и ASCLEPIOS II ( NCT02792231 ), сравнивались эффективность и безопасность офатумумаба, введенного под кожу, против Абаджио (терифлуномида ), одобренного лечения РС , у 1881 пациента с RRMS. Участники получали либо офатумумаб каждые четыре недели, либо Абаджио один раз в день.
В исследовании оценивалось количество подтвержденных рецидивов за 12 месяцев, зарегистрированных на срок до 2,5 лет. Ухудшение по инвалидности показало снижение риска на 34,4% через три месяца и на 32,5% через шесть месяцев при применении офатумумаба по сравнению с Абаджио. Улучшение инвалидности через шесть месяцев также показало благоприятную тенденцию к применению офатумумаба, но результаты не были статистически значимыми.
Лечение офатумумабом привело к относительному снижению числа поражений T1 у больных ASCLEPIOS I на 97,5% и у пациентов с ASCLEPIOS II по сравнению с Абаджио на 93,8%. Эти результаты привели исследователей к выводу, что лечение офатумумабом превосходит Абаджио в лечении RRMS.
Нежелательные явления имели место у 83,6% пациентов, получавших офатумумаб, и у 84,2% пациентов, получавших Aubagio. Не было никаких существенных различий между двумя группами в отношении частоты инфекций (2,5% с офатумумабом против 1,8% с Aubagio) или злокачественных новообразований (0,5% с офатумумабом против 0,3% с Aubagio).
Фаза 3 клинического испытания ( NCT03650114 ) теперь запланирована для оценки долгосрочной безопасности, переносимости, эффективности и результатов лечения офатумумабом у пациентов, которые участвовали в предыдущем исследовании. В настоящее время он набирает пациентов в разных точках мира.
Исследование также будет включать в себя дополнительное исследование для оценки ответа антител на выбранные вакцины у подходящих пациентов с RRMS. Поскольку ofatumumab приводит к истощению B-клеток, это может повлиять на реакцию пациентов на прививки. Вакцинация не рекомендуется во время или вскоре после лечения офатумумабом, так как это создает высокий риск инфекции.











Офатумумаб имеет побочку- снижение иммуноглабулина М.Нет восстановления уже больше года. Жду … Но по МРТ спокойно.
Toze samoje.zdu vostonovlenija bolse goda
У меня 1 группа инвалидности существует ли лекарство для улучшения жизни.