Каннабидиол (CBD) — это каннабиноидное соединение, полученное из Cannabis Sativaкоторый не обладает высоким сродством ни к каннабиноидным рецепторам CB1, ни к CB2. Подобно другим каннабиноидам, мы ранее продемонстрировали, что CBD подавляет продукцию интерлейкина-2 (IL-2) из форболового эфира плюс ионофор кальция (PMA / Io) -активированные мышиные спленоциты. Таким образом, целью настоящих исследований была дальнейшая характеристика влияния CBD на иммунную функцию. CBD также подавлял экспрессию мРНК IL-2 и интерферона-γ (IFN-γ), пролиферацию и экспрессию на клеточной поверхности альфа-цепи рецептора IL-2, CD25. Хотя все эти наблюдения подтверждают тот факт, что CBD подавляет функцию T-клеток, мы теперь демонстрируем, что CBD подавляет продукцию IL-2 и IFN-γ в очищенных T-клетках селезенки. CBD также подавляет активность транскрипционной активности белка-1-активатора (AP-1) и ядерного фактора активированных T-клеток (NFAT), которые являются критическими регуляторами IL-2 и IFN-γ. Кроме того, CBD подавлял Т-клеточно-зависимый ответ на образование антител против иммуноглобулина М красных кровяных клеток овцы (анти-sRBC IgM AFC). Наконец, с использованием спленоцитов, полученных из CB1— / — / CB2 — / — мышей было определено, что подавление IL-2 и IFN-γ и подавление in vitro анти-sRBC IgM AFC-ответа происходило независимо от CB1 и CB2. Однако величина иммунного ответа на sRBC была значительно снижена у мышей CB1 — / — / CB2 — / — . Взятые вместе, эти данные предполагают, что CBD подавляет функцию Т-клеток и что CB1 и / или CB2 играют критическую роль в величине in vitro анти-sRBC IgM AFC-ответа.Перейти к:
1. Введение
Каннабиноиды — это группа структурно родственных соединений, полученных из растения Cannabis Sativa , которое широко известно как марихуана. Основным психоактивным конгенером марихуаны является тетрагидроканнабинол (ТГК) [ 1 ]. Хотя в настоящее время ТГК одобрен для медицинского применения в качестве маринола ® , в Соединенных Штатах ведутся споры о том, может ли курение сырой марихуаны быть медицинской необходимостью. Эти дебаты вызвали интерес к определению физиологических свойств некоторых других растительных каннабиноидных соединений. Одним из таких соединений является каннабидиол (CBD), который является одним из наиболее распространенных каннабиноидов в растении.
CBD обладает низким сродством к каннабиноидным рецепторам CB1 и CB2 и, следовательно, не дает «высокого», связанного с употреблением марихуаны [ 2 , 3 ]. Несмотря на это, CBD проявляет иммуносупрессивные свойства. В частности, CBD снижает IL-8 и хемокины MIP-1α и MIP-1β из линии В-клеток человека [ 4 ]. Также было показано, что CBD подавляет вызванный коллагеном артрит [ 5 ] и каррагинан-индуцированное воспаление [ 6 ]. Важно отметить, что CBD был эффективен в сочетании с THC в лечении невропатической боли при рассеянном склерозе, аутоиммунном заболевании [ 7 , 8 ].
Несмотря на эти сообщения, что CBD обладает иммунодепрессивным действием, его влияние на T-лимфоциты не было полностью охарактеризовано. С нашей предыдущей демонстрацией того, что CBD был одним из наиболее мощных растительных каннабиноидов в подавлении IL-2 из PMA / Io-стимулированных спленоцитов [ 9 ], целью настоящих исследований было дальнейшее изучение влияния CBD на функцию Т-лимфоцитов. , Иммунологические конечные точки включают определение влияния CBD на продукцию цитокинов (IL-2 и IFN-γ) из спленоцитов, активированных через рецептор Т-клеток, пролиферацию Т-клеток и В-клеток, ответы AFC и прямые воздействия на очищенные Т-клетки селезенки. Как и многие сообщения в литературе, предполагают участие еще не идентифицированного третьего рецептора каннабиноида [ 10 , 11], Каннабиноидов действия через другие рецепторы [ 12 — 14 ], и что некоторые эффекты КБР могут быть обратными антагонистами рецепторов CB1 и CB2 [ 15 ], мы использовали спленоциты , полученные из СВ1 — / — / CB2 — / — мышей к адресу роль CB1 и CB2 в эффектах CBD в T-лимфоцитах. Наши результаты предполагают, что CBD подавляет функцию T-клеток посредством механизма, который включает AP-1 и NFAT, и мы также обнаружили предполагаемую критическую роль для CB1 и / или CB2 в величине in vitro анти-sRBC IgM AFC-ответа.Перейти к:
2. Материалы и методы
2.1 Реагенты
CBD и THC были предоставлены Национальным институтом по борьбе со злоупотреблением наркотиками (Bethesda, MD). Все другие реагенты были получены от Sigma (Сент-Луис, Миссури), если не указано иное.
2.2 Животные
Самок мышей B6C3F1 или C57BL / 6 без патогенов в возрасте 6 недель приобретали в племенных лабораториях Charles River (Portage, MI). По прибытии мышей рандомизировали, переносили в пластиковые клетки, содержащие подстилки для опилок (5 животных на клетку), и помещали в карантин на 1 неделю. Мыши CB1 — / — / CB2 — / — любезно предоставлены доктором Андреасом Циммером (Университет Бонна) и выведены в Университете штата Мичиган. Мышам давали еду (сертифицированную Purina Laboratory Chow) и воду ad libitumи не использовались для экспериментов, пока их масса тела не составила 17-20 г. Помещения для содержания животных содержали при 21-24 ° С и относительной влажности 40-60% с 12-часовым циклом свет / темнота. Все процедуры с участием мышей выполнялись в соответствии с руководящими принципами, установленными Институциональным комитетом по уходу за животными и их использованию в Университете штата Мичиган.
2.3 Приготовление культур лимфоцитов
Мышей умерщвляли, а селезенки удаляли в асептических условиях. Готовили суспензии отдельных клеток и клетки культивировали в среде RPMI 1640 (Invitrogen, Carlsbad, CA) с добавлением 100 ед. / Мл пенициллина, 100 мкг / мл стрептомицина, 5 × 10 -5 М 2-меркаптоэтанола и 2-10% быка. сыворотка теленка (BCS; Hyclone, Logan, UT). Для иммунофлуоресцентного анализа эритроциты лизировали раствором ACK (150 мМ NH 4 Cl, 10 мМ KHCO 3 , 0,1 мМ EDTA). Клетки Jurkat (клон E6-1, ATCC, Manassas, VA) содержали в среде RPMI 1640 с добавлением 2-10% BCS, 100 единиц / мл пенициллина, 100 мкг / мл стрептомицина, 1 × растворов несущественных аминокислот и пируват натрия (Invitrogen, Карлсбад, Калифорния).
2.4 ИФА
Спленоциты (8 × 10 5 клеток) обрабатывали CBD (0,1-20 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток в течение 24 часов в полной среде, содержащей 2% BCS, в 48-луночных культуральных планшетах по 0,8 мл /. Что ж. Клетки активировали либо 40 нМ / 0,5 мкМ PMA / 10o, либо 100 нг иммобилизованного анти-CD3 плюс 1 мкг / мл растворимого анти-CD28 (BD Biosciences, Сан-Хосе, Калифорния). В качестве альтернативы, клетки Jurkat (5 × 10 4клетки) обрабатывали CBD (0,1-10 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток в течение 24 часов в полной среде, содержащей 2% BCS, в 48-луночных культуральных планшетах при 0,25 мл / лунку. Клетки Jurkat активировали с помощью 40 нМ / 0,5 мкМ PMA / 10 мл. Клетки собирали и супернатанты собирали и анализировали на продуцирование человеческого IL-2 или мышиного IL-2 или IFN-γ методом ELISA. Рекомбинантный очищенный человеческий IL-2 или мышиный IL-2 или IFN-γ (BD Biosciences, Сан-Хосе, Калифорния) служили стандартами, по которым можно было определить количество цитокина в образцах. Захваченные антитела очищали против человеческого IL-2 или против мышиного IL-2 или IFN-γ, а детектирующие антитела представляли собой биотинилированные анти-человеческий IL-2 или против мышиного IL-2 или IFN-γ (BD Biosciences, San Jose, CA). Развитие окраски осуществляли с использованием стрептавидинпероксидазы, а затем тетраметилбензидина (Fluka / Sigma, St. Louis, MO).2 SO 4 , после чего образцы считывали при 450 нм.
2.5 Полимеразная цепная реакция в реальном времени (ПЦР)
Спленоциты (5 × 10 6клетки) обрабатывали CBD (0,5-10 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток в течение 6 часов в полной среде, содержащей 2% BCS, в 6-луночных культуральных планшетах по 5 мл / лунку. Клетки активировали с помощью 40 нМ / 0,5 мкМ PMA / 10o. Клетки собирали и помещали в реагент TRI (Sigma, St. Louis, MO). После разделения фаз с помощью бромхлорфенола РНК осаждали из водной фазы изопропанолом. Остальную часть экстракции, очистки и обработки ДНКазой осуществляли с использованием системы выделения полной РНК Promega SV (Promega, Madison, WI). Общая РНК была подвергнута обратной транскрипции с использованием случайных праймеров с набором обратной транскрипции кДНК High Capacity (Applied Biosystems, Foster City, CA).
2.6 Иммунофлуоресцентный анализ
Спленоциты (8 × 10 5 клеток) обрабатывали CBD (0,2-20 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток с помощью 40 нМ / 0,5 мкМ PMA / 10 в течение 24 часов в полной среде, содержащей 2% BCS, в 48-луночные культуральные планшеты по 0,8 мл / лунку. Клетки собирали, окрашивали антителами, направленными против CD3 или CD25 (CD3-FITC или CD25-PE; BD Biosciences, Сан-Хосе, Калифорния), и анализировали с использованием FACSCalibur (BD Biosciences, Сан-Хосе, Калифорния). Клетки стробировали на основе прямого и бокового рассеяния (FSC / SSC) и данные анализировали с использованием программного обеспечения CellQuest (BD Biosciences, Сан-Хосе, Калифорния).
2.7 Анализы лимфопролиферации
Спленоциты (2 × 10 5 клеток) обрабатывали CBD (0,2-20 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток в полной среде, содержащей 2% (культуры 48 часов) или 5% (культуры 72 часов) BCS. в 96-луночных культуральных планшетах по 0,2 мл / лунку. Клетки активировали либо 40 нМ / 0,5 мкМ PMA / 10o, 100 нг иммобилизованного анти-CD3 плюс 1 мкг / мл растворимого анти-CD28, либо 10 мкг / мл липополисахарида (LPS). Спленоциты, которые были активированы LPS, культивировали в течение 72 часов; спленоциты, которые были активированы с помощью PMA / 10 или анти-CD3 / CD28, культивировали в течение 48 часов. Культуры были пульсированы с 1 мкКи / лунку [ 3H] -тимидин за 18 часов до сбора, и клетки собирали на стекловолоконные фильтры с использованием устройства для сбора клеток PHD (Cambridge Technology, Inc., Watertown, MA). Включение трития измеряли с использованием жидкостного сцинтилляционного анализатора Packard Tri-Carb 2100TR (Packard Biosciences / Perkin-Elmer, Wellesley, MA).
2.8 Смешанный ответ лимфоцитов (MLR)
Спленоциты (1 × 10 5 клеток) обрабатывали CBD (0,2-20 мкМ) с последующей клеточной активацией спленоцитами, не обработанными митомицином C, которые не являются самостоятельными (DBA / 2), в полной среде, содержащей 5% FBS, в 96-луночном круглом дне. культуральные планшеты по 0,2 мл / лунку. Спленоциты DBA / 2 обрабатывали митомицином С в концентрации 40 мкг / мл в течение 60 мин при 37 ° С, 4 раза промывали RPMI и доводили до соответствующей плотности клеток таким образом, чтобы соотношение стимулятор: ответчик составляло 4: 1 (4 × 10 5). обработанные митомицином С DBA / 2 спленоциты: 1 × 10 5 спленоцитов B6C3F1). Клетки культивировали в течение 96 часов. За 18 ч до сбора урожая культуры пульсируют с помощью 1 мкКи / лунку включения [ 3 H] -тимидина и трития, как описано выше.
2.9 Переходные передачи
Клетки Jurkat (5 × 10 5 клеток) трансфицировали с использованием реагента Lipofectamine 2000 (Invitrogen, Carlsbad, CA) в полной среде, содержащей 2% BCS. Плазмиды NFAT-luc, AP-1-luc и pTA-luc были приобретены у Clontech (Mountain View, CA). Вкратце, за каждые 5 × 10 5клетки, подлежащие трансфекции, объединенные клетки инкубировали с 1,5 мкг плазмидной ДНК и 3 мкл реагента Lipofectamine 2000, каждый из которых был доставлен в 50 мкл RPMI 1640. Плазмидную ДНК и реагент Lipofectamine 2000 инкубировали в RPMI 1640 в течение 5 минут, объединяли и оставляли для комплексного взаимодействия. за 20 мин до добавления к клеткам. Затем трансфицированные объединенные клетки распределяли по 48-луночным планшетам по 1 мл / лунку. Через три часа после трансфекции и высевания клетки обрабатывали CBD (1-20 мкМ) в течение 30 минут при 37 ° C с последующей активацией клеток 40 нМ / 0,5 мкМ PMA / 10 в течение 24 часов. Супернатанты собирали и оценивали на IL-2, а клетки оценивали на активность люциферазы.
2.10. Люциферазные анализы.
Активность люциферазы определяли, используя систему анализа люциферазы и репортерный буфер лизиса (RLB) от Promega (Madison, WI). Вкратце, клетки промывали один раз в PBS, затем ресуспендировали в 50 мкл RLB на 5 × 10 5 клеток. Затем клетки замораживали при -80 ° С в течение 10 минут, оттаивали и непосредственно переносили в непрозрачные 96-луночные планшеты для определения активности люциферазы. Субстрат люциферазы (100 мкл) добавляли в каждую лунку с использованием прибора Bio-Tek Synergy HT с программным обеспечением KC4 версии 3.4 (Winooski, VT). После 2-секундной задержки активность люциферазы была обнаружена в течение 10-секундного периода, и данные представлены в виде относительных световых единиц (RLU) в количестве импульсов в секунду (CPS). Определение белка проводили с использованием анализа на бицинхониновую кислоту (BCA; Sigma, St. Louis, MO).
2.11 Очистка Т-клеток
Т-клетки очищали из препаратов цельных спленоцитов с использованием набора для выделения Т-клеток Pan в соответствии с инструкциями производителя (Miltenyi Biotec, Auburn, CA). Вкратце, селезенки собирали и генерировали суспензию отдельных клеток в буфере MACS (PBS, 0,5% BSA и 2 мМ EDTA). Затем клетки инкубировали с коктейлем антител и магнитными шариками, которые допускают отрицательный отбор Т-клеток в присутствии магнитной колонки. Очищенные Т-клетки впоследствии использовали для анализа ELISA и пролиферации. Чистота Т-клеток определялась с использованием иммунофлуоресцентного анализа с антителами, направленными против CD3, и обычно превышала 98%.
2.12. Антителообразующий клеточный ответ in vitro (AFC).
Спленоциты (2,5-5 × 10 6 клеток) обрабатывали CBD (1-20 мкМ) с последующей активацией клеток в полной среде, содержащей 10% инактивированных нагреванием BCS в 48-луночных культуральных планшетах по 0,5 мл / лунку. Клетки активировали либо 6,5 × 10 6 эритроцитов овцы (sRBC; Colorado Serum, Denver, CO), либо 100 мкг / мл LPS. Спленоциты культивировали (sRBC, 5 дней; LPS, 3 дня) в камере для культивирования тканей из нержавеющей стали Bellco, находящейся под давлением до 5,5 фунтов на квадратный дюйм смесью крови и газа, содержащей 10% O 2 , 7% CO 2 и 83% N 2 . Культурную камеру инкубировали при 37 ° С и непрерывно качали в течение периода культивирования. Подсчет антителобразующих клеток был основан на анализе бляшек Джерна [ 16 ,17 ]. Вкратце, аликвоты 50 или 100 мкл культивируемых спленоцитов объединяли с 0,5% расплавленного агара (Difco / BD, Franklin Lakes, NJ), комплементом морской свинки (Gibco / Invitrogen, Carlsbad, CA) и эритроцитами овец, которые покрывали покрытием Стекло покровного стекла размером 24 × 50 мм и оставлено для затвердевания. Планшеты инкубировали в течение, по меньшей мере, 3 часов при 37 ° С, после чего подсчитывали AFC при увеличении в 6,5 раз с использованием устройства для наблюдения за зубами Bellco (Bellco Glass Co., Vineland, NJ).
2.13 In vivo антителообразующий клеточный ответ (АФК)
Мышам (B6C3F1, 5 на группу лечения) вводили CBD (25, 50 или 100 мг / кг) или THC (50 мг / кг) в кукурузном масле с помощью орального зондирования в течение 3 дней. На второй день мышей сенсибилизировали 5 × 10 8 sRBC на мышь путем внутрибрюшинной инъекции. Через четыре дня после сенсибилизации sRBC мышей умерщвляли и регистрировали массу тела, селезенки, тимуса и почек. Затем генерировали отдельные клеточные суспензии спленоцитов и использовали для определения ответа AFC in vivo, как описано выше.
2.14 Статистический анализ
Среднее значение ± SE было определено для каждой группы лечения. Различия между средними были определены с помощью параметрического дисперсионного анализа. Когда были обнаружены значительные различия, терапевтические группы сравнивали с соответствующим контролем , используя два хвостами Даннетта т испытание. После двухстороннего дисперсионного анализа все группы сравнивали с использованием теста Бонферрони. Два-хвостатых т тест был использован для определения статистической значимости между группами , стимулированных в ответ анти-ЭБ IgM — AFC между C57BL / 6 и СВ1 — / — / CB2 — / — мышей. Статистический анализ проводили с использованием GraphPad Prism версии 4.0a для Macintosh OS X, GraphPad Software (Сан-Диего, Калифорния).
3. Результаты
3.1 CBD подавляет продукцию цитокинов в PMA / Io-стимулированных спленоцитах независимо от рецепторов CB1 и CB2
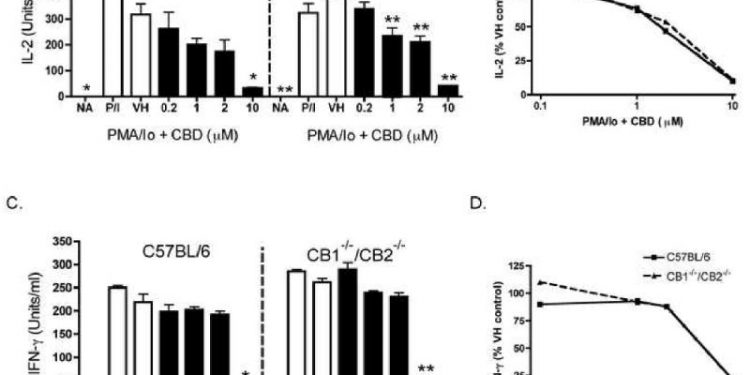
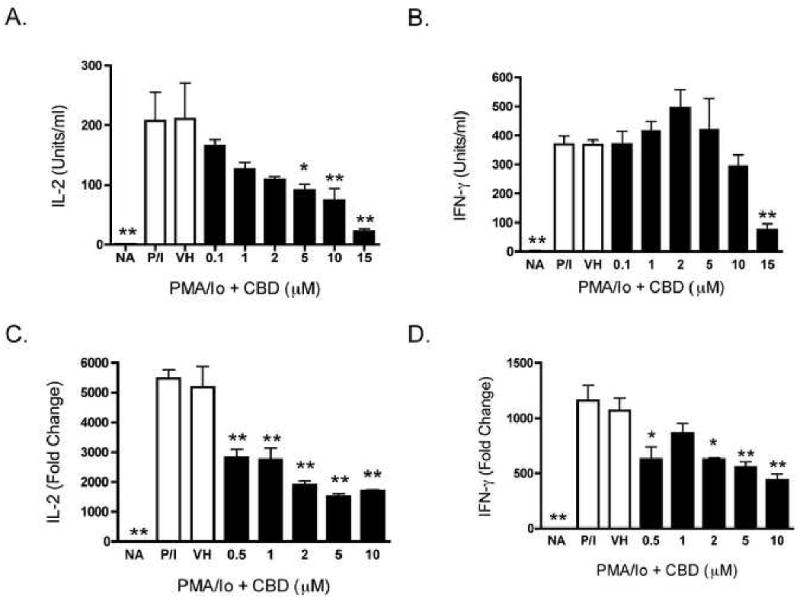
Предыдущая работа нашей лаборатории показала, что CBD был одним из наиболее мощных каннабиноидов для подавления индуцированной PMA / Io продукции IL-2 в спленоцитах [ 9 ]. Как видно на фиг.1В , CBD также подавлял индуцированную PMA / Io продукцию IFN-γ, хотя эффективность, с которой CBD подавлял IFN-γ, была не такой выраженной, как для IL-2 (показано на фиг.1A в качестве сравнительного контроля). CBD-индуцированное подавление обоих цитокинов происходило на уровне мРНК ( фиг. 1C и D). После демонстрации того, что IL-2 является чувствительной мишенью подавления CBD, мы затем определили влияние CBD на экспрессию α-цепи рецептора IL-2 (CD25). CBD подавлял экспрессию CD25 на клеточной поверхности зависимым от концентрации образом в PMA / Io-стимулированных спленоцитах ( Figure 2 ). Интересно, что в отсутствие стимуляции не было большой популяции клеток CD25 + , что позволяет предположить, что первичный эффект CBD на CD25 происходит во время активации Т-клеток, в отличие от воздействия на популяцию Т-регуляторных клеток. Наконец, не было различий в способности CBD подавлять PMA / Io-стимулированный IL-2 и IFN-γ из спленоцитов, полученных от мышей C57BL / 6 дикого типа или мышей CB1 — / — / CB2 — / — ( Figure 3 ) ,
AB.) Спленоциты (8 × 10
5 клеток) обрабатывали CBD (0,1-15 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 24 часов.
Супернатанты собирали и определяли количество IL-2 (A.) или IFN-γ (B.) с помощью ELISA.
Данные выражены в виде средних единиц / мл ± SE для трехкратных культур.
Кр.) Спленоциты (5 × 10
6клетки) обрабатывали CBD (0,5-10 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 6 часов.
ПЦР в реальном времени проводили для IL-2 и IFN-γ.
Изменение фолда рассчитывали по сравнению с NA.
* или ** обозначает значения, которые значительно отличаются от контроля транспортного средства при р <0,05 или 0,01.
Результаты являются репрезентативными как минимум для двух отдельных экспериментов.
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
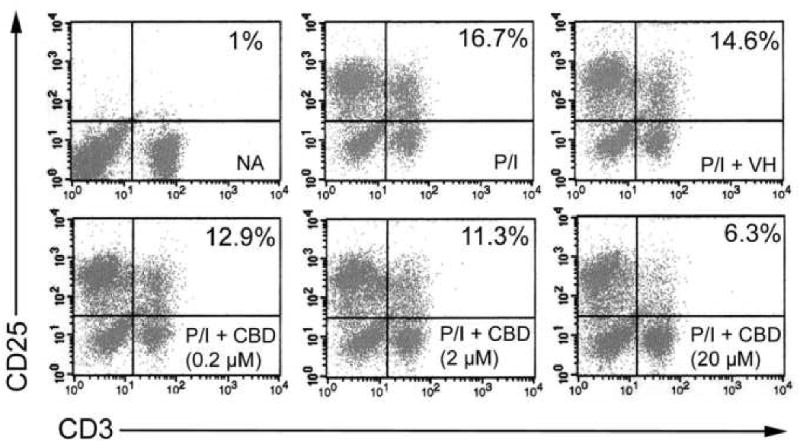
CBD подавлял экспрессию CD25 на клеточной поверхности в PMA / Io-стимулированных спленоцитах B6C3F1.
Спленоциты (8 × 10
5 клеток) обрабатывали CBD (0,2-20 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 24 часов.
Клетки собирали и окрашивали флуоресцентными антителами, направленными против CD3 (FITC) или CD25 (PE).
Клетки были закрыты на FSC / SSC.
Цифры обозначают процент закрытых событий.
Результаты являются репрезентативными для трех отдельных экспериментов.
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
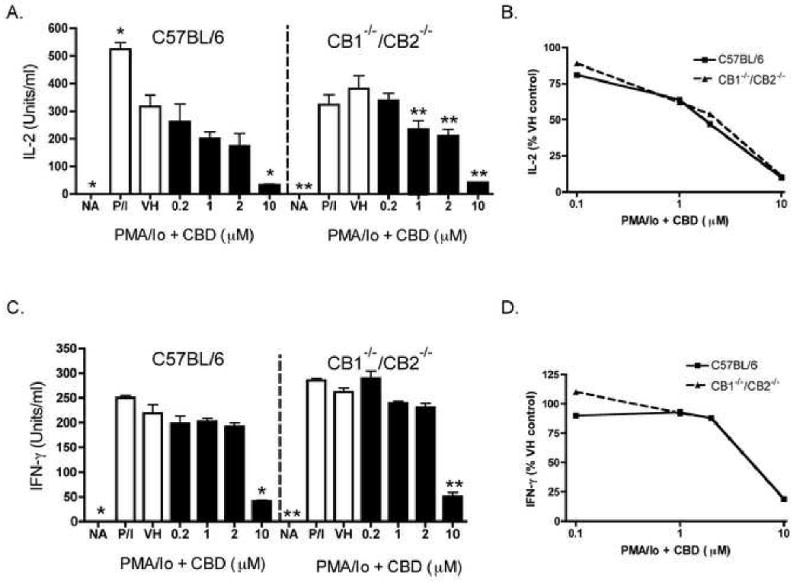
CBD подавлял выработку цитокинов в
спленоцитах
C57BL / 6 дикого типа и CB1
— / — / CB2
— / — .
Спленоциты (8 × 10
5 клеток) обрабатывали CBD (0,2-10 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 24 часов.
Супернатанты собирали и
определяли ELISA
количество IL-2 (AB) или IFN-γ (CD) в C57BL / 6 дикого типа и CB1
— / — CB2
— / — .
Данные выражены в виде средних единиц / мл ± SE для трехкратных культур.
* или ** обозначает значения, которые значительно отличаются от соответствующего контроля транспортного средства при р <0,05 или 0,01.
Данные представлены в виде% VH контроля в B и D. Результаты представляют два отдельных эксперимента.
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
3.2 CBD подавляет продукцию цитокинов в Т-клетках
Чтобы определить, являются ли Т-лимфоциты селезенки непосредственными мишенями ингибирования CBD, спленоциты активировали анти-CD3 / анти-CD28, который исключительно стимулирует Т-лимфоциты через рецептор Т-клеток. Хотя CBD также не так заметно, как ингибирование цитокинов, продуцируемых в ответ на PMA / 10, CBD также подавляет IL-2 и IFN-γ, продуцируемые в ответ на анти-CD3 / анти-CD28 из селезеночных Т-лимфоцитов ( фиг.4А и В ). Кроме того, CBD (CBD) также подавляла индуцированную PMA / Io продукцию IL-2 и IFN-γ из очищенных Т-клеток селезенки (т.е.> 95% чистоты) ( фиг. 4C и D ). Следует отметить, что очищенные Т-клетки были особенно чувствительны к CBD в присутствии PMA / 10, и поэтому для этих исследований были использованы более низкие концентрации CBD.
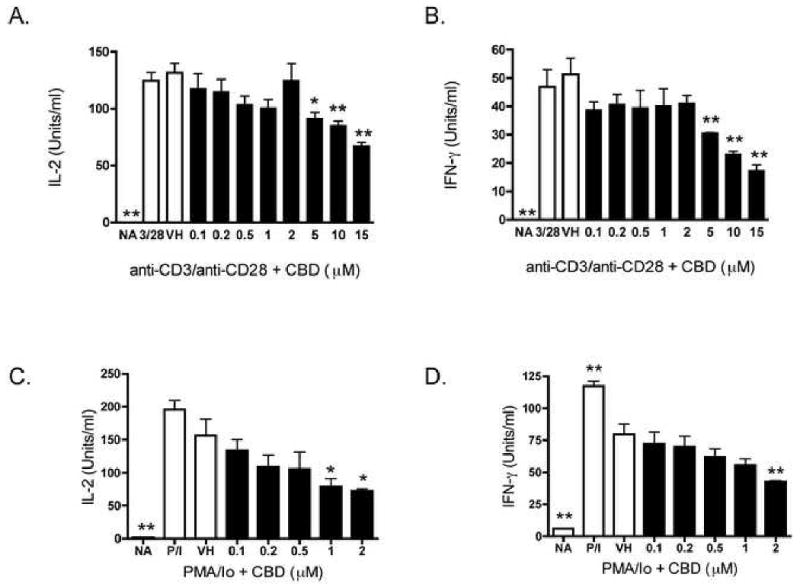
CBD подавляет выработку цитокинов в Т-клетках селезенки B6C3F1.
AB.) Спленоциты (8 × 10
5 клеток) обрабатывали CBD (0,1-15 мкМ) в течение 30 минут с последующей активацией клеток иммобилизованным анти-CD3 плюс растворимым анти-CD28 в течение 24 часов.
Супернатанты собирали и определяли количество IL-2 (A.) или IFN-γ (B.) с помощью ELISA.
Кд.) Т-клетки очищают от спленоцитов (8 × 10
5клетки) обрабатывали CBD (0,1-2 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 24 часов.
Супернатанты собирали и определяли количество IL-2 (C) или IFN-γ (D.) с помощью ELISA.
Данные выражены в виде средних единиц / мл ± SE для трехкратных культур.
* или ** обозначает значения, которые значительно отличаются от контроля транспортного средства при р <0,05 или 0,01.
Результаты являются репрезентативными как минимум для двух отдельных экспериментов.
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
3.3. CBD подавляет пролиферацию клеток в нескольких типах клеток
IL-2, который действует через рецептор IL-2, является критическим цитокином для пролиферации Т-клеток; поэтому мы определили влияние CBD на клеточную пролиферацию. CBD подавлял PMA / Io-стимулированную пролиферацию зависимым от концентрации образом ( Figure 5A ). Однако, поскольку PMA / Io, вероятно, индуцирует пролиферацию в большинстве типов селезеночных клеток, различные стимулы были использованы для нацеливания на специфические клеточные популяции. Клеточная пролиферация в ответ на LPS, который преимущественно активирует B-клетки, также подавлялась CBD в зависимости от концентрации ( фиг. 5B).). Чтобы учесть влияние CBD на пролиферацию Т-клеток, были использованы два различных стимула: анти-CD3 / анти-CD28 или обработанные митомицином C аллогенные лимфоциты (MLR). В ответ на аллогенные лимфоциты, обработанные анти-CD3 / анти-CD28 или митомицином С, оба из которых активируют Т-клетки через рецептор Т-клеток, CBD подавляет пролиферацию Т-клеток ( фиг. 5C и D ).
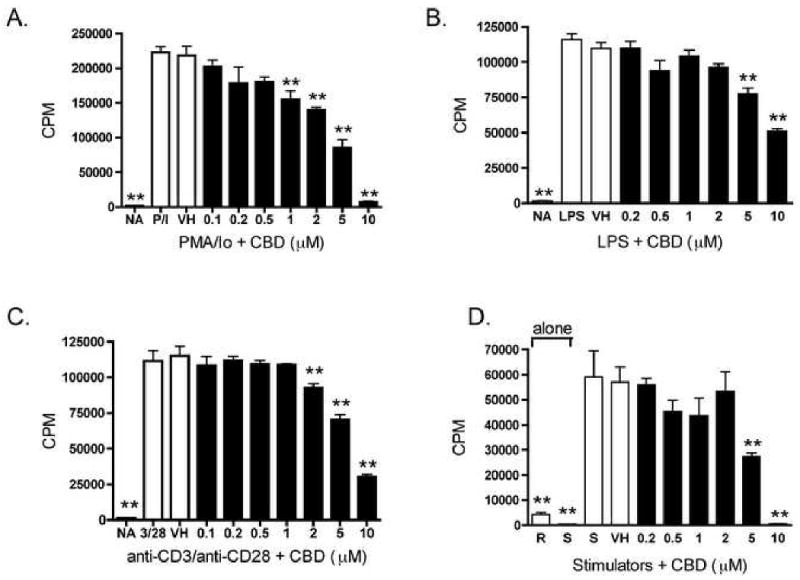
CBD подавлял клеточную пролиферацию в спленоцитах B6C3F1 в ответ на различные раздражители.
AD.) Спленоциты (2 × 10
5 клеток) обрабатывали CBD (0,2-10 мкМ) в течение 30 минут с последующей активацией клеток.
За 18 часов до сбора клеток пульсировали 1 мкКи
3Н-тимидина.
Клетки собирали на стекловолоконные фильтры и измеряли включение трития с помощью жидкостного сцинтилляционного счетчика.
Спленоциты активировали А.) PMA / 10 в течение 48 часов;
B.) ЛПС в течение 72 часов;
C.) иммобилизованный анти-CD3 плюс растворимый анти-CD28 в течение 48 часов;
D.) обработанные митомицином C аллогенные лимфоциты в течение 96 часов.
Данные выражены в виде среднего значения CPM ± SE для четырехкратных культур.
* или ** обозначает значения, которые значительно отличаются от контроля транспортного средства при р <0,05 или 0,01.
Результаты являются репрезентативными как минимум для трех отдельных экспериментов.
R, респонденты;
S, стимуляторы;
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
3.4 CBD подавляет Т-клеточно-зависимый ответ AFC
Одной из функциональных иммунных конечных точек, чувствительных к подавлению другими растительными и синтетическими каннабиноидами, является Т-клеточно-зависимый ответ АФК [ 18 , 19 ]. Как видно на фиг. 6A , и в соответствии с THC CBD подавлял Т-клеточный in vitro -зависимый анти-sRBC IgM-ответ AFC, но не влиял на IgM-AFC-ответ in vitro на поликлональный активатор В-клеток, липополисахарид (LPS; фиг. 6B). ).
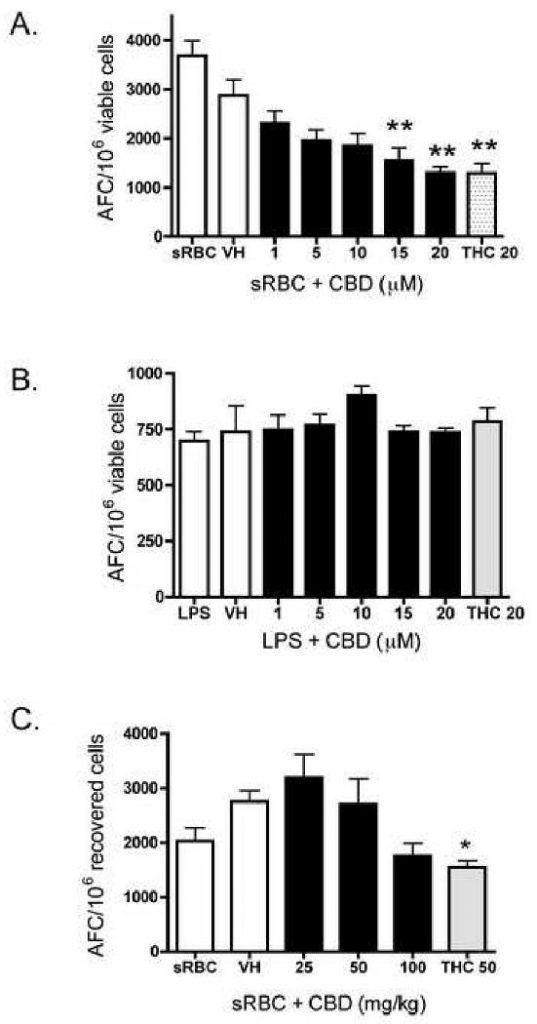
Влияние CBD на ответ IgM AFC в спленоцитах B6C3F1.
AB.) Спленоциты (5 × 10
6 клеток для sRBC; 2,5 × 10
6 клеток для LPS) обрабатывали CBD (1-20 мкМ) или THC (20 мкМ) в течение 30 мин с последующей стимуляцией A.) sRBC для 5 дней или B.) ЛПС в течение 72 часов.
Затем клетки инкубировали в камере для культивирования тканей из нержавеющей стали Bellco под давлением 5,5 фунтов на квадратный дюйм газовой смесью, состоящей из 10% O
2 , 7% CO
2 и 83% N
2 .
Камеру для культивирования помещали при 37 ° С при постоянном покачивании в течение периода культивирования.
Перечисление ответа AFC проводили, как описано в разделе «Материалы и методы».
Данные выражены как среднее значение AFC / 10
6.жизнеспособные клетки ± SE четырехкратных культур.
C.) Мыши B6C3F1 получали CBD (25-100 мг / кг) или THC (50 мг / кг) пероральным зондом в течение 3 дней.
На 2-й день, помимо лекарственного средства, мыши получали однократную внутрибрюшинную инъекцию sRBC (5 × 10
8 клеток / мышь).
Мышей умерщвляли на 6 день, после чего ответ AFC перечисляли, как описано в разделе «Материалы и методы».
Данные выражены в виде среднего AFC / 10
6 жизнеспособных или восстановленных клеток ± SE.
Результаты объединены из двух отдельных экспериментов.
* или ** обозначает значения, которые значительно отличаются от контроля транспортного средства при р <0,05 или 0,01.
Поскольку CBD подавлял in vitro анти-sRBC IgM AFC-ответ, определяли эффект CBD in vivo . Пероральное введение КБР производится скромной модуляцией ответа IgM — AFC к ЭБУ ( фиг.6С ). Хотя ни одна из обработок CBD не вызывала статистически значимой модуляции (при p <0,05), тенденция к CBD-индуцированному подавлению ответа AFC in vivo на sRBC при 100 мг / кг была последовательной в двух отдельных повторностях эксперимента. Величина подавления CBD 100 мг / кг была аналогична величине подавления THC 50 мг / кг. Не было значительных изменений в общей массе тела, весе селезенки или тимуса или в весе почек, предположительно не являющихся мишенями для иммуносупрессии каннабиноидами (данные не представлены).
Хотя CBD, как сообщается, обладает низким сродством к каннабиноидным рецепторам CB1 и CB2 [ 2 , 3 ], мы затем попытались определить и / или подтвердить отсутствие роли CB1 и CB2 в CBD-индуцированной супрессии анти-sRBC. Ответ IgM AFC с использованием спленоцитов, полученных от мышей CB1 — / — / CB2 — / — . Как видно из рисунка 7 , CBD надежно подавлял ответ IgM AFC против sRBC у мышей C57BL / 6. Наблюдалось значительное снижение (p <0,001) общей величины AFC, индуцированной sRBC, у мышей CB1 — / — / CB2 — / — по сравнению с мышами C57BL / 6 (379,7 ± 65,7 против 3829 ± 443, соответственно, в течение 4 отдельных эксперименты, один репрезентативный график изображен вРисунок 7А ). Поскольку наблюдалось такое большое расхождение в величине иммунного ответа на sRBC у мышей CB1 — / — / CB2 — / — , данные также выражали в виде процента от контроля носителя в четырех отдельных экспериментах (фигура 7B ). Не было различий в CBD-индуцированной супрессии IgM-ответа против sRBC ни в одном генотипе, за исключением концентрации 5 мкМ, которая сильно варьировала умышейCB1 — / — CB2 — / — . Вероятно, что CB1 и / или CB2 не вовлечены в CBD-индуцированное подавление in vitro анти-sRBC IgM AFC-ответа. С другой стороны, очевидно, что либо CB1, либо CB2, либо оба вносят вклад в общую величину in vitro. анти-sRBC IgM AFC ответ.
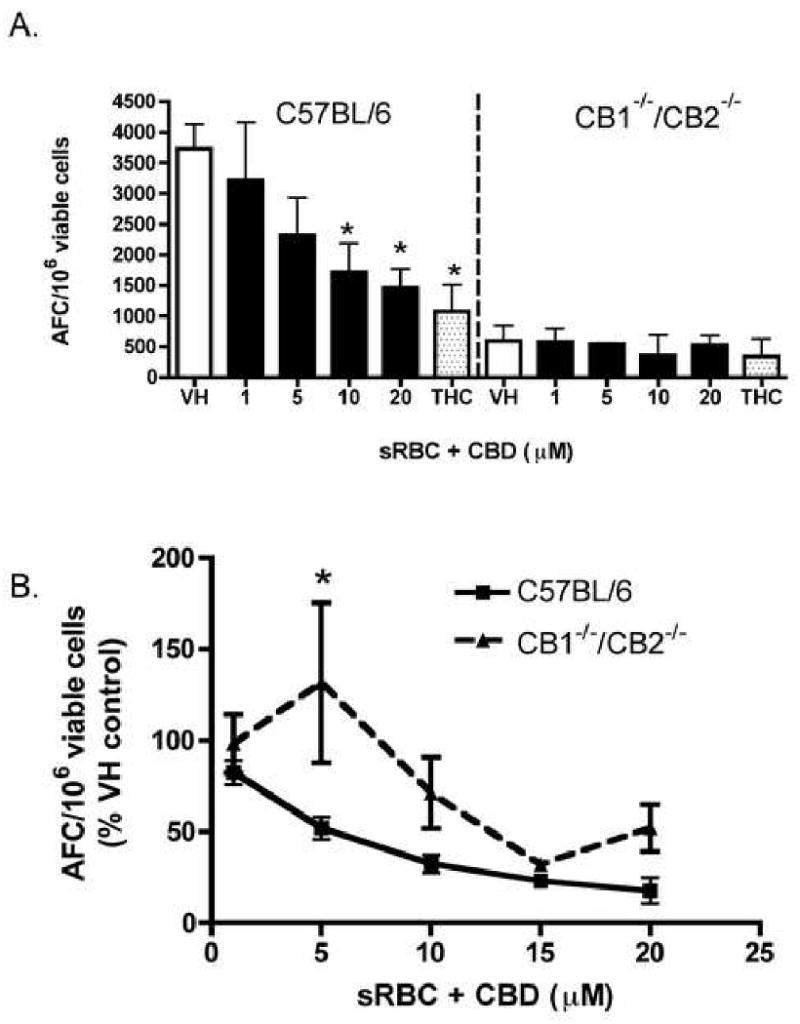
Влияние CBD на
ответ AFC
in vitro в C57BL / 6 дикого типа и CB1
— / — / CB2
— / — спленоцитах.
Спленоциты (5 × 10
6 клеток) из C57BL / 6 или CB1
— / — / CB2
— / — обрабатывали CBD (1-20 мкМ) или THC (20 мкМ) в течение 30 минут с последующей стимуляцией sRBC в течение 5 дней ,
Затем клетки культивировали и подсчитывали AFC, как указано на
фиг.1 .
Данные выражены как среднее значение AFC / 10
6.жизнеспособные клетки ± SE четырехкратных культур для одного репрезентативного эксперимента (A.) или% VH результатов для CBD из четырех экспериментов объединяют, за исключением группы 15 мкМ, которая представляет один эксперимент (B.).
* или ** обозначает значения, которые значительно отличаются от соответствующего контроля транспортного средства при р <0,05 или 0,01.
3.5 CBD подавлял активность репортерного гена NFAT и AP-1 в клетках Jurkat, стимулированных PMA / Io
CBD подавляется IL-2 и IFN-gamma продукцию цитокинов в различных препаратах Т — клеток, оба из которых регулируются несколькими факторами транскрипции, включая АР-1 и NFAT [ 20 — 23 ]. Интересно, что AP-1 и NFAT, как было показано, являются чувствительными мишенями ингибирования многими каннабиноидами [ 24 — 26 ]. Таким образом, мы определили, были ли NFAT и AP-1 также мишенью CBD с использованием AP-1- и NFAT-управляемых репортерных генов люциферазы в T-клетках Jurkat человека. Как показано на фиг.8А , CBD действительно подавлял выработку человеческого IL-2 из PMA / Io-стимулированных T-клеток Jurkat. Кроме того, механизм включает подавление транскрипции, поскольку CBD подавляет PMA / 10-индуцированную экспрессию AP-1- и NFAT-люциферазы зависимым от концентрации образом (Рисунок 8B и 8C , соответственно). Не было никакого влияния на общее содержание белка (данные не показаны) в различных группах лечения, что фактически указывает на то, что подавление активности люциферазы было связано с CBD. В соответствии с другими каннабиноидами [ 26 ], подавление NFAT-люциферазы было более устойчивым, чем AP-1-люцифераза.
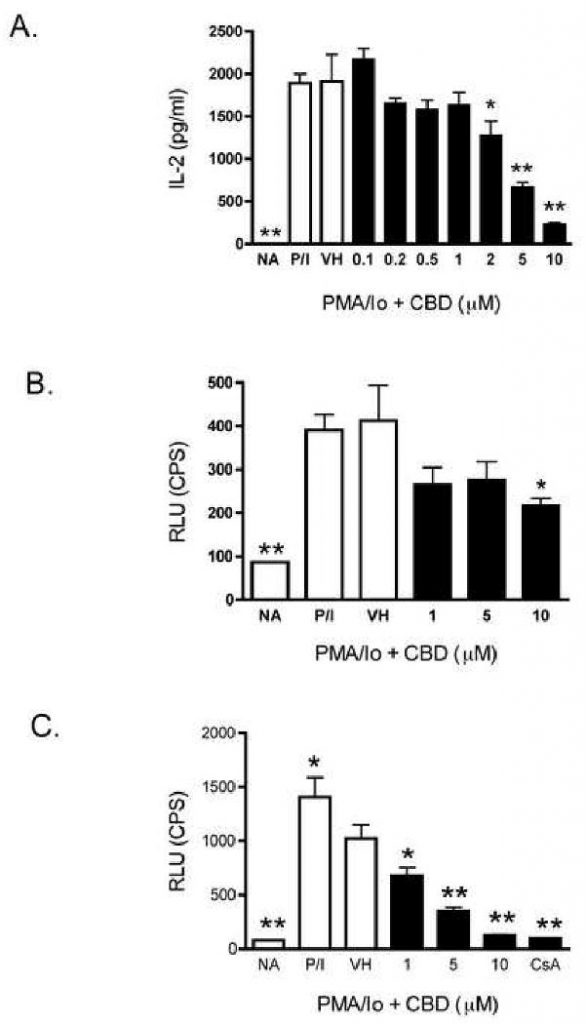
CBD подавлял продукцию IL-2 и активность AP-1 и NFAT в PMA / Io-стимулированных T-клетках Jurkat человека.
A.) Клетки Jurkat (5 × 10
4 клеток) обрабатывали CBD (0,1-10 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 24 часов.
Супернатанты собирали и количество IL-2 определяли с помощью ELISA.
Данные выражены в виде средних единиц / мл ± SE для трехкратных культур.
До н. Э.) Клетки Jurkat (5 × 10
5клетки) временно трансфицировали либо AP-1-люциферазой (B.), либо NFAT-люциферазой (C.).
Через три часа клетки обрабатывали CBD (1-10 мкМ) в течение 30 минут с последующей активацией клеток с помощью PMA / 10 в течение 21 часа.
Активность люциферазы определяли, как описано в разделе «Материалы и методы».
Данные выражены в виде среднего значения CPS для трехкратных культур.
* или ** обозначает значения, которые значительно отличаются от контроля транспортного средства при р <0,05 или 0,01.
Результаты являются репрезентативными как минимум для двух отдельных экспериментов.
NA, наивный (необработанный);
VH, носитель (0,1% этанол).
4. Дискуссия
CBD подавлял некоторые иммунологические конечные точки, с профилем активности, сходным с другими растительными, синтетическими и эндогенными каннабиноидами [ 9 , 18 , 27 — 29 ]. В частности, CBD подавляет выработку цитокинов из активированных первичных спленоцитов мыши зависимым от концентрации образом. Следует отметить наблюдение, что эта супрессия цитокинов происходила независимо от CB1 или CB2, как продемонстрировано в спленоцитах, полученных от мышей CB1 — / — / CB2 — / — . Основные преимущества оценки иммунологических конечных точек с использованием CB1 — / — / CB2 — / —мыши, а не доступные в настоящее время антагонисты CB1 и CB2, являются отсутствием потенциального обратного агонизма и / или прямого действия антагонистов, как сообщалось [ 30 , 31 ]. Несмотря на потенциальную активность с антагонистами при определенных условиях, антагонисты использовались для предположения, что CBD может оказывать некоторые из своих эффектов через CB1 и / или CB2 [ 15 ]. Также имеются недавние доказательства того, что CBD может оказывать свое влияние через еще не идентифицированный каннабиноидный рецептор или недавно идентифицированный предполагаемый каннабиноидный рецептор, GPR55 [ 32 ]. Кроме того, имеются сообщения, что CBD связывает ваниллоидный рецептор, VR1 [ 33 ], является агонистом серотонинергического рецептора 5HT-1a [ 34 , 35] и является агонистом рецепторов A2a в клетках микроглии [ 36 ]. Кроме того, Drysdale, et. и др. продемонстрировали, что вызванное CBD повышение внутриклеточного кальция в клетках гиппокампа усиливалось в присутствии либо антагониста рецептора CB1, либо антагониста рецептора VR1, что указывает на сигнальные взаимодействия между CBD и этими рецепторами по неизвестному механизму [ 30 ]. Хотя мы демонстрируем, что CBD-индуцированное подавление продукции цитокинов из PMA / Io-стимулированных спленоцитов не зависит от CB1 и CB2, мы не можем исключить возможность того, что CBD оказывает свое влияние через один или несколько других вышеупомянутых рецепторов в это время.
В дополнение к подавлению PMA / Io-стимулированной продукции IL-2 CBD подавлял продукцию IFN-γ. Эффект CBD был более выраженным на IL-2, чем IFN-γ из PMA / Io-стимулированных спленоцитов. Однако в спленоцитах, которые стимулировались через рецептор Т-клеток с использованием анти-CD3 / анти-CD28, CBD проявлял аналогичную активность в отношении подавления IL-2 и IFN-γ. Разница в чувствительности вызванной CBD супрессии IL-2 может быть связана с быстрым повышением внутриклеточного кальция, наблюдаемого с PMA / Io, причем PMA / Io-стимулированный IL-2 более чувствителен к быстрому росту кальция, чем анти-CD3 / анти-CD28-стимулированный IL-2. Это подтверждается нашим предыдущим наблюдением, что предварительная обработка спленоцитов агентами, которые повышают внутриклеточный кальций, приводила к подавлению PMA / Io-стимулированного IL-2 [ 9], тогда как эндогенный каннабиноид-2-арахидоноил-глицерин (2-AG) -индуцированный супрессия PMA / Io-стимулированного IFN-γ может быть частично обращен путем увеличения внутриклеточного кальция [ 29 ]. Чувствительность как IL-2, так и IFN-γ, однако, предполагает, что существует общая цель ингибирования CBD. Одной из вероятных общих целей может быть NFAT, поскольку NFAT является критическим как для IL-2, так и для IFN-γ [ 37 ], и поскольку активность NFAT по связыванию ДНК заметно снижается в активированных Т-клетках при культивировании в присутствии двух других каннабиноидов, CBN или 2. -АГ [ 24 — 26]. Действительно, CBD подавлял экспрессию генов AP-1- и NFAT-люциферазы. Хотя CBD-индуцированное подавление экспрессии гена NFAT-люциферазы было более устойчивым, примечательно, что белки AP-1 связываются совместно с NFAT на многих NFAT-чувствительных элементах как в IL-2, так и в IFN-γ [ 21 , 23 ].
Демонстрация того, что CBD подавляет активность NFAT, подтверждается также нашим наблюдением, что CBD подавляет экспрессию CD25 на клеточной поверхности, которая также регулируется NFAT [ 38 ]. Интересно, что этот эффект оказался специфичным для Т-клеток. Хотя CBD подавлял экспрессию CD25 на клеточной поверхности в популяции CD3 + , он не оказывал влияния на CD3 —(т. е. не-Т-клеток, и, по-видимому, в основном B-клеток) популяции. Эти результаты также согласуются с наблюдением, что CBD подавляет ответ AFM IgM на T-клеточный антиген, sRBC, но не влияет на ответ AFC IgM на поликлональный активатор B-клеток, LPS. Это противоречит нашему наблюдению, что CBD также подавляет LPS-индуцированную пролиферацию, которая классически идентифицируется как B-клеточный ответ. Однако есть много доказательств того, что Т-клетки будут пролиферировать в ответ на LPS и что Т-клетки экспрессируют соответствующие toll-подобные рецепторы, важные для этого ответа [ 39 , 40 ]. Альтернативно, эти результаты предполагают, что механизм иммуносупрессии CBD и, вероятно, других каннабиноидов, для которых наблюдалась эта дихотомия [18 ], может включать генерализованное подавление клеточной пролиферации на определенные раздражители. В целом, способность CBD подавлять PMA / Io-, LPS-, анти-CD3 / анти-CD28-индуцированную пролиферацию в сочетании с подавлением MLR, предоставляет больше доказательств того, что CBD нацеливается на T-клетки.
Профиль, с которым CBD нацеливался на выработку и пролиферацию Т-клеток, был очень похож на тот, который ранее сообщался для двух других растительных каннабиноидных соединений, THC и CBN [ 18 , 19 ]. Эти результаты предполагают, что механизмы, с помощью которых эти три растительных каннабиноидных соединения подавляют выработку цитокинов, по крайней мере, in vitro , аналогичны и не требуют CB1 или CB2. Однако CBD лишь незначительно подавлял in vivo анти-sRBC IgM-ответ AFC. Эти данные подтверждают предыдущие исследования, проведенные на самцах мышей CD-1, у которых CBD (≤ 25 мг / кг) не подавлял in vivo анти-sRBC IgM-ответ AFC [ 41 ]. С демонстрацией того, что КБР является эффективным в естественных условияхв различных модельных системах [ 6 , 7 , 15 , 42 ] эти результаты позволяют предположить, что ответ AFC in vivo довольно устойчив к ингибированию CBD. Одним из объяснений отсутствия подавления ответа AFC in vivo является то, что CBD может быстро метаболизироваться in vivo до нефункционального метаболита, особенно потому, что CBD вводили перорально. Несоответствие между CBD и THC in vivo и in vitro подразумевает участие одного или обоих каннабиноидных рецепторов в ответе IgM AFC против sRBC. Еще одно доказательство потребности в CB1 и / или CB2 in vivoНаши анти-sRBC IgM AFC предоставлены нашими наблюдениями о том, что THC-индуцированное подавление этого ответа было отменено у мышей CB1 — / — / CB2 — / — (Springs, et. al. , представленных для публикации), предполагая, что каннабиноиды должны обладать сродство к CB1 или CB2 для подавления ответа AFC in vivo .
Мы также попытались определить роль CB1 и CB2 в CBD-индуцированном подавлении in vitro анти-sRBC IgM AFC-ответа с использованием спленоцитов, полученных от мышей CB1 — / — / CB2 — / — . Интересно, что контрольный ответ IgM AFC против sRBC спленоцитами, выделенными от мышей CB1 — / — / CB2 — / -, был удивительно низким по сравнению с таковым, наблюдаемым у спленоцитов, выделенных от мышей C57BL / 6 дикого типа, что ограничивало нашу способность абсолютно заключить сыграли ли CB1 и / или CB2 критическую роль в подавлении КБД in vitroанти-sRBC IgM AFC ответ. Тем не менее, после изучения данных в процентах от управления транспортным средством, маловероятно, что задействованы CB1 и / или CB2. Хотя между генотипами при более низких концентрациях CBD была разница, ответ был сильно варьирующим, что, вероятно, связано со степенью, до которой клетки CB1 — / — / CB2 — / — стимулировались in vitro с помощью sRBC.
Приведенные выше результаты также убедительно свидетельствуют о том, что CB1 и / или CB2 играют критическую роль в ответе in vitro на анти-sRBC IgM AFC. В настоящее время причины, лежащие в основе заметного различия в величине иммунного ответа на sRBC между спленоцитами, полученными от мышей CB1 — / — / CB2 — / — и мышей C57BL / 6 дикого типа, еще предстоит полностью выяснить. Часть механизма может включать нарушенную функцию вспомогательных клеток (например, макрофагов) у мышей CB1 — / — / CB2 — / -, поскольку не было различий в величине ответа IgM AFC in vitro очищенными B-клетками, активированными лигандом CD40. экспрессирующие L-клетки, стимуляция которых не требует Т-клеток или макрофагов (Springs et al., представленный для публикации). Примечательно, что различий в величине in vivo анти-sRBC IgM AFC-ответа между CB1 — / — / CB2 — / — и мышами C57BL / 6 дикого типа (Springs et al. , Представленные для публикации) не следует, что наличие дополнительных компенсаторных механизмов in vivo .
В целом, CBD существенно не изменяет ответ IgM AFC против sRBC in vivo , но CBD действительно подавляет ряд иммунных ответов in vitro , особенно с участием T-клеток в качестве первичных эффекторов. Используя спленоциты, полученные от мышей CB1 — / — / CB2 — / — , было определено, что CBD-индуцированное подавление продукции цитокинов и подавление in vitro анти-sRBC IgM AFC-ответа не зависело от CB1 и CB2-рецепторов. Что еще более важно, наблюдение значительного различия в контрольном анти-sRBC IgM AFC ответе в CB1 — / — / CB2 — / —мыши по сравнению с мышами дикого типа C57BL / 6 предполагают, что CB1 и / или CB2 играют критическую роль в величине ответа на sRBC in vitro . Эти данные предоставляют детальную характеристику эффектов CBD на различные иммунологические конечные точки и предоставляют дополнительные доказательства того, что механизмы, с помощью которых каннабиноиды модулируют иммунную функцию, зависят как от каннабиноидных рецепторов, так и от них. Наконец, эти данные демонстрируют, что факторы транскрипции в промоторе IL-2 являются чувствительными мишенями ингибирования CBD.
Подтверждения
Мы хотели бы поблагодарить доктора Андреаса Циммера (Университет Бонна) за любезное предоставление мышей с нокаутом CB1 — / — / CB2 — / — . Мы также хотели бы поблагодарить г-на Роберта Кроуфорда и г-жу Эмбер Кроуфорд за отличную техническую помощь и г-жу Кимберли Хэмблтон за помощь в подготовке рукописи.
Эта работа поддержана грантом NIH DA07908 Перейти к:
Сокращения
AFCантителообразующая клеткаCBDканнабидиолаTHCдельта-9-тетрагидроканнабинолIL-2интерлейкин-2Интерфероны-синтерферон-гамма