Каннабиноиды четко модулируют иммунные ответы во время воспалительных процессов, и их иммуносупрессивные эффекты были изучены на многих моделях заболеваний, таких как рассеянный склероз, диабет, септический шок, ревматоидный артрит и аллергическая астма ( Croxford and Yamamura 2005 ; Klein and Cabral 2006 ). Исследования на этих моделях заболеваний наряду со многими в пробиркеэксперименты показывают, что каннабиноиды проявляют свои иммуносупрессивные свойства четырьмя основными способами: (1) индукция апоптоза, (2) ингибирование пролиферации клеток, (3) ингибирование продукции цитокинов и хемокинов и (4) индукция регуляторных Т-клеток (T regs). ). Было опубликовано много обзоров о влиянии каннабиноидов на иммунную систему, особенно обсуждались вторые и третьи пути, упомянутые выше ( Klein et al. 1998 , 2000 ; Klein and Cabral 2006 ). В этом обзоре мы сосредоточимся на каннабиноидах и апоптозе иммунных клеток, а также рассмотрим влияние природных и синтетических каннабиноидов на различные популяции иммунных клеток.
Апоптоз — это процесс запрограммированной гибели клеток, который может быть вызван внутренними факторами, внешними факторами или обоими ( Hengartner 2000 ; Igney and Krammer 2002 ). Поскольку апоптоз устраняет поврежденные, вредные и нежелательные клетки, он играет важную роль в биологических процессах, включая развитие, морфогенез и гомеостаз. Во время апоптоза происходят многие морфологические изменения, такие как блеббинг мембран, сокращение клеток, утечка митохондрий и фрагментация ядер. Молекулярные изменения лежат в основе этих морфологических изменений, и они составляют два различных пути апоптоза: (1) внутренний путь — через митохондрии и (2) внешний путь — через рецепторы смерти ( Hengartner 2000 ; Igney and Krammer 2002). Вкратце, внутренний путь инициируется дисбалансом в антиапоптотических и проапоптотических членах белков семейства Bcl-2, которые регулируют проницаемость митохондриальной мембраны. Дисбаланс в отношении последнего приводит к утечке цитохрома с в цитозоль. Затем цитохром с объединяется с прокаспазой 9, АТФ и APAF-1 с образованием апоптосомы. Апоптосома приводит к образованию активной каспазы 9, расщепляет прокаспазу 3 в активную каспазу 3 и приводит к апоптозу ( Kroemer and Reed 2000). Внешний путь запускается лигированием рецепторов смерти, таких как семейство рецепторов фактора некроза опухоли (т.е. CD95), и приводит к формированию сигнального комплекса, индуцирующего смерть (DISC). DISC содержит каспазу 8 и каспазу 10 в качестве инициаторов каспаз, и эти каспазы активируют каспазу 3, что приводит к апоптозу ( Hengartner 2000 ).
Канопиноид-индуцированный апоптоз в Т-клетках
В то время как курение марихуаны или воздействие каннабиноида марихуаны может вызвать повреждение легких, было показано, что дельта9-этрагидроканнабинол (ТГК) на экспериментальных моделях подавляет иммунные функции и повышает восприимчивость к инфекциям ( Tashkin et al. 2002 ). Исследования in vitro показали, что ТГК может оказывать прямое влияние на иммунные клетки, ингибируя пролиферацию лимфоцитов в культуре, хотя точные механизмы остаются неясными. В 1994 году было показано, что анандамид, лиганд эндогенного рецептора каннабиноида, индуцирует апоптоз в культурах лимфоцитов человека ( Schwarz et al. 1994). Это исследование было также распространено на мышиные макрофаги и Т-клетки, показывая, что обработка культивированных иммунных клеток ТГК вызывает апоптоз посредством регуляции активности Bcl-2 и каспазы ( Zhu et al. 1998 ). Хотя эти исследования открыли новые возможности для дальнейшего изучения апоптоза как механизма иммунотоксичности in vivo, индуцированного ТГК, никаких дополнительных исследований для демонстрации этих эффектов in vivo не проводилось . Одной из причин могло быть то, что обнаружение апоптоза in vivo затруднено, поскольку апоптотические клетки быстро и эффективно очищаются посредством фагоцитоза. Исследования нашей лаборатории установили этот факт с использованием ряда лекарств и химических веществ, включая 2,3,7,8-тетрахлордибензо- п-диоксин (TCDD) и дексаметазон ( Kamath et al. 1997 ; Camacho et al. 2001 ; Singh et al. 2008 ). В этих исследованиях мы отметили, что если иммунные клетки, подвергающиеся воздействию апоптотического химического вещества in vivo , культивируются in vitro в течение дополнительных 12–24 часов, они демонстрируют заметное увеличение апоптоза из-за своей неспособности очиститься in vitro фагоцитами.
Поэтому мы провели систематическое исследование того, вызывают ли каннабиноиды апоптоз in vivo , с использованием нормальных мышей и убедительно продемонстрировали, что это делают ТГК и другие каннабиноиды, что может объяснять иммунотоксичность in vivo . В этих исследованиях мы продемонстрировали, что введение ТГК in vivo (10 мг / кг массы тела) снижало клеточность селезенки и тимуса, затрагивая несколько клеточных популяций, таких как Т-клетки, В-клетки и макрофаги. Неопровержимые доказательства апоптоза получены не только из наблюдения, что клетки, подвергшиеся воздействию in vivo, подвергались усиленному спонтанному апоптозу in vitro.но также то, что воздействие на мышей ингибитора панкаспазы до введения ТГК блокировало апоптотические эффекты ТГК in vivo ( McKallip et al. 2002b ).
Кроме того, обширные исследования in vitro продемонстрировали, что наивные или митоген-стимулированные спленоциты подвергались апоптозу при культивировании с THC, как измерено с помощью анализа TUNEL и окрашивания AnnexinV / PI. При более низкой концентрации (10 мкМ) THC индуцирует только клетки аннексина V +, что указывает на ранние апоптотические клетки. При более высоких концентрациях ТГК (т.е. 20 мкМ) спленоциты были как аннексином V, так и PI-позитивными, которые представляют поздние апоптотические, а также некротические клетки. Одним интересным открытием было то, что в культурах, которые были обработаны только ТГК, и в отсутствие митогена уровни апоптоза были выше, чем в культурах, которые содержали как ТГК, так и митоген ( McKallip et al. 2002b). Эти результаты позволяют предположить, что ТГК может поражать наивные лимфоциты в большей степени, чем активированные лимфоциты. Кроме того, было отмечено, что активированные лимфоциты подавляют экспрессию CB2, что объясняет снижение чувствительности активированных лимфоцитов к THC. Использование антагонистов CB2 блокировало THC-индуцированный апоптоз в этих клетках, в то время как антагонисты CB1 не проявляли значительного эффекта. Эти данные указывают на то, что THC-индуцированный апоптоз в спленоцитах зависит от рецептора CB2. Подобные результаты наблюдались, когда эксперименты повторялись с тимоцитами ( McKallip et al. 2002b ).
Тот факт, что активация CB2 запускает апоптоз в иммунных клетках, предполагает, что нацеливание на CB2 может представлять собой новый подход к лечению воспалительных и аутоиммунных заболеваний. Такое лечение не оказывает психотропного эффекта и может избирательно воздействовать на иммунные клетки. С этой целью Lombard et al. (2007) из нашей лаборатории проверил действие синтетического агониста СВ2, JWH-015, на Т и В-клетки. Было отмечено, что JWH-015 зависимым от дозы образом не только ингибирует пролиферацию, но также индуцирует апоптоз в наивных и активированных спленоцитах и тимоцитах. В этом исследовании результаты подтвердили, что были задействованы как путь рецептора смерти, так и внутренний путь, потому что лечение каспазой 8 и ингибитором каспазы 9 было способно блокировать апоптоз, вызванный JWH-015. В естественных условияхвведение JWH-015 (150 мг / кг массы тела) ингибировало пролиферацию спленоцитов ex vivo при стимуляции ConA. Кроме того, JWH-015 снижал антигенспецифический ответ у мышей, которые подвергались действию стафилококкового энтеротоксина A, что определялось снижением пролиферации SEA-чувствительных Vβ3 + и Vβ11 + T-клеток ( Lombard et al. 2007 ).
Недавно группа исследователей изучила влияние непсихоактивного каннабиноида каннабидиола (CBD) на апоптоз иммунных клеток ( Lee et al. 2008 ). Они продемонстрировали, что CBD вызывает апоптоз в популяциях CD4 + и CD8 + T-клеток в зависимости от времени и дозы. Обработка спленоцитов 4–8 мкМ CBD значительно увеличивала апоптоз, и это определялось процентным содержанием гиподиплоидных клеток и TUNEL-положительных клеток. Кроме того, исследователи показали, что апоптоз был обусловлен образованием активных форм кислорода (АФК), активацией каспазы 8 и каспазы 3. Эта же группа также сообщила, что CBD оказывает сходное воздействие на мышиные тимоциты и клетки EL-4.
Ajulemic acid (Aja) является метаболитом THC и является мощным анальгетическим и противовоспалительным средством ( George et al. 2008 ). Аджа принадлежит к классу каннабиноидов, называемых карбокситрагидроканнабинолами. В контролируемых исследованиях пациентов с нейропатической болью Aja показала такую же эффективность, как морфин и у крыс, она значительно снижала тяжесть артрита, вызванного адъювантом ( Karst et al. 2003 ; Zurier et al. 1998). В одном исследовании изучалось влияние Aja на Т-лимфоциты периферической крови человека. Это исследование показало, что Aja снижал пролиферацию Т-клеток на ∼75% и индуцировал апоптоз в зависимости от дозы (при 1, 3 и 10 мкМ). Инкубация клеток с Aja (10 мкМ) в течение 6 ч повышает активность каспазы 3 в 9 раз, а фрагментацию ДНК — в 2,471,3 раза. Наблюдается широкий диапазон наблюдаемых эффектов Aja на Т-клетки от доноров, и это предполагает, что клетки каждого донора имеют разные уровни чувствительности к апоптозу, вызванному Aja ( Рис. 1 ).
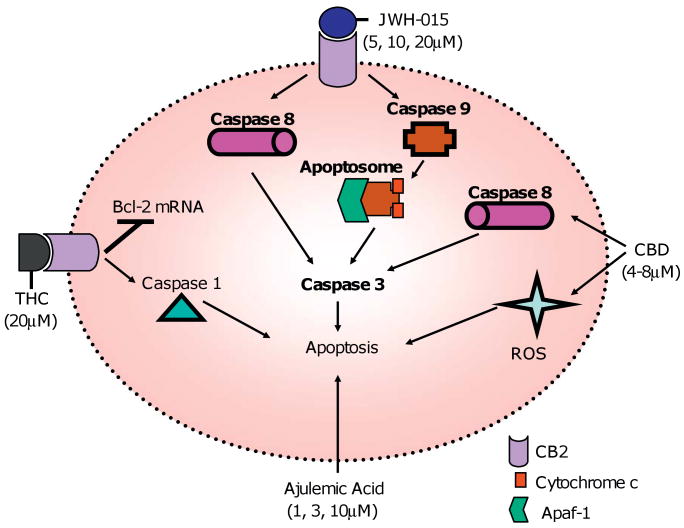
Натуральные и синтетические каннабиноиды вызывают апоптоз в Т-клетках.
THC (20 мкМ) и JWH-015 (5, 10, 20 мкМ) индуцируют апоптоз в Т-клетках посредством лигирования рецептора CB2.
JWH-015 активирует как внутренний путь, так и внешний путь, и THC подавляет мРНК Bcl-2 и индуцирует активность каспазы 1.
Не известно, оказывают ли CBD и Aja свои эффекты через рецептор-зависимые пути;
однако одно сообщение показало, что CBD может опосредовать свое действие через рецептор CB2 ( McKallip et al. 2006 ).
Способность каннабиноидов вызывать апоптоз иммунных клеток in vivo позволяет предположить, что ТГК может быть очень эффективным против воспалительных заболеваний. На модели ConA-индуцированного гепатита мы проиллюстрировали, что THC был способен облегчить повреждение печени у мышей, обработанных ConA, посредством индукции повышенных уровней апоптоза в активированных T-клетках ( Hegde et al. 2008 ). Интересно, однако, что мы также отметили, что обработка THC увеличивала количество Foxp3 + T reg клеток. Такие T reg могут ингибировать индукцию цитокинов, индуцированных in vivo.по КонА. Вместе эти исследования показали, что T regs, в отличие от других T-клеток, могут быть устойчивыми к апоптозу, вызванному THC, и могут подавлять активацию T-клеток, которые избегают апоптоза. Дальнейшие исследования необходимы, чтобы рассмотреть эту возможность.
Эндоканнабиноидная система также играет роль во время болезненных процессов. В крови пациентов с септическим шоком было обнаружено 4-кратное увеличение AEA и 2-AG ( Wang et al. 2001 ), и это также наблюдалось при гипотонии, вызванной LPS ( Varga et al. 1998 ). Использование антагонистов CB1 в модели гипотонии облегчало действие каннабонидов, показывая, что эти соединения влияют на степень воспаления. С другой стороны, соединения WIN играют защитную роль при септическом шоке, поскольку они снижают инфильтрацию лимфоцитов и ингибируют выработку цитокинов ( Di Fillippo et al. 2004 ). Еще раз, этот пример демонстрирует двухфазную роль каннабиноидов в целом.Перейти к:
Чувствительность В-клеток к канопиноидному апоптозу
В-клетки являются антителопродуцирующими клетками иммунной системы, и они экспрессируют наибольшее количество CB2 на своей клеточной поверхности. Несколько сообщений показали, что каннабиноиды оказывают различное влияние на В-клетки, такие как снижение пролиферации клеток и снижение выработки антител (обзор Croxford and Yamamura 2005 ). Также были проведены исследования популяций курящих марихуану, и результаты этих исследований значительно различаются, потому что многие факторы, такие как возраст и генетический фон потребителей, количество потребляемой марихуаны и продолжительность употребления, были разными. В некоторых отчетах, проведенных на людях, было показано снижение количества В-клеток наряду со снижением IgG и IgM ( El-Gohary and Eid 2004 ), в то время как в других не было отмечено изменений в количестве В-клеток и повышения уровней IgE (Rachelefsky et al. 1976 ).
Derocq et al. (1995) продемонстрировали, что активность каннабиноидов не ограничивается иммуносупрессией, а наномолярные концентрации синтетических (СР55, 940 и WIN55212-2) и природных (ТГК) каннабиноидов увеличивают пролиферацию в В-клетках миндалин человека, ко-стимулированных либо анти-Ig, или анти-CD40-антитела. Они утверждали, что этот эффект каннабиноидов был опосредован через рецептор CB2, поскольку блокирование рецептора CB1 с помощью SR141716A не ингибировало пролиферацию. Исследователи отметили, что они также тестировали каннабиноиды в диапазоне 1–100 мкм, и это указывало на то, что высокие концентрации ингибировали пролиферацию.
Независимый от рецепторов механизм каннабиноид-индуцированной гибели клеток был продемонстрирован в культивируемых человеческих В-лимфобластоидных клетках ( Chen and Buck 2000). Исследователи показали, что ТГК, каннабинол и каннабидиол защищают В-лимфобластоидные клетки человека (5/2) от сывороточной гибели клеток при субмикромолярных концентрациях. Кроме того, они иллюстрировали, что действие каннабиноидов не коррелировало с их аффинностью связывания с рецепторами CB1 и CB2, и не было стереоселективности, что предполагало независимое от рецепторов действие каннабиноидов. Они также провели эксперименты с α-токоферолом, наиболее мощным изомером антиоксиданта витамина Е, и с ретинодом ангидроретинолом, который вызывает окислительную гибель клеток либо в присутствии, либо в отсутствие ТГК. Их результаты показали, что, подобно эффекту α-токоферола, и в отличие от ретиноида ангидроретинола, ТГК способен защищать 5/2 клеток от окислительного стресса и гибели клеток.Перейти к:
Индуцированный каннабиноидом апоптоз в нтигенпрезентирующих клетках
Дендритные клетки (ДК) являются наиболее мощными и специализированными антигенпрезентирующими клетками иммунной системы, и было показано, что каннабиноиды вызывают апоптоз в этих клетках через рецепторы CB1 и CB2. Do et al. (2004) продемонстрировали, что THC (5 мкМ или более) и AEA (20 мкМ) индуцировали апоптоз в дендритных клетках, происходящих из костного мозга, у мышей C57BL / 6, которые культивировали в бессывороточной среде, путем вовлечения обоих рецепторов. Было показано, что обработка THC приводила ко многим молекулярным изменениям, таким как активация каспаз 2, 8 и 9, расщепление Bid (белка семейства Bcl2), высвобождение цитохрома с , уменьшение потенциала митохондриальной мембраны и увеличение фосфорилирования Iκβ-α. Это исследование также продемонстрировало in vivo эффекты введения ТГК и показали, что наблюдалось уменьшение количества DC селезенки и экспрессии MHCII на DC.
Лу и соавт. (2006) изучали иммуносупрессивные эффекты ТГК в дендритных клетках, инфицированных Legionella pneumophila (Lp), и сосредоточились на иммуносупрессии Th1. Их результаты показали, что загрузка Lp in vitroв дендритные клетки, и последующее введение мышам привело к иммунизации. Однако, когда дендритные клетки предварительно обрабатывали THC, потенциал иммунизации Lp-нагруженных клеток подавлялся. Обработка THC подавляла продукцию IL-12p40 дендритными клетками, а также ингибировала экспрессию маркеров созревания, таких как MHCII, CD86 и CD40. Исследователи подвергли сомнению, было ли это снижение цитокинов вызвано увеличением апоптоза дендритных клеток после обработки THC, и они продемонстрировали, что 10 мкМ THC не вызывали гибель клеток в DC через 24 часа. Их результаты противоречат До и соавторам (2004)Результаты; Однако это может быть связано с различиями в дизайне эксперимента. Например, Do et al. использовали бессывороточные условия для минимизации ингибирующего воздействия сыворотки на действие каннабиноидов, тогда как Lu et al. использовали сыворотку в своих условиях культивирования. Кроме того, Do et al. использовали DC из костного мозга мышей C57BL / 6, тогда как Lu et al. использовали DC из костного мозга мышей Balb / c.
THC также индуцировал апоптоз в наивных макрофагах, а также в LPS-активированных макрофагах, выделенных из брюшной полости мышей Balb / c ( Zhu et al. 1998 ). Исследователи проверили влияние ТГК на макрофаги с помощью электрофореза в агарозном геле и методов TUNEL и показали, что при концентрации 5 мкг / мл препарат вызывает фрагментацию ДНК, но не повреждает мембрану. Более высокая концентрация лекарственного средства (10 мкг / мл) вызывала значительную фрагментацию ДНК и повреждение мембраны после 24 ч обработки. Что касается механизма действия, исследователи сосредоточились на двух генах: Bcl-2 и caspase-1. Каспаза-1 перерабатывает преждевременный IL-1 в зрелый IL-1, что способствует апоптозу ( Zhu et al. 1994), и когда они использовали ингибитор каспазы Ac-Tyr-Val-Ala-L-аспарагиновой кислоты, фрагментация ДНК, индуцированная THC, подавлялась. После активации макрофаги усиливали экспрессию Bcl-2, но обработка THC снижала уровень Bcl-2 на уровне мРНК. Подобные результаты также наблюдались в спленоцитах.
Джордж и соавт. (2008) изучали влияние Aja на клетки-предшественники остеокластогенеза, которые представляют собой моноциты и макрофаги, и на сами остеокласты. Они использовали клетки костного мозга, инкубированные с фактором, стимулирующим макрофаги (M-CSF), и линию клеток макрофагов мыши в качестве клеток-предшественников, и добавили RANKL к клеткам-предшественникам для получения чистых клеток остеокластов in vitro . В этом исследовании они демонстрируют, что Aja индуцировал апоптоз как в моноцитах-предшественниках и макрофагах, так и в остеокластах в концентрациях от 15 до 30 мкМ.
Влияние каннабиноидов на неиммунные клетки
Каннабиноиды влияют на судьбу клеток во многих других типах клеток, таких как трансформированные нервные клетки, клетки рака молочной железы, гепатоциты и клетки рака простаты ( Guzman et al. 2002 ; Hegde et al. 2008 ). Как обсуждалось ранее, присутствие каннабиноидных рецепторов на клеточной поверхности является ключевым фактором, определяющим, как каннабиноиды будут влиять на определенную популяцию клеток. В одном исследовании изучалось влияние ТГК на клеточные линии рака молочной железы человека и человека, а также на модель рака молочной железы in vivo у мышей ( McKallip et al. 2005). Исследователи продемонстрировали, что карцинома молочной железы мышей 4T1 и клеточные линии рака молочной железы человека MCF-7 и MDA-MB-231 экспрессировали уровни CB1 и CB2 от низкого до неопределяемого; поэтому были устойчивы к THC-индуцированной гибели клеток. Кроме того, это исследование продемонстрировало, что THC создал хозяина с ослабленным иммунитетом и помог в росте опухоли 4T1 и метастазировании у мышей C57BL / 6. Иммуносупрессия опосредована через рецептор CB2, и после обработки THC произошел переход от цитокинов Th1 к цитокинам Th2, таким как IL-4 и IL-10.
Хегде и соавт. (2008) исследовали апоптотическое действие THC на нормальные клетки гепатоцитов мыши, BNL.CL.2, и продемонстрировали, что эти клетки также устойчивы к апоптозу, вызванному THC. В этом исследовании спленоциты использовались в качестве положительного контроля, и исследователи показали, что дозы, которые вызывали гибель клеток в спленоцитах, не могли вызвать каких-либо изменений жизнеспособности клеток в гепатоцитах. Кроме того, исследователи собрали супернатанты из культур спленоцитов (CS), активированных ConA, и проверили способность THC защищать гепатоциты от CS-индуцированной гибели клеток. Они показали, что ТГК снижал процент апоптотических клеток в зависимости от дозы. Эти результаты согласуются с исследованием, в котором изучалось влияние выбранного агониста CB2, HU-308, на модели ишемического / реперфузионного повреждения у мышей C57BL / 6,Раджеш и соавт. 2007 ).
Одно исследование было нацелено на каннабиноидные рецепторы для лечения меланомы на мышиной модели ( Blazquez et al. 2006 ). Они показали, что клетки меланомы экспрессируют рецепторы CB1 и CB2, и что активация рецептора THC и WIN-55,212-2 приводила к ингибированию роста клеток меланомы как in vitro, так и in vivo . Кроме того, они продемонстрировали, что THC и WIN-55,212-2 вызывают остановку клеточного цикла в клетках меланомы посредством ингибирования Akt и гипофосфорилирования белка-супрессора опухоли, ретинобластомы (Rb).
Вывод
Каннабиноиды были одобрены в некоторых странах для лечения тошноты и рвоты, вызванных химиотерапией, и клинические испытания показывают эффективность каннабиноидов в подавлении боли и стимуляции аппетита ( Guzman 2003 ; Tramer et al. 2001). Противовоспалительный терапевтический потенциал каннабиноидов также очевиден из исследований, обсуждаемых в этом обзоре. В оптимальных концентрациях каннабиноиды действительно вызывают апоптоз в иммунных клетках, облегчая воспалительные реакции и защищая хозяина от острого и хронического воспаления. Совокупное действие каннабиноидов на все клеточные популяции иммунной системы может быть полезным, когда существует необходимость в подавлении иммунитета. Например, у пациентов с аутоиммунными заболеваниями, такими как рассеянный склероз, артрит и волчанка, или у пациентов с септическим шоком, когда заболевание вызывается активированными иммунными клетками, воздействие на иммунные клетки с помощью агонистов CB2 может вызывать апоптоз и действовать как противовоспалительное средство терапия. CB2-селективные агонисты не являются психоактивными, и поскольку CB2 экспрессируется главным образом в иммунных клетках, Использование агонистов CB2 может обеспечить новый терапевтический метод против аутоиммунных и воспалительных заболеваний. Очевидно, что дополнительные исследования необходимы для подтверждения этих исследований на людях с помощью клинических испытаний. Однако в других случаях, например у пациентов с раком молочной железы, у которых каннабиноидные рецепторы могут не экспрессироваться раковыми клетками, каннабиноиды могут усугубить заболевание, поскольку иммунная система ослаблена, а клетки рака молочной железы устойчивы к каннабиноидному воздействию. апоптоз. Таким образом, крайне важно сбалансировать иммуносупрессивные эффекты с противораковыми свойствами, что требует тщательных исследований доза-ответ на эти клинические исходы. В целом, для каннабиноидов существует двухфазная роль, и это зависит от трех ключевых факторов: (1) тип каннабиноида, (2) доза каннабиноида, и (3) тип клетки, на которую действует каннабиноид. Степень экспрессии каннабиноидных рецепторов может играть роль в некоторых случаях; однако рецептор-независимый механизм действия очевиден для каннабиноидов в некоторых клеточных популяциях. В дополнение к использованию экзогенных каннабиноидов,манипуляции с эндоканнабиноидами in vivo могут также предложить новые возможности лечения рака и аутоиммунных заболеваний.