Рассеянный склероз (РС) — это хроническое аутоиммунное заболевание, при котором воспалительные поражения вызывают повреждение миелиновой оболочки, покрывающей нервные волокна центральной нервной системы (ЦНС), что приводит к появлению симптомов от онемения конечностей до паралича ( 1 ). Хотя точная этиология MS неизвестна, исследования выявили , что миелин антиген-специфические Th1 и Th17 клетка от периферии пересечь гематоэнцефалический барьер и триггер нейровоспаление , в конечном счете , ведущее к разрушению миелинизированных нервных клеток и производить паралич ( 2 — 9 ). Изнурительные последствия рассеянного склероза и отсутствие в настоящее время эффективных методов лечения оправдывают необходимость продолжения исследований в области терапевтического вмешательства при заболевании.
Было показано, что каннабиноиды марихуаны обладают сильными противовоспалительными свойствами и эффективны при лечении ряда аутоиммунных заболеваний, включая рассеянный склероз ( 10 — 12 ). Кроме того, было показано, что каннабидиол (CBD), основной непсихоактивный каннабиноидный компонент марихуаны, оказывает нейрозащитное действие ( 13 , 14). Такие исследования привели к введению таких препаратов, как сативекс, который состоит в основном из ТГК и КБД, для облегчения нейропатической боли и спастичности при РС. Вероятно, что способность CBD уменьшать невропатическую боль и спастичность может быть независимой от ее противовоспалительных эффектов. Кроме того, крайне важно идентифицировать механизмы, посредством которых CBD подавляет нейровоспаление при MS.
Хотя точно установлено, что патогенез экспериментального аутоиммунного энцефаломиелита (ЭАЭ) регулируется Tregs, недавние исследования показали, что клетки-супрессоры миелоидного происхождения (MDSC) также могут играть критическую роль в подавлении нейровоспаления ( 15 ). MDSCs являются клетками-супрессорами миелоидного происхождения, которые были первоначально идентифицированы у пациентов с опухолями и моделях рака ( 16 ). При раке, MDSCs , как полагают, привод дисфункции Т — клеток , что приводит к стимуляции роста опухоли и метастазов ( 17 — 19 ). Совсем недавно, MDSCs также было показано, что индуцированное на участках воспаления ( 20 — 22), что позволяет предположить, что они могут играть регулирующую роль в смягчении воспалительного ответа ( 10 , 12 , 23 ). При аутоиммунном заболевании MDSC служат привлекательными мишенями для подавления активации и функции аутореактивных Т-клеток ( 24 ). Интересно, что недавние исследования в нашей лаборатории показали, что каннабиноиды, в том числе CBD, при введении мышам индуцируют огромное количество MDSC, которые обладают высокой иммуносупрессией ( 10 , 25 ). Учитывая, что механистическая роль CBD-опосредованной нейропротекции при MS плохо изучена, мы исследовали, вызывает ли CBD подавленную воспалительную реакцию, вызывая увеличение MDSC и последующее подавление Т-клеток.
Используя ЭАЭ в качестве модели РС, мы определили эффект лечения CBD на нейровоспаление, уделяя особое внимание роли MDSCs. Мы обнаружили, что CBD ослаблял прогрессирование заболевания, главным образом, за счет индукции MDSC, поскольку истощение MDSC могло частично обратить вспять процесс ослабления заболевания, а адоптивный перенос CBSC-индуцированных MDSC в наивных мышей защищал их от развития EAE.
Материалы и методы
Использование и уход за животными
Самки мышей C57BL / 6 были приобретены в Национальном институте здравоохранения (NIH) (Bethesda, MD, США). Все животные содержались в Университете Южной Каролины для животных (Колумбия, Южная Каролина, США). Все процедуры на животных выполнялись в соответствии с руководящими принципами NIH в соответствии с протоколами, утвержденными Комитетом по уходу за животными и их использованию Университета Южной Каролины.
Реактивы
Реагенты, использованные в этом исследовании, были приобретены, как описано: CBD (NIH, Bethesda, MD, USA), пептид миелинового олигодендроцитарного гликопротеина (MOG35–55), H-MEVGWYRSPFSRVVHLYRNGK-OH (PolyPeptide Laboratories, Сан-Диего, Калифорния, США), RBC буфера для лизиса, пропидиум иодид, гематоксилином и эозином (Sigma-Aldrich, St. Louis, МО, США), RPMI 1640, л -glutamine, HEPES, фосфатно-буферный солевой раствор (PBS) , и эмбриональной бычьей сыворотки (VWR, West Chester, Пенсильвания, США), Percoll (GE Healthcare Life Sciences, Питсбург, Пенсильвания, США).
Индукция схемы лечения ЭАЭ и КБР
Экспериментальный аутоиммунный энцефаломиелит был индуцирован в группах из 10 самок мышей C57BL / 6 (6–8 недель), как описано ранее ( 23 , 26 , 27 ). Вкратце, мы ввели 100 мкл 150 мкг пептида MOG35–55, эмульгированного в полном адъюванте Фрейнда (Difco, Детройт, Мичиган, США), содержащего 4 мг / мл убитого Mycobacterium tuberculosis.(штамм H37Ra; Difco) подкожно. После иммунизации 200 нг токсина коклюша (List Labs, Кэмпбелл, Калифорния, США) вводили внутрибрюшинно мышам в день 0 с последующей внутрибрюшинной (внутрибрюшинно) инъекцией токсина 400 нг в день 2. КБД (20 мг / кг; 16% ДМСО (PBS) вводили ежедневно, начиная с 9 по 25 день внутрибрюшинным путем. Мыши EAE, обработанные носителем, были обозначены как EAE-VEH, а мыши, которые получали CBD, были EAE-CBD.
Клинические показатели (0, нет клинических признаков; 1 — слабый хвост; 2 — частичный паралич задних конечностей; 3 — полный паралич задних конечностей или частичный паралич задних и передних конечностей; 4 — тетрапаралич; 5 — отмирание; 6 — смерть); записывается ежедневно. Средний балл рассчитывался для каждой группы каждый день. Каждый эксперимент повторяли, по меньшей мере, дважды с постоянными результатами
Исследования с использованием MDSC
Полученные из миелоидов супрессорные клетки выделяли из брюшной полости мышей, которым инъецировали CBD, как описано ( 28 ), и 4 × 10 6 клеток вводили внутрибрюшинно для адоптивного переноса. Спленоциты от наивных мышей служили в качестве контроля. Чтобы истощить MDSCs in vivo , мы использовали анти-Gr-1 Abs (RB6-8C5) или контроль изотипа Ab, назначенный через 3 часа после инъекции CBD в дозе 0,1 мг каждые 48 часов.
Обнаружение цитокинов в культурах спленоцитов сыворотки и ex vivo
Экспериментальные мыши с аутоиммунным энцефаломиелитом кровоточили на 16 день после иммунизации MOG35–55, и сыворотку отделяли. Кроме того, супернатанты из культур спленоцитов, активированных in vitro с помощью MOG, собирали после 72 ч культивирования. Уровни цитокинов для IFNγ, IL-10, IL-17 и TNFα определяли для сывороточных и культуральных супернатантов. Все цитокины измеряли с использованием наборов BioLegend ELISA Max (Сан-Диего, Калифорния, США), как описано в Busbee et al. ( 29 ).
Окрашивание клеток антителами и использование проточной цитометрии
Клетки окрашивали флуоресцентными конъюгированными антителами и анализировали с использованием Beckman Coulter FC500 (Индианаполис, Индиана, США) для определения фенотипов инфильтрирующих клеток в ЦНС. Используемые антитела: конъюгированный с флуоресцеином изотиоцианат (FITC) анти-мышиный CD4 (L3T4) (клон GK1.5; крысиный IgG2b), FITC-конъюгированный анти-мышиный Ly-6G / Ly-6C (Gr-1) (клон RB6-8C5) ; Крысиный IgG2b), конъюгированный с фикоэритрином (PE) анти-мышиный / человеческий CD11b (клон M1 / 70; крысиный IgG2b), аллофикоцианин анти-мышиный CD8 (Ly-2) (клон 53-6.7; крысиный IgG2a) и РЕ анти-PE -мыши CD3ε (клон 145-2C11; IgG хомяка).
Культура клеток
Культуры клеток поддерживали в полной среде RPMI 1640, дополненной 10% инактивированной нагреванием фетальной бычьей сывороткой, 10 мМ HEPES, 10 мМ l- глутамином, 50 мкМ β-меркаптоэтанолом и 100 мкг / мл пенициллина / стрептомицина при 37 ° С и 5 ° С. % СО 2 .
Ex Vivo MOG35–55 Рестимуляция
Спленоциты от наивных, EAE-VEH или EAE-CBD мышей выделяли через 16 дней после иммунизации и культивировали в 96-луночном планшете в присутствии 30 мкг / мл MOG35–55 в течение 3 дней. Супернатанты собирали для анализа цитокинов. Перед сбором спленоцитов стимулировали иономицином, ацетатом форбола миристата, Golgi-Plug в течение 4-6 часов с использованием коктейля активации лейкоцитов (BD Biosciences).
Выделение инфильтрирующих клеток ЦНС
Экспериментальным мышам, индуцированным аутоиммунным энцефаломиелитом, давали носитель или CBD, как указано ранее. На 16-й день собирали кровь и выделяли сыворотку для анализа цитокинов / хемокинов. Селезенку и паховые лимфатические узлы иссекали до перфузии. Затем мышей перфузировали гепаринизированным PBS по 10 мл и выделяли целую ткань головного и спинного мозга. Ткани гомогенизировали раздельно в одноклеточную суспензию и подвергали лизису эритроцитов. Мононуклеарные клетки из гомогенатов всего головного и спинного мозга выделяли с использованием 33% Percoll, как описано в Rouse et al. ( 27). Клетки подсчитывали и окрашивали флуоресцентно меченным Abs, как указано. Абсолютное количество клеток рассчитывали по следующему уравнению: Общее количество клеток, имеющих конкретного производителя = Процент клеток с маркером, проанализированный с помощью проточной цитометрии × Абсолютное количество клеток / 100.
Выделение MDSCs
Через шестнадцать часов после введения CBD мышей умерщвляли и собирали перитонеальный экссудат. Вкратце, брюшную полость трижды промывали ледяной 1 × PBS (5 мл / промывка) в течение 5 минут при перемешивании для восстановления клеток. Клетки ресуспендировали в 1 мл, обрабатывали Fc-блоком в течение 10 минут и метили PE-конъюгированным анти-Gr1. Процедура EasySep-положительного отбора PE (STEMCALL Technologies, Ванкувер, Британская Колумбия, Канада) была использована для выделения клеток Gr1 + , как описано ранее. После выделения клетки метили FITC-конъюгированным анти-CD11b и оценивали на чистоту с помощью проточно-цитометрического анализа ( 12 , 30 ). Мы указали на использование очищенного Gr1 + CD11b +MDSCs в таких случаях, когда клетки были обогащены посредством положительного отбора.
Статистика
Статистический анализ проводили с использованием GraphPad Prism 5.0 (Сан-Диего, Калифорния, США). Для экспериментов EAE мы использовали группы из 10 мышей, а цифры представляют как минимум два независимых эксперимента. Клинические показатели мышей EAE в различные моменты времени сравнивали между различными группами с использованием теста Манна-Уитни, как описано ( 27 ). В экспериментах in vitro данные, использованные на каждой фигуре, представляют собой среднее ± SEM по меньшей мере трех экспериментов. Статистическая разница была рассчитана с использованием ANOVA и t- критерия Стьюдента , и там, где заявленный последующий анализ был выполнен с помощью метода Тьюки. Значение <0,05 считалось статистически значимым.Перейти к:
Результаты
CBD значительно снижается ЕАЕ
Для изучения влияния КБР на EAE, мы индуцированное EAE , используя MOG в качестве антигена и обрабатывали мышей с транспортным средством (ЕАЕ-VEH) или CBD (EAE-CBD) , как показано на рисунке Figure1A.1 А. CBD (20 мг / кг) лечение ЕАЕ мышей было начато в начале клинических признаков (день 9) и с учетом каждый день до конца исследования (день 25) (рис (Figure1A).1 А). ЕАЕ-VEH мышей постепенно развилась болезнь EAE , как видно из клинических скоринг (рис (Figure1B)1 В) со 100% случаев и максимальный средний балл 4,1 ± 0,17. Лечение с CBD задержкой начала болезни и значительно ослабленные клинические признаки EAE (максимальный балл 2,2 ± 0,16) (рис (Figure1B).1Б). Кроме того, значительное увеличение инфильтратов мононуклеарных клеток видели в спинном мозге и головном мозге ЕАЕ-VEH мышей ослабляется при обработке CBD (рис (Figure1C).1 С). Кроме того, лечение CBD значительно уменьшили повышенные CD3 + CD4 + и CD3 + CD8 + число клеток видели в ЦНС ЕАЕ-VEH мышей (рис (Figure1D).1 D). Сыворотку собирали из ЕАЕ-VEH мышей отображаются повышенные уровни IFN & gamma ; и IL-17 в то время как обработка CBD значительно снижается эти воспалительные уровни цитокинов (рис (Рисунок11 E).
Влияние лечения CBD на про- и противовоспалительные цитокины и факторы транскрипции
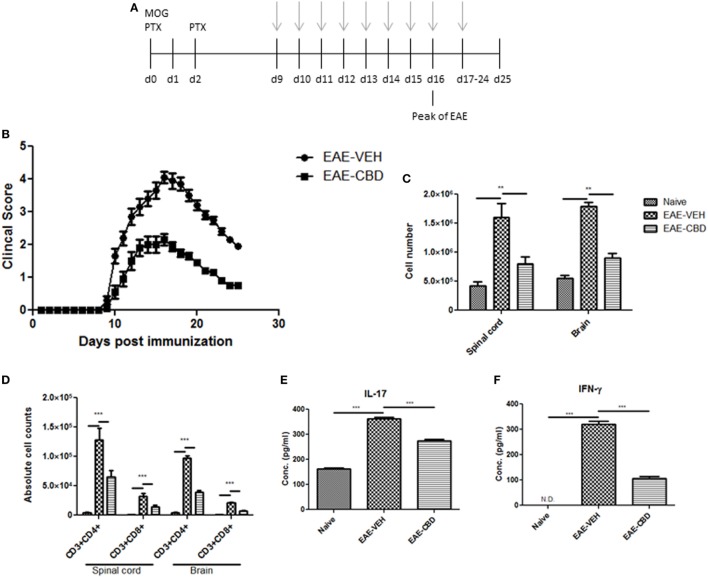
Влияние лечения каннабидиолом (CBD) на развитие экспериментального аутоиммунного энцефаломиелита (EAE) у мышей C57BL / 6.
(A) Схема временной шкалы исследований.
Лечение CBD проводилось в моменты времени с серыми стрелками.
Данные были оценены на пике заболевания, если не указано иное.
(B) Клинические показатели (
n = 10 мышей на группу);
данные были представлены как среднее ± SEM и проанализированы на значимость с помощью
U- критерия
Манна-Уитни.
Сравнения считали достоверными при
p ≤ 0,05, обозначенном *.
Данные представляют как минимум два независимых эксперимента;
в каждом эксперименте заболеваемость составляла 100% для каждой группы.
(C) Общее количество мононуклеарных клеток в центральной нервной системе.
(D) Абсолютное количество клеток для CD3 + CD4 + T-клеток и CD3 + CD8 + T-клеток;
мононуклеарные клетки окрашивают соответствующими Abs и затем подсчитывают, используя общее количество клеток и частоту из проточной цитометрии.
(E) Уровень сывороточной экспрессии провоспалительных цитокинов IL-17 и IFNγ, анализируемых методом ELISA.
На панелях
(D – F) все данные представлены как среднее ± SEM.
ANOVA, ***
р <0,0001 и **
р <0,001 с помощью
специального теста
Тьюки.
Поскольку EAE запускается главным образом клетками Th1 и Th17, мы затем изучили влияние CBD на цитокины, связанные с этими клетками. Кроме того, мы также изучили влияние CBD на некоторые критические факторы транскрипции и цитокины: Tbx21 (T-bet), RORγT и IL-10. С этой целью CD4 + Т-клетки селезенки были очищены от наивных, EAE-VEH и EAE-CBD мышей на 16 день, и была выделена общая РНК. У мышей EAE-VEH был значительно повышен T-бет и RORγT по сравнению с мышами-наивниками, и лечение CBD значительно снижало эти уровни. Кроме того, экспрессия IL-10 была значительно увеличена в ЕАЕ-CBD мышей по сравнению с ЕАЕ-VEH мышей (рис (Figure2A).2А). Чтобы дополнительно выяснить влияние CBD на MOG-специфическую активацию и функцию Т-клеток, мы культивировали спленоциты от наивных, EAE-VEH и EAE-CBD мышей in vitro в присутствии пептида MOG35–55 в течение 3 дней. Супернатанты из клеток мышей EAE-VEH, повторно стимулированных MOG, демонстрировали повышенные уровни цитокинов IFNγ, IL-17, TNFα и IL-10, тогда как аналогичные клетки мышей EAE-CBD продуцировали значительно меньше IFNγ и IL-17 и увеличивали IL-10 производство, производя аналогичные уровни TNF & alpha ; (рис (Figure2B).2 В). Вместе эти данные продемонстрировали, что лечение CBD стимулировало противовоспалительные цитокины и факторы транскрипции, одновременно уменьшая провоспалительные.
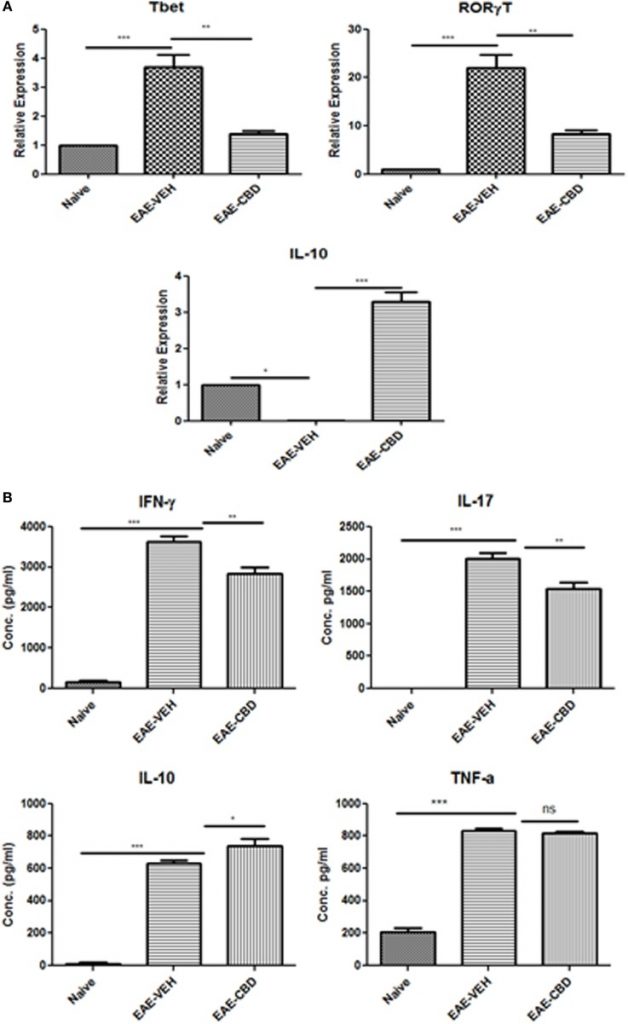
Профиль экспрессии в CD4
+ T-клетках
селезенки
от экспериментальных мышей с аутоиммунным энцефаломиелитом (EAE).
(A) Спленоциты выделяли из наивных, EAE-VEH и EAE-каннабидиола (CBD) на 16-й день, а CD4
+ T-клетки очищали с использованием набора для отбора MAC.
Тотальную РНК выделяли и образцы анализировали на T-bet, IL-10 и RORγT.
Данные представляют как минимум два независимых эксперимента;
в каждом эксперименте
n = 3–5 мышей на группу.
(B) Спленоциты из наивных (
n = 4), EAE-VEH (
n = 4) и EAE-CBD (
n = 4) были выделены через 16 дней после индукции заболевания.
Клетки повторно стимулировали пептидом MOG35–55 (30 мкг / мл) в течение 3 дней.
Супернатанты собирали и анализировали на IFNγ, IL-17, IL-10 и TNFα.
Данные представлены как среднее ± SEM.
ANOVA, ***
р <0,0001, **
р <0,001 и *
р <0,05 с помощью
специального теста
Тьюки
Лечение CBD приводит к индукции MDSC и подавлению MOG-специфической пролиферации Т-клеток
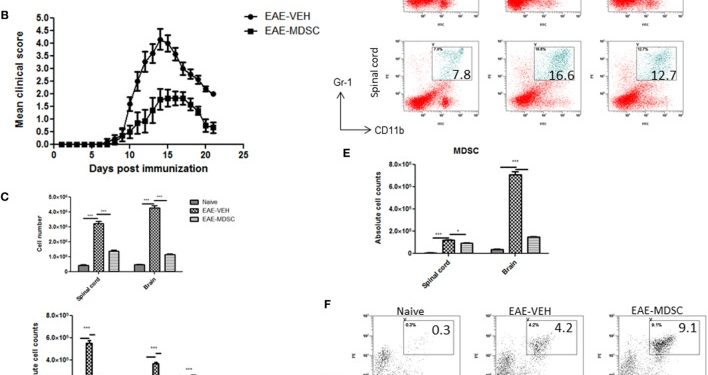
Было показано, что CD11b + Gr-1 + MDSC играют решающую роль в ослаблении воспаления, и наша лаборатория ранее сообщала, что лечение CBD индуцирует высокие уровни CD11b + Gr-1 + MDSC, которые подавляют аутоиммунный гепатит ( 10 ). Поэтому в настоящем исследовании мы исследовали, была ли способность CBD подавлять EAE связана с индукцией MDSC. Поскольку CBD вводили внутрибрюшинным путем, мы перечислили инфильтрацию MDSC в брюшную полость и обнаружили, что у мышей с EAE-CBD наблюдается значительный приток CD11b + Gr-1 + MDSC по сравнению с мышами с EAE-VEH, что было продемонстрировано на дни 10 и 12 и сужаться на 16 -й день (фиг(Figure3A).3 А). Затем мы определили, привело ли лечение CBD к увеличению количества CD11b+Gr-1+клеток в ЦНС. Однако данные указывают на то, что лечение CBD не привело к увеличению количестваклетокCD11b+Gr-1+в ЦНС, и на самом деле у мышей EAE-VEH было большеклетокCD11b+Gr-1+в спинном мозге и головном мозге, чем умышей.ЕАЙ-CBD мышей (рис(Figure3B).3 В). Уменьшенные количества CD11b+Gr-1+Клетки видели в ЕАЕ-CBD мышей в ЦНС может быть связано с тем , что было значительно уменьшилось количество инфильтрации клеток в ЦНС , как показано ранее (рис (Figure1E).1 Е). Эти данные позволяют предположить, что CBD индуцирует CD11b + Gr-1 + клетки на периферии, но не в ЦНС. Кроме MDSCs, также известно, что нейтрофилы экспрессируют фенотип CD11b + Gr-1 + . Однако ранее мы показали, что клетки CD11b + Gr-1 +, индуцированные CBD, являются MDSC, а не нейтрофилами, поскольку они обладают сильным иммуносупрессором, а нейтрофилы — нет ( 10 ). Для дальнейшего определения, является ли CBD-индуцированный CD11b + Gr-1+ клетки действительно были MDSC с иммуносупрессивными функциями, мы культивировали спленоциты от мышей EAE-VEH in vitro с пептидом MOG35–55 в течение 3 дней в присутствии или в отсутствие CBD-индуцированных MDSC, выделенных из внутрибрюшинного лаважа, и оценивали их способность подавлять MOG-специфичные Пролиферация Т-клеток. CBD-индуцированной CD11b + Gr-1 + были найдены в высшей степени иммуносупрессивной и ингибирует пролиферацию в зависимости от дозы, тем самым подтверждая , что они были MDSCs (рис (Figure3C).3 С). Когда мы перечислены числа жизнеспособных Т — клетки в таких культурах, мы обнаружили , что все Т — клетка была жизнеспособной в то время как общее количество жизнеспособных клеток значительно уменьшилось (рис(Figure3D),3 D), тем самым предполагаячто MDSCs не убивает Тклеткино ингибирования их от пролиферирующих. Чтобы дополнительно определить механизм подавления пролиферации Т-клеток, мы измерили уровни цитокинов в этих культурах и обнаружили, что было снижено продуцирование IFNγ и IL-17, тогда как индукция IL-10 была значительно увеличена, что зависело от количество MDSCs в культуре (рис (Figure4). Поскольку хорошо известно, что MDSC продуцируют IL-10, и наши данные показывают дозозависимый ответ, вместе эти исследования показали, что MDSC, индуцированные CBD, могут снижать MOG-специфическую пролиферацию T-клеток, по меньшей мере частично, продуцируя IL-10 и ингибируя воспалительные цитокины, такие как IFNγ и IL-17.
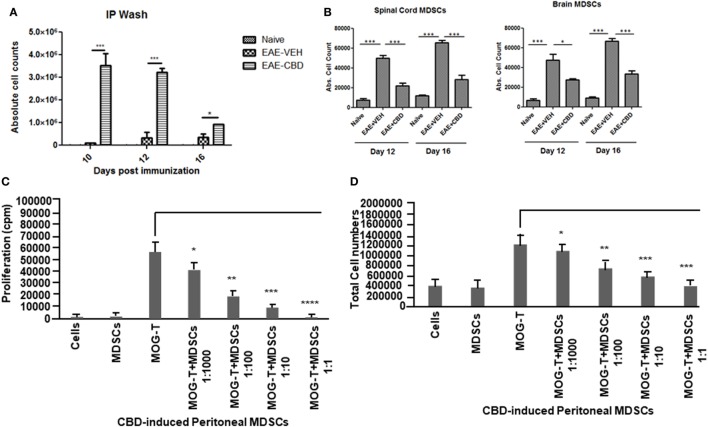
Измененный профиль экспрессии миелоидных клеток-супрессоров (MDSC) после обработки каннабидиолом (CBD).
Абсолютное количество клеток для MDSC: клетки были выделены из внутрибрюшинного лаважа
(A) , спинного мозга и головного мозга
(B) в указанный день.
Клетки окрашивали CD11b и Gr-1 (MDSC), затем подсчитывали, используя общее количество клеток и частоту из проточной цитометрии.
Данные представлены как среднее значение ± стандартная ошибка среднего (
n = 3–5 на образец).
Подавляющую функцию MDSC, индуцированных CBD, тестировали, используя
ex vivo рестимуляцию экспериментальных аутоиммунных энцефаломиелитов (EAE) -VEH спленоцитов в присутствии MOG35–55 (30 мкг / мл) в течение 3 дней.
Клетки были пульсированы тимидином и проанализированы с помощью счетчика BetaScint и были оценены на пролиферацию
(C)и общее количество жизнеспособных клеток
(D) .
Данные представлены как среднее ± SEM.
ANOVA, ***
р <0,0001, **
р <0,001 и *
р <0,05 с помощью
специального теста
Тьюки
.
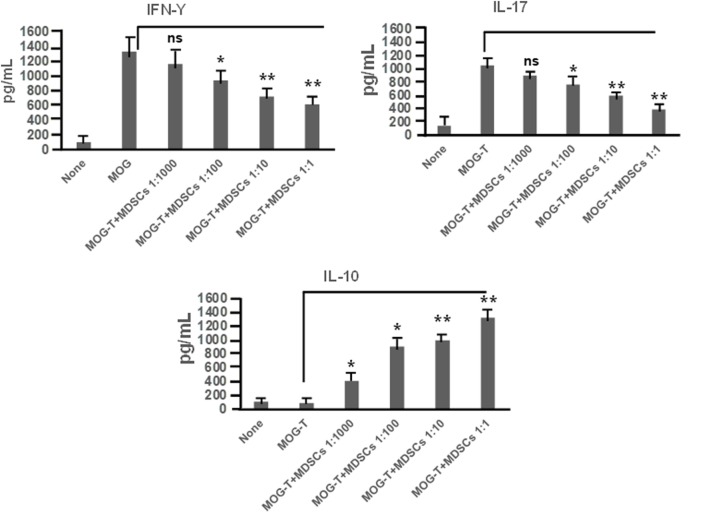
Индуцированные миелоидом супрессорные клетки (MDSC), индуцированные каннабидиолом (CBD), изменяют стимулированную MOG секрецию воспалительных цитокинов Т-клетками.
Регулирующий функция CBD-индуцированной MDSCs был протестирован с
помощью
экс виво рестимуляции экспериментального аутоиммунного энцефаломиелита (ЕАЕ) -VEH спленоциты в присутствии MOG35-55 (30 мкг / мл) в
течение 3 -х
дней, как подробно описано на рисунке
Рисунок 3 легенды.
Культуральные супернатанты собирали и анализировали на IFNγ, IL-17 и IL-10.
Данные представлены как среднее ± SEM.
ANOVA, **
р <0,001 и *
р <0,05 с помощью
специального теста
Тьюки.
Адоптивный перенос CBSC-индуцированных MDSCs ослабляет прогрессирование заболевания EAE
Чтобы подтвердить, что MDSC, индуцированные CBD, действительно ослабляют клиническое заболевание, мы провели эксперименты по адоптивному переносу. С этой целью мы переместили очищенный CBD-индуцированные MDSCs в MOG35-55 иммунизированных мышей на 7 дней и 9. Четыре миллиона клеток вводили внутрибрюшинно в иммунизированных мышей, и аналогичные числа спленоцитов от наивных мышей служили в качестве контрольных (рис (Figure5A) .5 А). Переданные MDSCs были способны ослаблять прогрессирование заболевания, как показано значительным снижением клинических показателей (рис (Figure5B)5 В) и общей клеточной инфильтрацией в ЦНС, в том числе количества CD4 + и CD8 + Т — клеток (рис (Figure5C ).5С). Когда мы оценивали уровни MDSCs в тканях ЦНС, мы обнаружили , что не было никакого существенного увеличения доли и абсолютного числа MDSCs в адоптивно переданных мышей по сравнению с контрольной группой (фиг (Figures5D, Е).5 D, Е). Интересно, однако, селезенка показала значительное увеличение их процента (рис (Figure5F).5 F). Эти данные вместе позволяют предположить, что адоптивно перенесенные MDSC подавляли MOG-специфическую активацию Т-клеток на периферии, а не мигрировали в ЦНС и блокировали там воспаление.
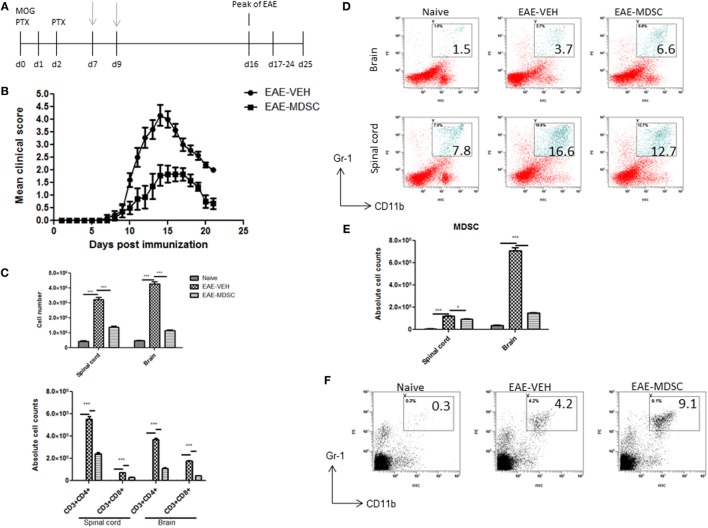
Рисунок 5
Адоптивный перенос индуцированных каннабидиолом (CBD) миелоидных клеток-супрессоров (MDSC) ослабляет экспериментальный аутоиммунный энцефаломиелит (EAE).
(A) Схема временной шкалы исследований.
MDSC, индуцированные CBD, вводили в моменты времени с серыми стрелками (d7 и d9)
посредством внутрибрюшинной инъекции.
Данные были оценены на пике заболевания, если не указано иное.
MDSC, индуцированные CBD, из полости IP собирали, и 4 × 10
6 MDSCs или спленоцитов из исходного C57BL / 6 в качестве контроля переносили адоптивно.
(B) Клинические показатели (
n = 5 мышей на группу);
данные были представлены как среднее ± SEM и проанализированы на значимость с помощью
U- критерия
Манна-Уитни
.
Сравнения считались значимыми при
р ≤ 0,05, обозначается как *.
Данные представляют как минимум два независимых эксперимента;
в каждом эксперименте заболеваемость составляла 100% для каждой группы.
(C) Общее количество мононуклеарных клеток в центральной нервной системе и абсолютное количество клеток для CD3
+ CD4
+ и CD3
+ CD8
+ T-клеток;
мононуклеарные клетки окрашивают соответствующими Abs и затем подсчитывают, используя общее количество клеток и частоту из проточной цитометрии.
(D) Мононуклеарные клетки окрашивают CD11b и Gr1 Abs и затем анализируют проточной цитометрией.
Представлены гистограммы.
(E) Абсолютное количество клеток для MDSC (CD11b
+ Gr1
+) подсчитано с использованием общего количества клеток и частоты из проточной цитометрии.
(F) Спленоциты окрашивали CD11b и Gr1 Ab и затем анализировали проточной цитометрией.
Представлены гистограммы.
Вертикальные столбцы на этом рисунке представляют данные, собранные от трех до пяти мышей на группу, выраженные как среднее ± SEM.
ANOVA, ***
р <0,0001 и *
р <0,05 с помощью
специального теста
Тьюки
.
Ослабление EAE при лечении CBD может быть обращено вспять с истощением MDSC
Чтобы дополнительно подтвердить роль MDSCs в CBD-опосредованном ослаблении EAE, мы выполнили исследования истощения MDSC с использованием RB6-8C5 (анти-Gr-1 Ab), который очень эффективен в истощении таких клеток, как показано ранее нами ( 12 ). Мышам вводили CBD в ЕАЕ мышей , как и раньше, и RB6-8C5 вводили через день, 3 ч после обработки CBD (рис (Figure6A).6 А). В качестве контроля изотипа использовали аналогичные концентрации нормального IgG2b Ab. CBD был в состоянии прогрессирования заболевания значительно затухает , как показано ранее, и истощение MDSC обратного этот эффекта, как указано клинические показатели (рис (Figure6B).6 В). Истощение MDSC было подтверждено с помощьюпромывание брюшной полости через 18 ч после введения КБД на 9-й день (умерщвленный 10-й день). MDSCs были значительно снижен по частоте и числу клеток после лечения с RB6-8C5 по сравнению с мышами , которые были обработаны с контролем Ab (фиги (Figures6C, D).6 С, D). Этот эффект также был замечен на 16 день (данные не показаны). Кроме того, значительное снижение общей клеточной инфильтрации и специфических подмножеств Т — клеток (CD4 + и CD8 + ) , опосредованных КБР значительно отменено после обработки RB6-8C5 (Фигуры (Figures6E, F).6E, F). Вместе исследования истощения MDSC подтвердили эксперименты по адоптивному переносу, предполагая, что CBD-опосредованное ослабление EAE опосредовано, главным образом, посредством индукции MDSC.
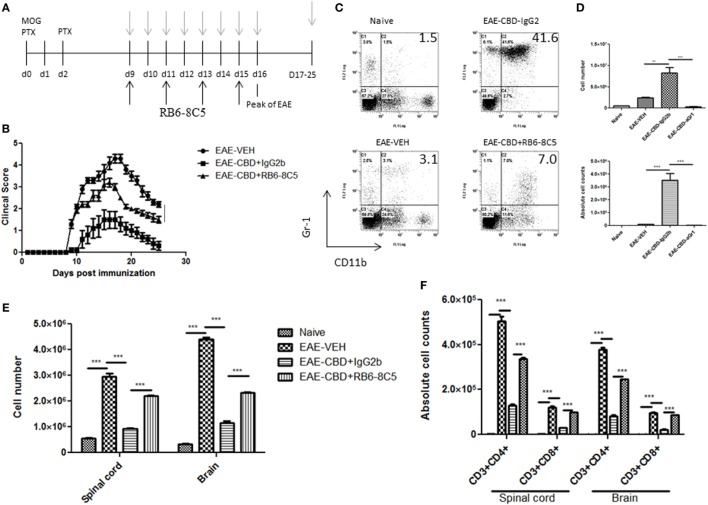
Истощение миелоидных клеток-супрессоров (MDSC) сводит на нет мелиоративное действие каннабидиола (CBD) на экспериментальный аутоиммунный энцефаломиелит (EAE).
(A) Схема временной шкалы исследований.
CBD вводили в моменты времени с серыми стрелками, а антитело RB6-8C5 (анти-Gr-1) вводили через день через 3 часа после CBD
посредством внутрибрюшинной инъекции.
(B) Клинические показатели (
n = 5 мышей на группу);
данные были представлены как среднее ± SEM и проанализированы на значимость с помощью
U- критерия
Манна-Уитни
.
Сравнения считались значимыми при
р ≤ 0,05, обозначается как *.
Данные были оценены на пике заболевания, если не указано иное, и являются репрезентативными по крайней мере для двух независимых экспериментов;
в каждом эксперименте заболеваемость составляла 100% для каждой группы.
(C) На 10-й день эффективность RB6-8C5 тестировали на клетках, извлеченных из брюшной полости.
В качестве контроля использовали изотип Ab IgG2b.
Клетки окрашивали CD11b и Gr1 Abs для выявления MDSC и анализировали проточной цитометрией.
Представлены гистограммы.
(D) Общее количество клеток в IP-лаваже и абсолютное количество клеток для MDSC (CD11b
+ Gr1
+ ), перечисленные в верхней и нижней панелях, соответственно.
(E) Общее количество клеток мононуклеарных инфильтрирующих клеток в центральной нервной системе (ЦНС).
(F)Мононуклеарные клетки из ЦНС окрашивали на CD3
+ CD4
+ и CD3
+ CD8
+ T-клетки для каждой группы и подсчитывали абсолютное количество клеток этих подгрупп T-клеток.
Вертикальные столбцы на этом рисунке представляют данные, собранные от трех до пяти мышей на группу, выраженные как среднее ± SEM.
ANOVA, ***
р <0,0001 и **
р <0,001 с помощью
специального теста
Тьюки
.
обсуждение
Учитывая, что Sativex (комбинация THC и CBD) уже одобрена для клинического применения для лечения РС в Европе и других странах, а также недавней легализации медицинской марихуаны в нескольких штатах США, важно понять основной механизм эта терапия для MS и других связанных воспалительных заболеваний. Известно, что сативекс уменьшает нейропатическую боль у пациентов с РС. Однако такие эффекты могут быть независимыми от противовоспалительных свойств, проявляемых CBD. Противовоспалительные преимущества CBD были недавно изучены на моделях EAE ( 31 , 32 ). В этом исследовании мы дополнительно выясняем эффект CBD на модели аутоиммунного нейровоспаления и впервые демонстрируем, что наблюдаемые CBD-индуцированные эффекты могут быть опосредованы индукцией MDSC.
Мы решили использовать дозу 20 мг / кг массы тела КБД, которая переводится в 1,6 мг / кг при пересчете на эквивалентную дозу для человека. Это составляет ~ 96 мг для взрослого человека (60 кг). Во время клинического испытания пациентам с болезнью Хантингтона давали 700 мг КБД ежедневно в течение 6 недель без токсических эффектов по сравнению с плацебо ( 33 ). Кроме того, в недавнем клиническом исследовании у детей с эпилепсией CBD вводили в суточной дозе до 50 мг / кг / день ( 34 ). Кроме того, основываясь на предыдущих исследованиях, проведенных в нашей лаборатории, 20 мг / кг является оптимальной дозой на мышиной модели для подавления воспаления и считалась подходящей и безопасной ( 10 ).
В соответствии с другими сообщениями ( 32 , 35 ), наши данные показали, что CBD эффективен при ослаблении EAE, о чем свидетельствуют уменьшение клинических признаков, задержка начала заболевания, уменьшение клеточной инфильтрации и повреждение тканей в ЦНС. ЭАЭ, индуцируемая MOG35–55, в первую очередь определяется совместными усилиями клеток Th1 и Th17, которые вырабатывают воспалительные цитокины и эффекторные клетки для косвенного и прямого повреждения миелиновой оболочки ЦНС ( 36 ). В текущем исследовании мы также обнаружили, что системная экспрессия IFNγ и IL-17 значительно возрастает на пике EAE. Кроме того, этот эффект был в значительной степени заблокирован при лечении CBD.
Ранее было показано, что каннабидиол in vitro модулирует ответы Th17, ингибируя секрецию IL-17 и IL-6 и стимулируя IL-10 ( 11 ). Эти данные согласуются с данным исследованием, поскольку лечение CBD in vivo вызывало значительное подавление IL-17 и IFNγ в сыворотке крови. Кроме того, спленоциты от мышей EAE, обработанных CBD, которые были повторно стимулированы in vitro с помощью MOG35–55, секретировали меньше IFNγ и IL-17, в то же время продуцируя более высокие уровни IL-10. В то время как наши исследования показали, что MDSCs играют решающую роль в ингибировании MOG-специфической пролиферации Т-клеток как in vitro, так и in vivo с использованием адоптивного переноса, другие также отмечают, что лечение CBD in vitro, может оказывать прямое влияние путем ингибирования пролиферации Т-клеток или индукции апоптоза ( 32 , 37 — 39 ). Таким образом, CBD может опосредовать свое влияние на воспалительные T-клетки как опосредованно через MDSC, так и напрямую.
Полученные из миелоидов супрессорные клетки коэкспрессируют антигены CD11b и Gr-1 и обладают высокой иммуносупрессивной природой. Хотя было показано, что другие типы клеток также имеют сходные паттерны экспрессии, в частности нейтрофилы, ранее мы показали, что каннабиноиды индуцируют MDSC, а не нейтрофилы ( 10 , 12 , 25 , 30 , 40 , 41 ). Мы обнаружили, что MDSCs, индуцированные каннабиноидом, обладают высокой иммуносупрессивностью, в то время как нейтрофилы от тех же животных не были ( 30 ). MDSC были первоначально обнаружены у больных раком; тем не менее, недавно было показано, что они сильно нарушают врожденный и адаптивный иммунный ответ ( 42). MDSCs используют множество иммуносупрессивных функций, включая; истощение l- аргинина аргиназой, приводящее к остановке цикла Т-клеток и ингибированию пролиферации, экспрессии активных форм кислорода, секреции IL-10 и индукции Tregs ( 43 , 44 ). Роль MDSCs в EAE во все времена было спорным, с некоторыми сообщениями о том , что циркулирующие миелоидных предшественников действуют увековечить болезни ( 45 ) , и в то время как другие продемонстрировали регуляторную роль ( 46 — 48 ). Более того, Ioannou et al. ( 47) продемонстрировали, что у пациентов с активным рассеянным склерозом значительно выше MDSCs в периферической крови по сравнению со здоровым контролем. Кроме того, недавнее исследование выявило терапевтический потенциал MDSCs у пациентов с MS, отметив, что в пределах фенотипов MS экспрессия и функция MDSCs были изменены ( 49 ). Поскольку MDSCs индуцируются в местах воспаления, неудивительно, что их уровни в ЦНС повышаются во время EAE, как видно из текущего исследования.
В текущем исследовании мы обнаружили, что после инъекции CBD мышам EAE в брюшной полости индуцировались высокие уровни MDSC, аналогично нашим предыдущим результатам ( 10 , 25 ). У таких мышей мы также отметили увеличение MDSC в селезенке, но не в ЦНС. Фактически, в ЦНС мы отметили, что мыши EAE-CBD имели более низкие уровни MDSC, чем мыши EAE-VEH. Это может быть объяснено тем фактом, что индуцированные на периферии MDSCs не могут мигрировать в ЦНС. Таким образом, MDSC могут ингибировать индукцию MOG-специфических Т-клеток во вторичных лимфоидных органах, тем самым предотвращая миграцию таких клеток в ЦНС, что вызывает клиническое заболевание. Поэтому мы стремились выяснить эту гипотезу. При этом мы продемонстрировали в пробиркечто CBD-индуцированные MDSCs способны подавлять MOG-специфическую пролиферацию T-клеток. Интересно, что изменение локальной цитокиновой среды может представлять потенциальный механизм для этого уменьшения пролиферации, потому что в таких культурах с CBD-индуцированными MDSCs было увеличено продуцирование IL-10 и уменьшено индуцирование провоспалительных цитокинов (IFNγ и IL-17) это было дозозависимым. IL-10 , также было показано , что снижение уровня B7 со-стимулирующего молекулой , которая экспрессируется на антиген-представляющих клеток , которые могут связываться с CD28 экспрессируется на Т — клетках приводит к активации Т — клеток ( 50 — 52 ). Таким образом, это может быть одним из путей, посредством которых CBD может уменьшить активацию Т-клеток. Во-вторых, было высказано предположение, что усиление воспаления, особенно хронического типа, вызывает MDSCs (43 ). Таким образом, также возможно, что у мышей EAE-VEH из-за сильного нейровоспаления MDSC индуцируются в более высоких количествах, тогда как у мышей EAE-CBD из-за заметно ослабленного нейровоспаления снижается индукция MDSC. Полученные данные свидетельствуют о том, что CBD индуцирует MDSCs на периферии, но не в ЦНС мышей EAE, вместе предположили, что CBD может действовать на периферии, чтобы ослаблять индукцию MOG-специфических Т-клеток, а не воздействовать непосредственно на ЦНС для уменьшения нейровоспаления. Это наблюдение также подтверждается нашими выводами о том, что приемный перенос MDSC не приводил к увеличению количества MDSC в ЦНС.
Текущее исследование убедительно продемонстрировало критическую роль MDSCs в CBD-опосредованном ослаблении EAE с использованием как экспериментов по адоптивному переносу, так и исследований истощения in vivo . Эти исследования согласуются с нашими предыдущими исследованиями, показывающими, что MDSC, индуцированные CBD, могут ослаблять аутоиммунный гепатит ( 10 ). Мы также использовали RB6-8C5, антитело против Gr-1, для истощения MDSC при лечении мышей EAE с CBD. Хотя Gr-1 экспрессируется на других клетках, он широко использовался для изучения эффекта истощения MDSC ( 53 — 55). Наши результаты показали, что лечение RB6-8C5 привело к заметному снижению MDSC и обратило способность CBD ослаблять EAE. Эти исследования в сочетании с экспериментами по адоптивному переносу убедительно продемонстрировали центральную роль, которую играют MDSCs в CBD-опосредованном улучшении EAE.
В заключение, мы продемонстрировали, что смягчение EAE с CBD происходит от его способности нацеливаться на ряд противовоспалительных путей, включая (i) индукцию противовоспалительных MDSCs и (ii) снижение провоспалительных и индукцию анти-воспалительных процессов. воспалительные цитокины. Поскольку КБД не психоактивен, наши исследования показывают, что КБД может стать отличным кандидатом для лечения РС и других аутоиммунных заболеваний. Наши исследования предоставляют дополнительные доказательства важности MDSCs и того, что манипуляции с такими клетками могут представлять собой новый терапевтический метод лечения MS и других аутоиммунных заболеваний.
Заявление об этике
Это исследование было проведено в соответствии с рекомендациями Руководства по уходу и использованию лабораторных животных Национального института здравоохранения. Протокол был одобрен Комитетом по уходу и использованию животных Университета Южной Каролины.
Вклад автора
Участвовал в разработке дизайна, выполнял анализ данных, писал или участвовал в написании рукописи: DE, MN и PN. Проводили эксперименты: DE и NS. Добавлены новые реагенты или аналитические инструменты: MN и PN.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов. Рецензент, MR и редактор отдела обработки заявили о своей общей принадлежности во время обзора.