Исследования с использованием изображений, серологии, патологии и генетики, а также реакции пациента на противовоспалительное лечение показывают, что рассеянный склероз (РС) — это прежде всего воспалительное демиелинизирующее заболевание центральной нервной системы (ЦНС) с различными клиническими проявлениями и гетерогенными гистопатологическими особенностями. Пик заболевания наступает в возрасте от 20 до 40 лет [ 1 ]; однако он также может развиваться у детей и, кроме того, был зарегистрирован у лиц старше 60 лет. РС встречается у женщин примерно в два раза чаще, чем у мужчин [ 2 — 5 ]. РС приводит к множеству неврологических проявлений и является ведущей причиной нетравматической инвалидности среди молодых людей и оказывает большое социально-экономическое воздействие в развитых странах [ 6]. Согласно эпидемиологическим исследованиям, около 400 000 человек в США болеют РС, и каждую неделю добавляется 200 новых случаев. Патогенез рассеянного склероза остается неясным, не было окончательной причины и эффективного лечения. Таким образом, РС можно классифицировать как эпизодическое демиелинизирующее заболевание центральной нервной системы. Патофизиология заболевания сложна и включает в себя генетическую предрасположенность, факторы окружающей среды и развитие патологического иммунно-опосредованного ответа, ведущего к очаговой деструкции миелина, потере аксонов и очаговым воспалительным инфильтратам.
Патофизиология РС также чревата путаницей, поскольку исследователи пытаются классифицировать заболевание как патологическое [ 7 ] или клиническое [ 8].]. Исследователи и клиницисты, изучавшие РС, согласны с тем, что иммунная система играет решающую роль в развитии поражений, особенно на ранних стадиях острого заболевания, характеризующегося рецидивами. Рецидивы в основном являются проявлением воспалительной реакции, возникающей в основном в белом веществе нервной системы, но также и в миелиновых трактах серого вещества. Это приводит к очаговой демиелинизации с относительной сохранностью аксонов. Лучшее доказательство рецидивов, вызванных воспалением, получено из работы в МРТ, которая демонстрирует связь рецидивов с повышением уровня гадолиния, что приводит к нарушению гематоэнцефалического барьера. Основным патологическим признаком РС является демиелинизированная бляшка, которая имеет специфические гистологические и иммуноцитологические характеристики в зависимости от активности заболевания [9 — 12 ]. Гистологически бляшка MS характеризуется выраженным преобладанием CD8 + Т-клеток и относительным отсутствием CD4 + Т-клеток (соотношение от 100: 1 до 50: 1). Кроме того, существует множество макрофагов, которые могут играть главную роль в поглощении обломков миелина. Неизвестно, являются ли они также первичными эффекторами в процессе болезни. Другой важной иммунопатологической особенностью является непрерывный синтез иммуноглобулинов (олигоклональных IgG) в спинномозговой жидкости (CSF). Доказательства связи антител с РС получены в исследованиях, таких как Kabat et al. , который описал повышенный уровень иммуноглобулина (Ig) в спинномозговой жидкости (CSF) [ 13]. CSF IgG и олигоклональные полосы остаются наиболее прогностическим иммунологическим тестом для диагностики РС. Все подтипы иммуноглобулинов вовлечены в РС. Основные иммунологические нарушения приводят к появлению различных аутоиммунных проявлений.
Является ли РС аутоиммунным заболеванием?
Из большинства ссылок, собранных в литературе, РС смело называют аутоиммунным заболеванием. Однако доказательства для такого утверждения слабые и косвенные. Мы обновили и пересмотрели критерии определения того, является ли заболевание аутоиммунным по природе [ 14 ]. Главный критерий данного аутоиммунного заболевания — наличие точного аутоантигена у всех пациентов с этим заболеванием. Несмотря на многочисленные попытки идентифицировать различные белки, липиды и ганглиозиды в миелине как потенциальные антигены РС, ни одна из них не была доказана или подтверждена. Во-вторых, введение аутоантител или Т-клеток вызывает аутоиммунное заболевание у нормальных животных. Эти подходы были предприняты на животных моделях РС с противоположными результатами [ 15 , 16]. Третий критерий — способность вызывать поражения путем иммунизации животных соответствующим аутоантигеном. Это было частично достигнуто, но с проблемами. Тот факт, что несколько различных антигенов могут вызывать заболевание в моделях на животных, при этом один специфический антиген не превосходит другой, делает результаты неоднозначными с точки зрения идентификации соответствующего антигена. Четвертый критерий — это способность изолировать аутоантитела или аутореактивные Т-клетки из очага поражения или из сыворотки. Многие исследователи предположили более высокую частоту предшественников Т-клеток, особенно подгруппы CD4, у пациентов с рассеянным склерозом по сравнению со здоровым контролем, который распознает MBP, протеолипидный белок (PLP), MOG или другие подобные антигены из миелина. К сожалению, поскольку аналогичные положительные результаты получены у нормальных людей, этот критерий не выполняется. Пятый критерий — корреляция между аутоантигеном или аутореактивными Т-клетками с активностью заболевания. Аутореактивные Т-клетки чаще встречаются у пациентов, переживающих обострение, чем у пациентов с прогрессирующим заболеванием, что предполагает возможную корреляцию между аутореактивными Т-клетками и активностью заболевания. Даже несмотря на то, что частота предшественников аутореактивных Т-клеток может быть выше при РС, чем в нормальном контроле, присутствие аутореактивных Т-клеток, продемонстрированное у нормальных контролей, делает окончательный вывод о РС как аутоиммунном более сложном для принятия. Шестой критерий — наличие других аутоиммунных нарушений или аутоантигенов, связанных с заболеванием. Этот вопрос был рассмотрен рядом исследователей,17 ] и сахарный диабет [ 18 ]. Однако популяционные когортные исследования, проведенные в округе Олмстед, штат Миннесота, не показали какой-либо связи между аутоиммунными заболеваниями и РС [ 19 ]. Единственно возможное увеличение отношения шансов было обнаружено при заболевании щитовидной железы, когда сочетались гипертиреоз и гипотиреоз. Кроме того, описаны редкие случаи у пациентов с рассеянным склерозом и воспалительными заболеваниями кишечника [ 17 , 18]. Также было проведено множество исследований, посвященных наличию аутоантител, характерных для пациентов с аутоиммунными заболеваниями, таких как антитела, наблюдаемые при синдроме Шегрена, системной красной волчанке (СКВ) или миастении, но на сегодняшний день нет доказательств того, что наличие этих антител больше у пациентов с РС, чем у здоровых людей. Интересно, что это сильно отличается от оптического нейромиелита (NMO) [ 20 , 21 ], где существует очевидная связь между присутствием аутоантител и NMO (обсуждается далее в этой статье).
Иммунные проявления РС: роль антител.
Есть основания полагать, что часть иммунопатогенеза рассеянного склероза опосредуется антителами. Исследования показали интратекальное производство антител, которое происходит после клональной экспансии, что проявляется в идентификации олигоклональных полос после электрофореза в спинномозговой жидкости [ 22 ]. Исследования, проведенные в клинике Майо, Австрия и Германия, сообщили о гетерогенности поражений РС в ткани ЦНС и их влиянии на патогенез демиелинизации. Подробное иммуногистохимическое исследование было выполнено в активных очагах рассеянного склероза из 83 биопсий и вскрытий пациентов с рассеянным склерозом, после чего были идентифицированы четыре различных патологических подтипа активных очагов рассеянного склероза. Один из подтипов, Образец II, продемонстрировал присутствие макрофагов и Т-клеток, но, кроме того, заметное проявление антител и комплемента [9 ]. Эти данные предоставили доказательства того, что паттерны поражения были неоднородными среди подгрупп пациентов, но однородными у одного и того же пациента. Barnett и Prineas изучали острые очаги рассеянного склероза и обнаружили активацию комплемента, апоптоз олигодендроцитов и ремиелинизацию — результаты, которые частично совпадают с исследованиями Mayo / Germany / Austria [ 23 ]. Недавнее исследование выявило активированный комплемент (C3d и C9neo) при фрагментации миелиновых оболочек во внешних активно демиелинизирующих поражениях у 20 пациентов с рецидивирующим РС (58 из 58 активных очагов) [ 24]. Авторы сообщили о присутствии активированного комплемента на разрушающихся оболочках при различных заболеваниях, поражающих белое вещество, включая вирусный и аутоиммунный энцефалит, NMO и даже ишемические инфаркты, предполагая, что это явление не ограничивается РС. В более позднем исследовании Breij et al. [ 25] исследовали, в какой степени четыре критерия патологической картины транслируются в активные поражения у пациентов с установленным РС. Эти авторы пришли к выводу, что очаги рассеянного склероза имеют однородный профиль. Авторам не удалось подтвердить гетерогенность поражения или межиндивидуальную гетерогенность в отношении иммунной реактивности Ig и комплемента. Однако возможно, что все изученные поражения не были активными. Возможно, что гетерогенные особенности, описанные в активных очагах рассеянного склероза, образцы которых были взяты в различные моменты времени, представляют собой эволюцию одного патофизиологического процесса, а не отдельные иммунопатогенные паттерны. Это может быть так, или большинство активных поражений будут иметь фенотип Pattern II, что подтверждается результатами исследования Barnett and Sutton,26 ]. Система из четырех паттернов до настоящего времени не была полностью проверена независимыми исследователями из-за отсутствия доступного патологического материала с высокой степенью сопоставимости.
Реакция на плазмаферез (PLEX) при остром фульминантном РС является дополнительным доказательством роли иммуноглобулина или компонентов сыворотки в заболевании. Родригес и др. впервые убедительно продемонстрировано пагубное действие компонентов плазмы при воспалительных демиелинизирующих заболеваниях ЦНС; ПЛЕКС в острых эпизодах молниеносной воспалительной демиелинизации ЦНС, которая не реагировала на высокие дозы метилпреднизолона, привел к заметному неврологическому улучшению у 6 пациентов [ 27]. Эти результаты были подтверждены в рандомизированном, фиктивно контролируемом, двойном маскированном исследовании PLEX без сопутствующего иммуносупрессивного лечения у пациентов с недавно приобретенным тяжелым неврологическим дефицитом, возникшим в результате приступов воспалительного демиелинизирующего заболевания, которые не смогли выздороветь после лечения внутривенными кортикостероидами [ 28 ]. Ретроспективное исследование изучило 19 пациентов, получавших PLEX по поводу приступа фульминантного воспалительного демиелинизирующего заболевания ЦНС. Все пациенты с паттерном II , но ни у одного из пациентов с паттерном I или III , достигли функционального неврологического улучшения от умеренного до существенного после PLEX [ 29]. Тот факт, что во всех случаях, которые отреагировали на PLEX, была проведена биопсия, показывающая Ig и комплемент, тогда как ни в одном из пациентов, которые ответили, не была обнаружена эта иммунологическая картина, является самым убедительным доказательством того, что патологические образцы уникальны и имеют терапевтическое значение. Многочисленные публикации за последние несколько десятилетий поддержали идею, что олигоклональные полосы CSF коррелируют с уровнем вовлечения B-клеток в MS [ 30 ]. Кроме того, данные указывают на то, что олигоклональные полосы могут иметь прогностическое значение. Одно проспективное исследование пациентов с острым изолированным демиелинизирующим эпизодом продемонстрировало, что интратекальный синтез иммуноглобулинов является лучшим предиктором прогрессирования РС, чем МРТ [ 31]. Другое проспективное исследование показало, что наличие олигоклональных полос в спинномозговой жидкости при раннем РС обычно коррелирует с худшим исходом [ 32 ]. Недавнее исследование показало сильную корреляцию между уровнями олигоклональных полос (ОКБ) и прогнозом инвалидности при РС [ 33 ].
Антиген: специфичность антител, обнаруженных при РС.
После нескольких лет исследований подтверждение антиген-специфичности антител при РС все еще отсутствует. Благодаря своей широкой реактивности IgG в спинномозговой жидкости пациентов с РС могут представлять собой синтез «бессмысленных» антител, не имеющих отношения к патогенезу [ 34 — 36 ]. Однако другие эксперименты обнаружили молекулярную однородность и временную устойчивость ответа Ig при РС, что противоречит бессмысленному предложению антител [ 37 ]. Возможно, что соответствующие антигены ограничены миелиновой оболочкой. Исследования продемонстрировали серологическое и / или CSF присутствие антител, направленных против MBP и / или миелин / олигодендроцитарного гликопротеина (MOG) у пациентов с MS [ 38]. Однако миелин-специфические антитела не ограничиваются РС. Используя иммуноферментный анализ, Karni et al. сравнили уровни и частоту антител к MOG между пациентами с РС, пациентами с другими неврологическими расстройствами и здоровыми контрольными субъектами [ 39 ] и обнаружили незначительные различия. Параллельно с этим в некоторых отчетах предлагались липиды или углеводы в качестве возможных антигенов-кандидатов на гуморальный иммунный ответ [ 40 , 41 ]. Предполагается, что антитела против гликана IgM на основе альфа-глюкозы могут быть предикторами активности рецидива при РС после первого неврологического события [ 42 ]. Другие предположили, что сывороточные антитела к Glc (альфа1, 4) Glc (альфа) служат биомаркерами ремиттирующего РС [ 43]. Антитела к белкам миелина, липидам и углеводам могут быть извлечены из тканей и сывороток некоторых пациентов с РС.
Иммунные проявления РС: роль Т-клеток
5.1. CD4 + Т-клетки как инициаторы заболевания против эффекторов в разрушении миелина
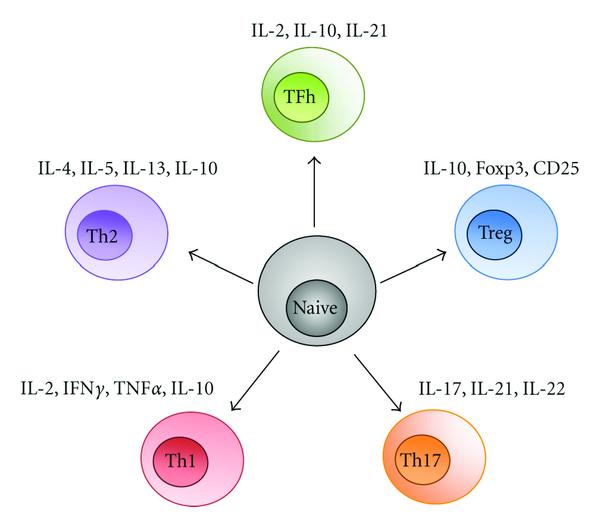
Область наибольшей путаницы в литературе по РС касается роли CD4 + Т-клеток в патогенезе заболевания. Клетки CD4 + преобладают при экспериментальном аутоиммунном / аллергическом энцефаломиелите (EAE) как эффекторы, которые вызывают заболевание и разрушают миелин. Поэтому из-за влияния экспериментальной модели многие исследователи пытались показать, что CD4 + Т-клетки также играют патогенную роль в эволюции РС. К сожалению, многие данные о роли CD4 + Т-клеток не были воспроизведены в других источниках [ 44 ]. Однако существуют убедительные экспериментальные доказательства того, что любой иммунный ответ должен начинаться с задействования антигена, распознаваемого рецепторами на CD4 +.Т-клетки. По идее, дендритные клетки как вне, так и внутри ЦНС захватывают экзогенный или эндогенный антиген и представляют его CD4 + Т-клеткам. В результате эти CD4 + Т-клетки дифференцируются на четыре различных подтипа в зависимости от воспалительной среды (рис. 1 ). Первая — это CD4 + Т-клетки Th1-типа , которые в основном секретируют IFN- γ и TNF- α . Вторая — это CD4 + Т-клетка, часто называемая Th2, которая секретирует в основном TGF- β и IL-10. Третья — это клетка CD4 + TREG, которая выполняет регуляторную функцию [ 45]. Эти Т-клетки экспрессируют ряд факторов транскрипции, включая FoxP3 и другие молекулы [ 46 , 47 ]. Эти клетки играют основную роль в подавлении иммунного ответа [ 48 — 50 ]. Наконец, есть CD4 + Т-клетки, которые в первую очередь секретируют IL17, называемые Th17-клетками. Эти клетки Th17 вызывают большую часть патологии при ЕАЕ. Имеются доказательства их присутствия в бляшках MS, где они могут преимущественно рекрутировать IFN- γ [ 51 ]. Данные свидетельствуют о том, что CD4 + Т-клетки пациентов с РС используют уникальные человеческие бета-рецепторы Т-клеток [ 52]. В этих исследованиях исследователи использовали Т-клеточные линии от пациентов с РС, а также здоровых людей контрольной группы и показали, что эти CD4 + Т-клеточные линии реагируют против определенных основных белков миелина человека, первый из которых представляет собой остатки 84-102, а второй — остатки 143 –168. Они показали, что используемые CD4 + Т-клеточные рецепторы в основном принадлежали к семействам V β 17 и V β 12. Рецепторы V β 12 часто использовались для распознавания с пептидом MBP (84–102), в то время как V β 17 в основном реагировал против MBP (143–168).
CD4
+ Т-клетки дифференцировались на подмножества.
CD4
+ Т-клетки могут дифференцироваться на разные подтипы в зависимости от факторов воспалительной среды, с которыми Т-клетки вступают в контакт.
Клетки
TH1
+ секретируют IFN-
γ и фактор некроза опухоли (TNF) и опосредуют патологию при экспериментальном аутоиммунном энцефаломиелите (EAE).
Многие из результатов, ранее приписываемых клеткам TH1, на самом деле опосредуются клетками Th17
+ .
Клетки Th17
+ секретируют IL17, IL21 и IL22.
Эти клетки были идентифицированы в очагах РС, где они могут служить важными эффекторами.
В результате
стимуляции
TGF-
β CD4
+Т-клетки развиваются в Т-регуляторные клетки.
Эти клетки подавляют иммунный ответ и экспрессируют FOXP3, CD25 и IL10.
Механизм подавления заключается в секреции таких факторов, как IL10.
ТН-хелперные клетки помогают другим Т-клеткам, таким как CD8
+ Т-клетки или В-клетки.
Th-хелперные клетки секретируют IL2, IL10 и IL21.
Клетки
Th2
+ подавляют иммунный ответ и связаны с восстановлением после острых приступов при EAE и, возможно, MS.
Цитокины, которые опосредуют подавление иммунного ответа, представляют собой IL4 и IL10 в дополнение к IL13 и IL5.
Наличие уникального гена V- β рецептора Т-клеток вызвало серию экспериментальных испытаний на животных, а также первых испытаний на людях с целью удаления специфических V- β Т-клеток у пациентов с РС [ 53 ]. Эти эксперименты были относительно успешными в EAE; однако этот подход оказался менее эффективным у людей. Интересно, что исследователи также выделили MBP-реактивные CD4 + Т-клеточные линии из нормальной крови человека [ 54 ]. Тот факт, что эти Т-клеточные линии реагируют на МВР [ 55 ], аналогично тому, что наблюдается у пациентов с РС, поднимает основные вопросы относительно специфичности ответа CD4 + Т-клеточных линий на миелиновый антиген у пациентов с РС [56 ]. Эти CD4 + Т-клеточные линии, полученные от пациентов без РС, секретировали IL2, аналогично тому, что наблюдали у пациентов с РС. Все линии Т-клеток, выделенные из периферической крови, имели фенотип CD4 [ 57 ]. Исследователи изучили лимфоциты периферической крови пациентов с рассеянным склерозом и других неврологических контролей, чтобы изучить конкретные популяции Т-клеток против очищенного человеческого MBP и других антигенов мозга [ 58]. Исследователи показали, что лимфоциты пациентов с РС с большей вероятностью реагируют на МВР. К сожалению, они обнаружили лишь незначительные различия между пациентами с РС и нормальной контрольной группой в отношении специфичности ответа на любые антигены ткани мозга. Большинство ответов было обнаружено у пациентов с хроническим прогрессирующим РС, фазой, когда Т-клетки наименее активны в заболевании. Эти результаты также вызвали опасения по поводу специфичности Т-клеточного иммунного ответа на миелиновые антигены у пациентов с РС, учитывая нелегко различимые различия между пациентами с РС и нормальными людьми. Даже те исследователи, которые утверждают, что демонстрируют положительный, «статистически значимый» ответ, демонстрируют такое совпадение результатов между пациентами и контрольной группой, что эти тесты никогда не разрабатывались в качестве диагностического теста для MS [59 ].
Недавняя работа была сосредоточена на Th17 + клетках при РС [ 60 , 61 ]. Исследователи смотрели на доказательства причастности ИФН & gamma производит гибридные Т — клетки (так называемые клетки Th1, а также IL17 + лимфоциты (Th17 + клетки)) в MS. Они сравнили это с животными с EAE и продемонстрировали увеличение количества лимфоцитов Th17 в крови здоровых контролей, а также пациентов с рецидивирующим РС. В ответ на IL23, который, как известно, расширяет фенотип Th17, они показали одновременную экспрессию IFN- γ и IL17. Они отметили, что у пациентов с ремиттирующим РС наблюдается повышенная выработка IFN- γ.клетками Th17. Те же результаты присутствовали и в экспериментальной модели. Оба этих набора данных подтверждают гипотезу о том, что клетки Th17 играют роль в патологии MS и EAE. Однако присутствие клеток Th17 не доказывает автоматически, что они играют роль в патогенезе [ 62 ]. Нет данных о том, что удаление клеток Th17 улучшает рассеянный склероз или что повышение уровня клеток Th17 в очагах поражения коррелирует с инвалидностью. Это контрастирует с работой, проделанной на CD8 + Т-клетках (обсуждаемой ниже), которая выявляет сильную корреляцию между CD8 + Т-клетками, перфорином и другими молекулами, секретируемыми CD8 + Т-клетками, с заболеванием.
5.2. CD8 + Т-клетки: первичный медиатор эффекторной функции в бляшках РС
Патологические исследования демонстрируют, что CD8 + Т-лимфоциты являются наиболее распространенными Т-клетками, наблюдаемыми в бляшках РС. Принято считать, что CD8 + Т-клетки выполняют две основные функции: цитотоксичность и подавление. При рассеянном склерозе из-за сильной предвзятости экспериментальных моделей аутоиммунного энцефаломиелита (EAE) считалось , что CD8 + T-клетки играют подавляющую роль. При EAE CD4 + T-клетка посредством своей функции Th1 и Th17 опосредует заболевание и вызывает воспалительную реакцию, неврологический дефицит, паралич и гистологические данные. В EAE CD8 +Т-клетки связаны с восстановлением неврологической функции и обладают подавляющими свойствами. Напротив, в бляшках РС CD8 + Т-клетки, по-видимому, играют гораздо более агрессивную роль, а не просто подавляют воспалительную реакцию. CD8 + Т-клетки взаимодействуют с антигенами класса I главной гистосовместимости (MHC), чтобы вызвать их ответ. В нормальной ЦНС класс I MHC наблюдается только в сосудистых клетках и в редких менингеальных клетках. Однако в разгар воспалительного процесса, такого как РС, MHC класса I наблюдается в астроцитах, олигодендроцитах и нейронах и даже редко на аксонах [ 63 ]. Кроме того, CD8 + Т-клетки коррелируют с повреждением аксонов, и in vitro имеются убедительные доказательства того, что CD8+ Т-клетки играют основную роль в рассечении аксонов [ 64 , 65 ]. Рецидивы РС связаны с повышенной цитотоксичностью CD8 + Т-клеток в спинномозговой жидкости [ 66 ]. Ряд клинических испытаний с моноклональными антителами, в частности против CD4 + Т-клеток [ 67 ], не продемонстрировали какой-либо терапевтической пользы при РС в отличие от антител более широкого спектра (алемтузумаб CD52), которые способны истощать все Т-клетки [ 68 ], включая CD8 + Т-клетки. Также важно подчеркнуть, что CD8 +Т-клетки могут играть важную роль в ряде доказанных аутоиммунных заболеваний, включая СКВ, сахарный диабет, болезнь Крона, болезнь Грейвса и аутоиммунную болезнь Аддисона [ 63 ].
Наконец, CD8 + Т-клетки демонстрируют олигоклональную экспансию в головном мозге, крови и спинномозговой жидкости, о которой не сообщалось с CD4 + Т-клетками [ 69 — 71 ]. Некоторые цитотоксические Т-клетки реагируют против аутоантигенов, таких как основной миелиновый белок [ 72 ]. Если бы эти клетки беспорядочно перемещались по ЦНС, то предположительно длина их области соединения CD3 показала бы нормальное гауссово распределение. Напротив, при РС наблюдается перекос участков соединения CDR3, что указывает на избирательную инфильтрацию или экспансию клонов CD8 + Т-клеток в ЦНС [ 71 ]. Более того, Т-клеточные рецепторы CD8 + Т-клеток демонстрируют различные CD8 +Клоны Т-клеток с консервативной специфичностью, предполагающие распознавание аналогичного антигена, что приводит к их пролиферации в ЦНС. Много усилий было сосредоточено на потенциальной роли IL17 в бляшках MS, и из-за систематической ошибки экспериментов по EAE было высказано предположение, что это происходит от CD4 + T-клеток. Однако есть свидетельства того, что IL17 также производится CD8 + Т-клетками [ 73 ]. Определение IL17 + CD8 + Т-клеток открывает новые возможности для будущих исследований и новые цели с точки зрения иммунотерапии. CD8 + Т-клетки секретируют ряд молекул, включая гранзимы и перфорин. Сильные данные свидетельствуют о том, что перфорин способствует аксонов травмы в бляшки MS (рис 2). Наличие перфорина коррелирует с неврологической инвалидностью и наличием «черных дыр» на МРТ. Следовательно, CD8 + Т-клетки играют решающую роль во время острой воспалительной фазы заболевания, а также во время нейродегенеративной фазы. CD8 + Т-клетки вызывают повреждение аксонов при РС, а также долгосрочные неврологические нарушения. Имеются данные о том, что CD8 + Т-клетки играют главную роль во вторичной прогрессирующей фазе заболевания за счет секреции лимфотоксина [ 74 ]. В исследованиях секреции цитокинов у пациентов с вторичным прогрессирующим РС и нормальной контрольной группы исследователи обнаружили явные доказательства наличия CD8 +, стимулированного анти-CD3.Т-клетки у пациентов со вторично-прогрессирующим РС. Эти клетки секретируют лимфотоксин и другие цитокины, которые играют решающую роль в развитии прогрессирующей фазы болезни. Это является убедительным доказательством того, что CD8 + Т-клетки играют роль в нейродегенеративном аспекте прогрессирующей фазы заболевания, а также в ранней острой фазе.
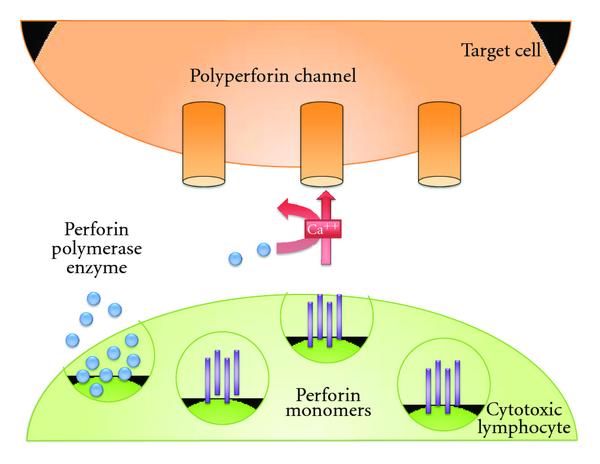
Перфорин является первичным медиатором повреждения CD8
+ Т-клетками.
Перфорин — это первичная молекула, которая, как известно, опосредует повреждение CD8
+ Т-клетками.
Перфорин опосредует пересечение аксонов при рассеянном склерозе (РС) и коррелирует с неврологической инвалидностью.
Цитотоксические Т-клетки секретируют перфорин в форме гранул вместе с гранзимами.
Это высвобождение активирует кальций, что приводит к образованию «полиперфориновых» каналов на клетках-мишенях.
Это приводит к образованию отверстий в мембране клеток-мишеней, вызывая утечку внутриклеточного материала, что приводит к гибели клеток.
Также важно подчеркнуть возможную регуляторную роль CD8 + Т-клеток при РС. Исследователи идентифицировали CD8 + / CD25 + Foxp3 + как регуляторные Т-клетки у пациентов с РС [ 75 ]. В этих исследованиях они исследовали клоны периферической крови, спинномозговой жидкости и CD8 + Т-клеток пациентов с обострениями рассеянного склероза, пациентов с ремиссиями, здоровых людей и пациентов с другими воспалительными неврологическими заболеваниями. Ингибирование CD4 + -реактивной пролиферации Т-клеток регулирующими клетками CD8 + опосредовано IL10 и трансформирующим фактором роста бета (TGF- β ). Любая попытка удалить CD8 +Т-клетки из очага рассеянного склероза потенциально могут усугубить болезнь за счет устранения регуляторных клеток. Следовательно, необходимо проявлять осторожность при любых попытках манипулировать популяцией CD8 +.
Доказательства патогенеза NMO на основе аутоиммунитета.
Доказательства патогенеза NMO на основе аутоиммунитета
Hinson et al. [ 76 — 78 ] обнаружили появление IgG к AQP4 у пациентов с NMO. Далее было продемонстрировано, что антитела, реагирующие с AQP4, появляются в патологических очагах [ 79 ] и что уровни антител AQP4 и активность заболевания коррелированы [ 80 ]. NMO связан с другими аутоиммунными заболеваниями [ 20 ]. Кроме того, аутоантитела против других распространенных аутоиммунных заболеваний, таких как синдром Шегрена и системная красная волчанка, появляются в сыворотке пациентов с NMO [ 21 ], но не в сыворотке крови пациентов с рассеянным склерозом [ 19]. Учитывая аутоиммунную гипотезу, связанную с NMO, мы предположили, что PLEX, традиционный метод удаления циркулирующих аутоантител у пациентов, будет полезным. Интересно, что PLEX оказался весьма успешным средством лечения NMO, аргументируя это в пользу иммуно-опосредованного патогенеза этого заболевания [ 81 ]. В соответствии с аутоиммунно-опосредованной гипотезой, гуморальные препараты, подавляющие иммунитет, такие как гидрохлорид митоксантрона [ 82 ] (синтетический антрацендион, одобренный для лечения обострения ремиттирующего и вторично прогрессирующего РС), мофетил микофенолата. терапии) и ритуксимаб [ 84] (терапия, истощающая B-клетки), была продемонстрирована полезная для лечения NMO. De Parratt и Prineas недавно описали резкое разрушение периваскулярных астроцитов у пациентов с NMO, которое предшествовало апоптозу олигодендроцитов в ранних поражениях. Их результаты дополняют экспериментальные доказательства того, что сывороточные антитела, направленные против астроцитов, присутствующие у значительной части пациентов с NMO, являются патогенными. Кроме того, их данные подтверждают новое определение заболевания, основанное на патологии: NMO — это демиелинизирующее заболевание, патологически характеризующееся мультифокальными поражениями, распространенными во времени и пространстве, и при котором демиелинизация является вторичной по отношению к острому разрушению периваскулярных астроцитов [ 85]. Однако Takano et al. сообщили, что повреждение астроцитов у NMO гораздо серьезнее, чем демиелинизация [ 86 ]. В настоящее время считается, что NMO является воспалительным аутоиммунным заболеванием ЦНС.
Альтернативная гипотеза патогенеза рассеянного склероза.
Привлекательная гипотеза для объяснения иммуноопосредованного патогенеза рассеянного склероза заключается в том, что он вызывается инфекционным агентом. Несмотря на то, что ни один инфекционный агент при РС не был убедительно продемонстрирован, существуют экспериментальные данные, подтверждающие эту гипотезу.
Экспериментальные данные о вызванной вирусами демиелинизации.
Экспериментальное заражение лабораторных животных различными вирусами вызывает демиелинизацию ЦНС. Наиболее изученной вирусной моделью рассеянного склероза на животных является заболевание, вызванное вирусом мышиного энцефаломиелита Тейлера (TMEV), кишечным патогеном мышей, который принадлежит к одноцепочечным РНК-пикорнавирусам [ 87 ]. Модель заболевания является хронически прогрессирующей у восприимчивых мышей, что резко контрастирует с широко используемой моделью аутоиммунного EAE. Две характерные особенности делают эту модель наиболее подходящей для изучения рассеянного склероза. Имеются данные об иммунном ответе на инфицированные вирусом клетки [ 88 , 89 ], а также об аутоиммунном ответе, вызванном вирусной инфекцией в ЦНС [ 90], оба из которых потенциально похожи на MS. Miller et al. сообщили, что инфекция TMEV приводит к аутоиммунитету ЦНС через распространение эпитопа [ 91 ]. Инфекция олигодендроцитов TMEV приводит к лизису клеток и высвобождению большего количества вирионов [ 92]. Напротив, инфицирование TMEV в макрофагах ограничено и приводит к их апоптозу. Вирус распространяется от макрофагов к другим макрофагам и олигодендроцитам, усиливая иммунопатологическое разрушение миелина. Демиелинизация частично является результатом прямого вирусного разрушения олигодендроцитов, но также является следствием иммунных и воспалительных реакций. Другие вирусные модели демиелинизации включают мышей с инфекцией вируса JHM и MHV-4 (корановирусы), собак с вирусом чумы собак, а также овец и коз с вирусом Visna и вирусом артрита-энцефалита коз. Животная модель индуцированной вирусом демиелинизации без рецидивов представляет собой инфицирование мышей вирусом леса Семлики (SFV) [ 93]. Все вирусы способны вызывать стойкую вирусную инфекцию в течение длительного периода, не вызывая гибели хозяина. Все эти примеры подтверждают вирусную гипотезу демиелинизации ЦНС.
Доказательства вирус-индуцированной этиологии рассеянного склероза.
Вирус Эпштейна-Барра (EBV), вирус герпеса человека 6 (HHV-6), вирус ветряной оспы (VZV) и Chlamydia pneumonia являются одними из предполагаемых инфекционных агентов у людей, вовлеченных в MS. Многие исследования продемонстрировали титры антител к широкому спектру патогенов у пациентов с рассеянным склерозом; однако многие из этих выводов остаются единичными и неподтвержденными. EBV — это B-лимфотропный ДНК-вирус герпеса человека, который бессимптомно инфицирует большинство людей, но у некоторых вызывает инфекционный мононуклеоз (IM) [ 95 , 96 ]. Cepok et al. идентифицировали белки EBV как предполагаемые мишени иммунного ответа при РС [ 97 ]. Другое исследование продемонстрировало повышенный риск рассеянного склероза у лиц с клиническим анамнезом IM [ 98 , 99]. Недавно исследователи из Соединенного Королевства изучили распространенность РС и инфекционного мононуклеоза (IM) и их связь с воздействием ультрафиолета B (UVB) [ 100 ]. Как ранее было показано в других исследованиях, МС сильно коррелировал с ИМ [ 101 , 102 ]. В качестве контроля авторы также исследовали корреляцию РС с распространенностью цитомегаловируса и распространенностью ветряной оспы, соответственно, оба из которых не коррелировали с РС. Следует отметить, что авторы обнаружили, что UVB в любое время года тесно коррелирует с инфекцией MS и EBV. Эти результаты хорошо согласуются с гипотезой ВЭБ, поскольку может существовать механизм, посредством которого УФ-В излучение опосредует риск РС.
Было высказано предположение, что низкий уровень витамина D приводит к иммуносупрессии, что приводит к увеличению инфицирования EBV. Также известно, что небольшое количество УФ-В снижает уровень витамина D. Географическая изменчивость в распространенности MS, с более высокой распространенностью заболевания в северных широтах и низкая распространенность на экваторе, хорошо установлены [ 103 — 105 ]. Это изменение в распространенности МС положительно коррелирует с изменением концентрации в сыворотке 25-гидроксивитамина D [ 106 — 108 ]. Некоторые, но не все, исследования показывают обратную корреляцию между концентрацией 25-гидроксивитамина D в сыворотке крови и частотой рассеянного склероза, тяжестью и прогрессированием заболевания [ 109 — 120]. Витамин D и его биологически активный метаболит 1,25-дигидроксивитамин D 3 (1,25 (OH) 2 D 3 ) не только играет важную роль в регуляции гомеостаза кальция и фосфора, но также является важным модулятором иммунной функции. . 1,25 (OH) 2 D 3 функционирует, связываясь с рецептором витамина D, который широко распространен в ряде тканей, транспортирующих кальций, нервных тканях и иммунных клетках (дендритных клетках, Т-лимфоцитах, В-лимфоцитах и макрофагах) [ 121 — 128 ]. 1,25 (ОН) 2 D 3увеличивает активность макрофагов, подавляет созревание дендритных клеток, подавляет функции В-клеток и способствует выработке Т-хелперных клеток 2, тем самым сдвигая соотношение Th1 / Th2-клеток в пользу Th2-хелперных клеток (рис. 3 ) [ 94 , 129 — 134 ]. Поляризация активированных CD4 + Т-клеток к фенотипу Th-1 ( секреция IL-2, IFN γ , TNF α ) или к фенотипу Th-2 (секреция IL-4, 5, 13, 10) представляет собой главную детерминанту характер последующих клеточных и гуморальных иммунных ответов. Это самовоспроизводящийся процесс, поскольку один подтип подавляет порождение другого [ 131 , 132]. Первичная генерация Т-клеточных ответов Th-1-типа сильно ингибируется 1,25 (OH) 2 D 3 как in vitro, так и in vivo . 1,25 (OH) 2 D 3 также индуцирует выработку человеческого кателицидина LL-37, который особенно эффективен против респираторных вирусов, таких как грипп [ 135 ]. Недостаток витамина D может привести к хронической инфекции, например, к EBV-инфекции, вызывающей IM, что приводит к более высокому риску MS [ 136 ].
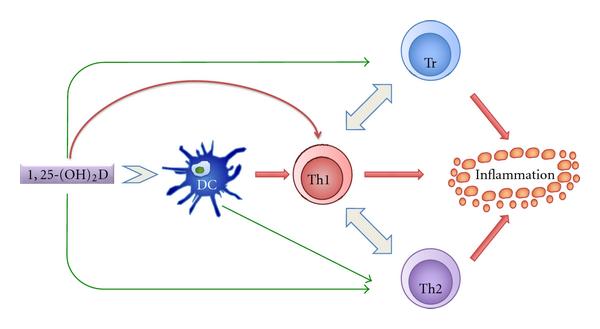
В
в пробирке эффекты 1,25 (OH)
2 D на иммунную систему.
Воздействие 1,25 (OH)
2 D прямо или косвенно показано стрелками.
Зеленая стрелка указывает на положительное влияние, а красная стрелка — на отрицательное.
Отрицательное влияние на воспаление указывает на ослабление воспалительной реакции.
DC: дендритная клетка;
Th1: Т-хелперный лимфоцит 1 типа;
Th2: Т-хелперный лимфоцит 2 типа;
Tr: регуляторный Т-лимфоцит
Выводы
При РС, чтобы олигодендроцит был поврежден воспалительными клетками, он должен экспрессировать гены MHC класса I или класса II. CD8 + Т-клетки затем могут взаимодействовать с новым белком, который экспрессируется в контексте MHC класса I. CD8 +Затем Т-клетки будут секретировать перфорин, гранзим или другие факторы, которые могут напрямую повредить или убить олигодендроцит, что приведет к демиелинизации. Антитела посредством молекулярной мимикрии могут распознавать аутоантигены ЦНС, а также могут повреждать олигодендроциты, связываясь с поверхностью клетки, и, в сочетании с комплементом, могут вызывать прямое повреждение миелина или олигодендроцитов. Это частично приводит нас к аутоиммунной гипотезе. Кроме того, В-клетки могут также представлять вирусные антигены в контексте молекул MHC класса II. Сам олигодендроцит или микроглия также может экспрессировать MHC класса II. Это представление вирусного антигена должно быть обработано, что позволяет CD4 +Т-клетки должны взаимодействовать с MHC класса II, чтобы вызвать повреждение — общий механизм повреждения, который предположительно присутствует при экспериментальном аутоиммунном энцефаломиелите. Олигодендроцит может погибнуть в результате прямой и стойкой вирусной инфекции. Эти механизмы повреждения могут быть независимыми или возникать одновременно в каждом мозге. Все эти механизмы приводят к демиелинизации, которую хозяин может исправить с помощью временной ремиелинизации. В конечном итоге процесс демиелинизации обгоняет ремиелинизацию, приводя к повреждению аксонов, что приводит к постоянному неврологическому дефициту. В настоящее время нет четких доказательств того, что эти паттерны травм относятся к различным стадиям течения заболевания и не коррелируют с клиническими подтипами ремиттирующего рассеянного склероза, вторичного прогрессирующего рассеянного склероза,
Многие из наблюдаемых результатов впоследствии привели исследователей к ложным выводам относительно патогенеза рассеянного склероза. Иммунные клетки присутствуют в бляшке при РС, и иммунная система играет важную роль в патогенезе заболевания, поскольку ряд иммуномодулирующих и иммуносупрессивных методов лечения действительно снижает рецидивы и количество поражений, повышающих уровень гадолиния, в головном мозге с РС. Однако долгосрочные последствия иммуносупрессии для течения болезни неизвестны, потому что большинство опубликованных клинических испытаний заканчиваются после двух лет наблюдения, что является недостаточным периодом времени для устранения долгосрочных последствий этих методов лечения. Становится все более очевидным, что CD8 + Т-клетки и их эффекторные молекулы могут напрямую влиять на процесс заболевания. К сожалению, несмотря на годы документирования участия CD8+ Т-клетки в очагах рассеянного склероза, скудные эксперименты проводились по этому аспекту иммунного ответа. Вероятно, это связано с предвзятостью экспериментальной модели EAE, в которой CD8 + Т-клетки играют только регуляторную роль, тогда как CD4 + Т-клетки играют основную эффекторную роль в патогенезе заболевания. Когда мы отходим от экспериментальной модели и начинаем исследовать РС у людей, становится очевидным, что Т-клеточный иммунный ответ MHC класса II CD4 + дает менее важные критические данные о CD8 + класса I MHC.Т-клеточный иммунный ответ. Самым важным диагностическим тестом на РС по-прежнему является присутствие повышенного уровня IgG в спинномозговой жидкости и наличие специфических олигоклональных полос в спинномозговой жидкости, но не в сыворотке. Следовательно, очень важно определить специфичность этих полос. В конечном итоге может быть доказано, что полосы олигоклональных IgG в спинномозговой жидкости играют скорее нейропротекторную, чем патологическую роль.
Перевод источник