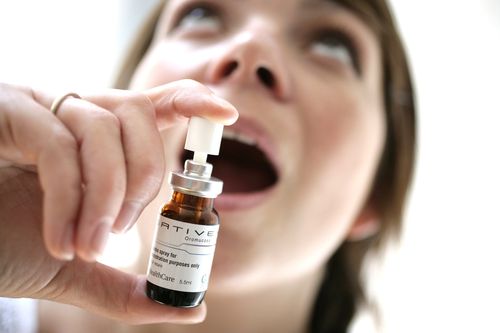
Фаза 3 проба проходит в США с целью оценки безопасности и эффективности Sativex (набиксимолс) , устный спрей, содержащий экстракты конопли, в лечении спастичности — жесткость мышцы или судороги — связанные с рассеянным склерозом (MS).
Sativex от GW Pharmaceuticals доступен в 25 странах, включая большую часть Европы и Канаду, в качестве дополнительной терапии для пациентов с рассеянным склерозом со спастичностью от умеренной до тяжелой, которые не реагируют на другие спастические препараты. Он содержит каннабидиол (CBD) и тетрагидроканнабинол (THC), два самых распространенных каннабиноида, обнаруженных в растении каннабис.
«Мы очень рады , что программа клинической фазы США 3 оценки набиксимолс в склерозом спастичности теперь набор пациентов, после задержки из — за COVID-19 , » сказал Джастин Говер, генеральный директор GW, в пресс — релизе.
«Учитывая тщательные исследования этого лекарства за пределами США и положительные обсуждения с FDA [Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов], мы считаем, что у нас есть четкий путь … [к подаче на утверждение], возможно, уже в ближайшее время год », — добавил Говер.
Ожидается, что в плацебо-контролируемое исследование ( NCT04203498 ) примут участие около 446 взрослых с рассеянным склерозом и спастичностью. Они будут случайным образом назначены либо на лечение Сативексом, либо на плацебо, оба вводятся самостоятельно в виде спрея для полости рта утром и вечером, до 12 раз в день в течение 12 недель.
Зарегистрированные пациенты войдут в 28-дневный «базовый» период, записывая количество своих ежедневных мышечных спазмов с помощью электронного дневника, одновременно принимая свои обычные лекарства от спастичности. Этот период устанавливает точку отсчета.
Затем они переходят к 12-недельному ежедневному лечению или плацебо с последующими двумя неделями последующих оценок, в общей сложности 18 недель (около 4,5 месяцев).
Основная цель исследования — оценить, превосходит ли Сативекс плацебо в снижении частоты мышечных спазмов у пациентов с РС.
По данным GW и ее американской дочерней компании Greenwich Biosciences, первый зарегистрированный пациент уже прошел скрининг и вошел в 28-дневный базовый период исследования. Сайты с пробными версиями в США еще не объявлены, и контактная информация, как ожидается, будет доступна здесь.
Это ключевое испытание фазы 3 — одно из пяти, которые GW планирует запустить для оценки безопасности и эффективности Sativex при спастичности РС. Ожидается, что четыре других исследования — три, посвященных влиянию лечения на мышечный тонус, и одно — по частоте мышечных спазмов, начнутся в период с конца этого года до середины 2021 года.
«Сейчас идеальное время для разработки набиксимолов в США, поскольку исследования показывают, что значительный процент пациентов со спастичностью сегодня занимается самолечением, используя неутвержденные продукты каннабиса для уменьшения спастичности», — сказал Говер.
Одобрение терапии в Европе было подтверждено данными трех исследований фазы 3, которые продемонстрировали, что Сативекс хорошо переносился и эффективно уменьшал спастичность РС. Лекарство в настоящее время не одобрено для каких-либо показаний в США.
«Существует значительная потребность в новых методах лечения спастичности у пациентов с рассеянным склерозом — сложном состоянии, в котором за последние десятилетия в Соединенных Штатах Америки практически не было терапевтических инноваций», — сказал Стивен Кригер, доктор медицины, доцент неврологии в больнице Mount Sinai в Нью-Йорке. .
«Набиксимол может стать тщательно протестированным и регулируемым FDA лекарством на основе каннабиса для людей, живущих с РС. Я с нетерпением жду участия в качестве исследователя в этом исследовании, которое оценит влияние набиксимолов на частоту мышечных спазмов », — добавил Кригер.