Рассеянный склероз (MS) является гетерогенным заболеванием, которое развивается как взаимодействие между иммунной системой и стимулами окружающей среды у генетически восприимчивых людей. Появляется все больше доказательств того, что вирусы могут играть роль в патогенезе рассеянного склероза, выступая в качестве этих триггеров окружающей среды. Однако неизвестно, является ли какой-либо один вирус причинным, или, скорее, несколько вирусов могут действовать как триггеры в развитии заболевания. Здесь мы рассмотрим связь различных вирусов с MS с акцентом на два вируса герпеса, вирус Эпштейна-Барра (EBV) и вирус герпеса человека 6 (HHV-6). Эти два агента оказали наибольшее влияние в последние годы как возможные сопутствующие факторы в развитии заболевания MS. Самый сильный аргумент в пользу связи ВЭБ с MS связан с наличием связи между симптоматическим инфекционным мононуклеозом и MS и с помощью сероэпидемиологических исследований. В отличие от EBV, HHV-6 был обнаружен значительно чаще в бляшках MS, чем в MS нормального белого вещества или мозга без MS, и во время клинических рецидивов MS сообщалось о повторной активации HHV-6. В этом обзоре мы также предлагаем новые стратегии, в том числе разработку новых инфекционных животных моделей MS и клинических испытаний противовирусных MS, чтобы выяснить роль различных вирусов в патогенезе этого заболевания. Кроме того, мы представляем идею использования методик обнаружения непредвзятых, независимых от последовательности, патогенов, таких как секвенирование следующего поколения, для изучения ткани мозга или жидкостей организма с целью выявления известных вирусных последовательностей или потенциальных новых вирусных агентов. HHV-6 был обнаружен значительно чаще в бляшках MS, чем в MS нормальное появление белого вещества или мозга без MS, и во время клинических рецидивов MS сообщалось о повторной активации HHV-6. В этом обзоре мы также предлагаем новые стратегии, в том числе разработку новых инфекционных животных моделей MS и клинических испытаний противовирусных MS, чтобы выяснить роль различных вирусов в патогенезе этого заболевания. Кроме того, мы представляем идею использования методик обнаружения непредвзятых, независимых от последовательности, патогенов, таких как секвенирование следующего поколения, для изучения ткани мозга или жидкостей организма с целью выявления известных вирусных последовательностей или потенциальных новых вирусных агентов. HHV-6 был обнаружен значительно чаще в бляшках MS, чем в MS нормальное появление белого вещества или мозга без MS, и во время клинических рецидивов MS сообщалось о повторной активации HHV-6. В этом обзоре мы также предлагаем новые стратегии, в том числе разработку новых инфекционных животных моделей MS и клинических испытаний противовирусных МS, чтобы выяснить роль различных вирусов в патогенезе этого заболевания. Кроме того, мы представляем идею использования методик обнаружения непредвзятых, независимых от последовательности, патогенов, таких как секвенирование следующего поколения, для изучения ткани мозга или жидкостей организма с целью выявления известных вирусных последовательностей или потенциальных новых вирусных агентов. выяснить роль различных вирусов в патогенезе этого заболевания. Кроме того, мы представляем идею использования методик обнаружения непредвзятых, независимых от последовательности патогенов, таких как секвенирование следующего поколения, для изучения ткани мозга или жидкостей организма для обнаружения известных вирусных последовательностей или потенциальных новых вирусных агентов. выяснить роль различных вирусов в патогенезе этого заболевания. Кроме того, мы представляем идею использования методик обнаружения непредвзятых, независимых от последовательности патогенов, таких как секвенирование следующего поколения, для изучения ткани мозга или жидкостей организма для обнаружения известных вирусных последовательностей или потенциальных новых вирусных агентов.
Инфекционная этиология рассеянного склероза (MS) подозревается в течение более ста лет, и большое количество вирусов, а также других инфекционных агентов были связаны с заболеванием в течение этого времени. Ассоциация заболевания с вирусом, безусловно, не подразумевает причинно-следственной связи, и, действительно, большинство ассоциированных агентов не выдержали испытания временем. Например, вирус кори в прошлом был тесно связан с РС, но введение вакцинации против кори не оказало заметного влияния на распространенность MS [ 1].]. Тем не менее, накапливающиеся данные все еще указывают на роль факторов окружающей среды, таких как вирусы, в патогенезе РС. В последние годы возрождается инфекционная теория при MS- не как единственный фактор, а как часть более сложной этиологии, в которой играют роль как гены, так и среда. Полученные данные о том, что генетические или эпигенетические факторы не могут полностью объяснить диссонанс при заболевании МS у монозиготных близнецов [ 2], еще раз указал на важность факторов окружающей среды в патогенезе РС. Наибольшее количество доказательств за последние несколько лет накоплено вокруг вируса Эпштейна-Барра (EBV) и герпесвируса человека 6 (HHV-6). Другие ассоциированные агенты включают вирус ветряной оспы (VZV) и эндогенные ретровирусы человека (HERV). До сих пор ни один из ассоциированных агентов не оказался причинным.
Чем больше мы понимаем механизмы патогенеза заболевания MS, тем яснее становится, что MS действительно является сложным заболеванием с генетическими, экологическими и иммунологическими компонентами. Степень взаимодействия между этими различными факторами находится под строгим исследованием. Неоднородность заболевания может также свидетельствовать о том, что MS не вызывается и не запускается только одним вирусом, а скорее более сложный набор вирусных инфекций может действовать как триггеры у генетически восприимчивых людей [ 3]. Некоторые из вопросов, которые необходимо изучить, включают степень взаимодействия между генами риска рассеянного склероза, уровнями витамина D, воздействием ультрафиолетового излучения, курением табака и вирусами. Существуют ли факторы риска, которые при наличии могут усиливать риск рассеянного склероза или все эти факторы риска независимы? Ответ на эти вопросы может привести к большему пониманию возможных механизмов, которые вирусы могут вызывать при MS. Кроме того, популяционные исследования распространенности различных ассоциированных с MS вирусов во всем мире могут выявить сходство с распространенностью самого заболевания в определенных регионах, усиливая связь между подозреваемыми вирусами и MS.
Целью данного отчета является обзор последних исследований инфекционных агентов при MS, основное внимание уделяется EBV и HHV-6. Самым важным выводом, связывающим EBV с MS, является более высокая серопревалентность и более высокие титры антител к EBV у пациентов с MS по сравнению с контрольной группой того же возраста. Полученные данные в поддержку EBV довольно единообразны в литературе, в то время как для исследований HHV-6 наблюдалась большая вариабельность в исследованиях, демонстрирующих более высокие титры или распространенность антител против HHV-6 у пациентов с MS, чем в контрольной группе. Это, вероятно, отражает отсутствие надежных, проверенных и коммерчески доступных серологических тестов HHV-6. Действительно, большинство серологических данных, предполагающих связь между HHV-6 и MS, было получено с использованием «домашних» методов, которые труднее воспроизвести и которые требуют знаний при разработке анализа. В отличие от ДНК HHV-6,
В дополнение к обзору вирусной ассоциации с MS мы хотим предложить новые стратегии для оценки роли инфекционных агентов при MS. Эти новые стратегии включают в себя разработку новых инфекционных животных моделей MS, клинические испытания с эффективными противовирусными препаратами и высокочувствительными и непредвзятыми стратегиями идентификации последовательностей (например, панмикробные микрочипы и методы секвенирования следующего поколения для выявления новых патогенов или подтверждения наличия ранее ассоциированных патогенов у пациентов с MS).
ВОЗМОЖНЫЕ МЕХАНИЗМЫ, СВЯЗАННЫЕ MS С ВИРУСАМИ
Большая часть данных, связывающих MS с вирусом (-ами), была получена путем изучения присутствия части вируса, такого как ДНК, РНК или белки, в жидкостях или тканях организма или иммунного ответа на вирус. Иммунный ответ на вирусы включает в основном исследования антител в сыворотке или CSF у пациентов с MS по сравнению с данными из соответствующих контрольных групп. Т-клеточные ответы на различные вирусы также были изучены, хотя и менее интенсивно. Контрольные группы пациентов, используемые в различных исследованиях, различаются, и часто используются здоровые субъекты. Тем не менее, здоровые субъекты могут не быть наиболее информативной контрольной группой, но следует рассматривать более тесно связанные группы пациентов, такие как другие воспалительные неврологические расстройства (OIND). Эти исследования дали большое количество MS-ассоциированных агентов, но мало что известно о том, как вирусы могут на самом деле запускать или модулировать процесс заболевания MS. Были разработаны животные модели для MS, включая экспериментальный аутоиммунный энцефалит (EAE) и модели для вызываемой вирусом демиелинизации, такие как демиелинизирующее заболевание, вызванное вирусом мышиного энцефаломиелита Тейлера, у мышей. Модели на животных помогли исследованиям понять некоторые механизмы, такие как молекулярная мимикрия и активация наблюдателей, которые могут играть роль в возможной вирус-индуцированной патологии при MS. К сожалению, модели на животных для вирусов человека, например, EBV и HHV-6, которые, как предполагается, играют роль в патогенезе MS, недоступны. Большинство герпесвирусов являются строго видоспецифичными, и поэтому разработка животных моделей для изучения этих вирусов была затруднена.
ПРЯМОЙ МЕХАНИЗМ
Хотя современное представление о патогенезе РС подчеркивает роль иммунных клеток, включая Т- и В-клетки, нельзя исключать возможность прямой гибели миелин-продуцирующих олигодендроцитов или прямого токсического воздействия активной инфекции на клетки ЦНС. Возможно, что активация иммунной системы и инфильтрация лимфоцитов в бляшке MS является вторичным эффектом вследствие активной вирусной инфекции в олигодендроцитах или, возможно, в других резидентных клетках ЦНС. Прямая вирусная инфекция олигодендроцитов действительно может вызвать гибель клеток и демиелинизацию. JC-вирус, возбудитель прогрессирующей мультифокальной лейкоэнцефалопатии (PML), является известным примером человеческого вируса, способного инфицировать олигодендроциты и вызывать демиелинизацию. Вирус JC — вездесущий вирус, который обычно приобретается в детстве. Не совсем известно, почему это вызывает ПМЛ у некоторых людей, хотя иммуносупрессия является распространенным фактором среди всех пациентов с ПМЛ. Следует отметить, что у небольшой части пациентов с MS, получавших натализумаб, моноклональное антитело против α4-интегрина, развился ПМЛ. Биология латентности и реактивации вируса JC в PML недостаточно известна.
Хроническая вирусная инфекция ЦНС может вызвать заболевание и демиелинизацию. При подостром склерозирующем панцефалите (SSPE) хроническая медленная инфекция ЦНС вирусом кори приводит к воспалительным заболеваниям как серого, так и белого вещества. Вирус кори был выявлен в нейронах, глиальных и иммунных клетках ЦНС пациентов с SSPE [ 4 ]. Вирусная инфекция клеток ЦНС, отличных от олигодендроцитов, также может вызывать демиелинизацию, как в случае вируса чумы собак, который преимущественно инфицирует астроциты в белом веществе [ 5 ], а инфекция олигодендроцитов на самом деле является редким явлением при чуме у собак. HHV-6 был обнаружен в бляшках MS значительно чаще, чем в контрольном мозге или в нормальном состоянии белого вещества (NAWM) [ 6 , 7]. Экспрессия антигена HHV-6 наблюдается в основном в олигодендроцитах и в некоторой степени в астроцитах, но не известно, является ли это причиной или следствием образования бляшек MS.
МОЛЕКУЛЯРНАЯ МИМИКРИЯ
Предполагается, что молекулярная мимикрия, когда некоторые из белков-патогенов имеют гомологичные аминокислотные последовательности с собственными белками, является возможным механизмом индуцированного вирусами аутоиммунитета [ 8 ]. Было обнаружено, что некоторые вирусные последовательности гомологичны миелиновым белкам путем поиска гомологии [ 8 ]. Позже, путем поиска структурных требований для распознавания Т-клеточными рецепторами MHC-связанных пептидов, было обнаружено, что несколько вирусных пептидов, которые не могли быть идентифицированы путем поиска гомологии, имеют структурное сходство и способны активировать аутореактивные Т-клетки [ 9 ]. Хотя известно, что вирусные пептиды, имитирующие собственные белки, могут вызывать заболевание [ 8], долгое время не было известно, может ли вирусная инфекция вызывать заболевание с помощью молекулярной мимикрии. Это было рассмотрено Чжао и соавт . [ 10 ] на мышиной модели аутоиммунного герпес-стромального кератита. Авторы показали, что аутореактивные Т-клетки распознают белок HSV-1, UL-6. Кроме того, мутантный вирус, лишенный эпитопа, ответственного за распознавание Т-клеток, не смог вызвать заболевание [ 10 ]. Это было четкой демонстрацией того, что вирусная инфекция способна индуцировать аутоиммунитет посредством механизма молекулярной мимикрии.
Предполагается, что повышенный лимфопролиферативный ответ на антиген HHV-6A возникает у пациентов с РС по сравнению с контрольной группой [ 11 ]. Реакция на ВГЧ-6В была одинаковой у пациентов и контрольной группы. Кроме того, белок H24-HHV-6 имеет растягивающуюся на пролин аминокислоту (PRTPPPS) с основным белком миелина, который может действовать как молекулярный имитатор. Было показано, что более 50% Т-клеток, распознающих пептид MBP, перекрестно реагировали и могли активироваться пептидом HHV-6 U24 у пациентов с РС, что предполагает молекулярную мимикрию [ 12]. Частота субпопуляции Т-клеток, распознающих оба пептида, была значительно увеличена у пациентов с МS по сравнению со здоровыми контролями. Также были сообщения о повышенных реакциях CD4 + и CD8 + T-клеток на EBV, особенно на EBNA-1, у пациентов с MS по сравнению с контрольной группой [ 13 — 15 ]. Фракция CD4 + T-клеток, специфичных к EBNA-1, также распознает миелиновые антигены, что предполагает молекулярную мимикрию [ 16 ].
В дополнение к перекрестно-реактивным Т-клеточным ответам между вирусными антигенами и миелиновыми антигенами, перекрестно-реактивные антитела между вирусами и антигенами миелина были изучены, хотя и менее интенсивно. В одном отчете, посвященном исследованию специфичности антител к CSF к более чем 37 000 меченых белков, было показано, что два наиболее часто обнаруживаемых антигена представляют собой белки, ассоциированные с латентностью EBV, EBNA-1 и BRRF2 [ 13 ]. В другом исследовании с использованием комбинаторных библиотек, экспрессирующих одноцепочечные вариабельные фрагменты, клонированные из МКПК от пациентов с МS, Gabibov et al . [ 17] смогли идентифицировать перекрестно-реактивные антитела, которые распознавали латентный мембранный белок 1 MBP и EBV (LMP1). Напротив, другие продуцировали моноклональные антитела из В-клеток CSF пациентов с РС и не обнаружили никаких предполагаемых аутоантигенов или инфекционных антигенов [ 18 ].
АКТИВАЦИЯ БИСТАНДЕРА И РАСПРОСТРАНЕНИЕ ЭПИТОП
Термин « распространение эпитопа» впервые был использован для описания процесса, в котором генерируется разнообразный иммунный ответ против нескольких эпитопов одного белка, хотя первоначальный иммунный ответ был инициирован против одного доминантного эпитопа этого белка [ 19 ]. Кроме того, многие белки содержат загадочные эпитопы, которые скрыты от иммунной системы в интактном белке, но могут быть обнаружены иммунным клеткам после диссоциации. При хроническом повреждении ткани в результате вирусной инфекции, отторжения трансплантата или аутоиммунного процесса специфичность иммунного ответа распространяется на самостоятельные эпитопы, отличные от исходного белка, который инициировал воспалительный процесс [ 20].]. Распространение эпитопа может включать как самореактивные Т-клетки, так и В-клетки, но в основном изучается в контексте аутореактивных Т-клеток.
В дополнение к своей роли в качестве антителопродуцирующих клеток, B-клетки могут действовать как антигенпрезентирующие клетки (APC). В ответ на вирусную инфекцию APC захватывают вирусный антиген и представляют вирусные пептиды через молекулы MHC класса II к рецепторам Т-клеток. Взаимодействие В-клеток с CD4 Т-клетками, как правило, необходимо для выработки большого количества антител. Во время активной инфекции В-клетки представляют вирусные антигены рецепторам Т-клеток в контексте МНС класса II. Дополнительное взаимодействие между В-клеточными CD40 и Т-клеточными CD40L необходимо для производства интерлейкина 2, 4 и 5 Т-клетками, что, в свою очередь, активирует В-клетки для пролиферации и созревания в плазматических клетках, продуцирующих антитела. Возможно, что В-клетки в ЦНС пациентов с MS могут обрабатывать и представлять инфекционные агенты, а затем части инфицированных клеток или поврежденные окружающие ткани, рисунок 1). Таким образом, аутоиммунитет может быть повышен как на уровне B-, так и T-клеток. Кроме того, если это созревание В-клеток является специфическим для компартмента, то есть происходит только в ЦНС, это может объяснить наличие олигоклональных полос при МS. При MS олигоклональные полосы в основном наблюдаются только в CSF, хотя в некоторых случаях MS картина полос включает также сывороточные полосы. Тем не менее, распространение эпитопа трудно изучать у людей, и при таких расстройствах, как МS, инициирующий антиген обычно неизвестен. Таким образом, большинство данных о распространении эпитопа получены на мышиной модели, такой как EAE и демиелинизирующее заболевание, вызванное вирусом мышиного энцефаломиелита Тейлера (TMEV-IDD).
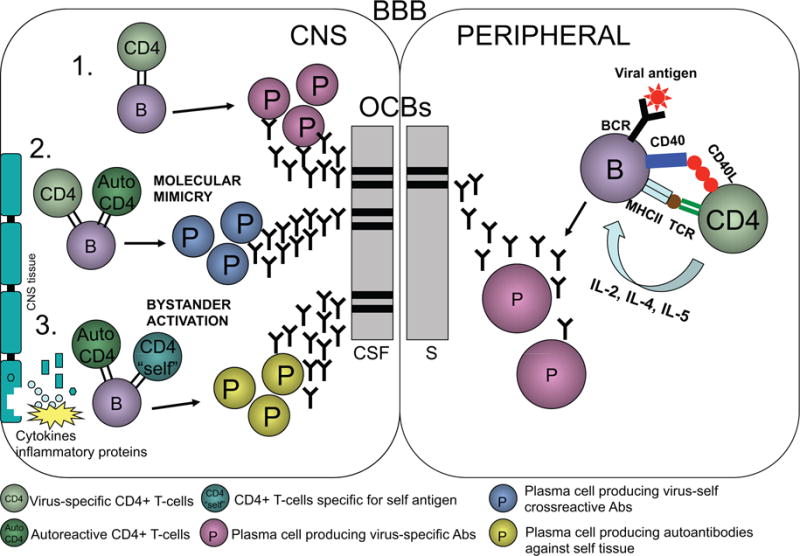
Эти плазматические клетки могут продуцировать клональные молекулы IgG, которые присутствуют в сыворотке во время активной инфекции периферии.
Если вирус проникает в ЦНС, В-клетки могут активироваться и превращаться в плазматические клетки и продуцировать антитела в маннаре, подобном периферии (1).
Вирусные антигены могут напоминать миелиновые антигены и индуцировать Т-клеточные, а также В-клеточные ответы, включая перекрестно-реактивные антитела к вирусным, а также аутоантигенам через механизмы молекулярной мимикрии (2).
Хроническая вирусная инфекция также может вызывать локальное повреждение тканей, приводящее к аутоантигенам, которые затем распознаются аутореактивными Т- или В-клетками (3).
Это приводит к образованию новых клонов Т-клеток и плазматических клеток, которые распознают только аутоантигены, но не вирусные антигены, которые могли инициировать процесс.
Любое из этих событий, происходящих в ЦНС, может продуцировать антитела, которые не обнаруживаются в периферической крови и, следовательно, будут присутствовать в CSF в виде олигоклональных полос.
Используя различные миелиновые пептиды в качестве антигенов, было показано, что распространение эпитопов, как внутримолекулярных, так и межмолекулярных, способствует развитию заболевания при ЭАЭ у мышей. Например, у мышей SJL, иммунизированных пептидом протеолипидного белка (PLP) 139–151, развивается ремиттирующее ремиттирующее заболевание, при котором CD4 + T-клетки, специфичные для PLP 139–151, появляются через три дня. Позже, во время первого рецидива, CD4 + T-клетки, специфичные для PLP 179–191, могут быть обнаружены. Во время второго рецидива можно продемонстрировать ответы CD4 + T-клеток на MBP 84–104, представляющие как внутримолекулярное, так и межмолекулярное распространение эпитопа [ 21 ]. Распространение эпитопа также играет роль в TMEV-IDD. Разрушение миелина инициируется миелин-специфическими Т-клетками, которые атакуют персистирующий вирус [ 22]]. После начала демиелинизации можно обнаружить ответы CD4 + T-клеток на PLP 139–151. Позднее при заболевании видны CD4 + Т-клетки, специфичные для менее энцефалитогенных миелиновых пептидов, таких как PLP 178–191, PLP 56–70 и MOG 92–106 [ 23 ]. При рассеянном склерозе иммунные ответы, включая компоненты В-клеток и Т-клеток, могут сначала быть направлены против активной или хронической вирусной инфекции, а затем диверсифицироваться посредством молекулярной мимикрии, активации случайных наблюдателей и / или распространения эпитопа против собственной ткани.
КОМПЛЕКСНОЕ ГЕНОМ-ВИРОМНОЕ ВЗАИМОДЕЙСТВИЕ
Степень тяжести вирусной инфекции зависит от множества различных факторов. Возможно, наиболее важным является взаимодействие между вирусами и иммунными механизмами хозяина. Иммунные механизмы хозяина, как и все признаки, зависят от генетики и иногда могут оказывать влияние на развитие симптоматического заболевания в ответ на инфекционные агенты. По мере того, как наши знания об общей микробной флоре росли, стало ясно, что у нас есть не только общая флора бактерий, но и общая флора вирусов, называемая виромой [ 24]. Наш виром состоит из распространенных вирусов, таких как эндогенные ретровирусы и герпесвирусы. Роль комменсальных бактерий как части физиологии человека хорошо известна, но роль вирома в физиологии и патофизиологии человека недостаточно изучена. Известно, что микробы необходимы для заражения и формирования иммунной системы, и недавно было предложено играть роль вездесущих вирусов в этом процессе [ 24 ].
Хотя некоторые полагают, что MS мог быть вызван одним вирусом, клиническая гетерогенность МS и разнообразие бляшек MS в ЦНС позволяют предположить, что в патогенезе этого заболевания может быть более одного инфекционного агента. Кроме того, распознавание более одного инфекционного триггера при MS, по крайней мере частично, объясняет длинный список вирусов, связанных с этим заболеванием (Таблица 1). MS- не единственное сложное заболевание человека, которое, как полагают, развивается в результате взаимодействия генома и вирома. Точно так же предположили, что взаимодействия геном-виром играют роль в диабете 1 типа, воспалительных заболеваниях кишечника и астме. Эти заболевания могут быть вызваны несколькими различными вирусными инфекциями, связанными с взаимодействиями между хозяином и вирусом, в модели, в которой распространенные частые вирусные инфекции могут вызывать или не вызывать симптомы .
Таблица 1
Неполный список вирусов и год (а), по которому они были связаны с РС (принято из Джонсона, 1994 [ 118 ])
| Вирус | лет |
|---|---|
| Rabies | 1946, 1964 |
| Простой герпес | 1964 |
| Скрепи агент | 1965 |
| MS-ассоциированный агент | 1962 |
| Вирус парагриппа 1 | 1972 |
| корь | 1972 |
| Симьян вирус 5 | 1978 |
| Цитомегаловирус шимпанзе | 1979 |
| Коронавирусы | 1980 |
| SIMON-подобный вирус | 1982 |
| Вирус клещевого энцефалита | 1982 |
| HTLV-1 | 1986 |
| MSRV (HERV-W) | 1989, 1997 |
| HSV-1 | 1989 |
| MS1533 (ретровирус) | 1994 |
| ВГЧ-6 | 1993, 1995 |
| Borna virus | 1998 |
| EBV | 1998, 2003, 2007 |
| VZV | 2004 |
| Torque Teno virus | 2005 |
Герпесвирусы и рассеянный склероз
Некоторые особенности некоторых распространенных герпесвирусов (EBV, HHV-6 и, возможно, VZV) делают их интересными кандидатами на роль триггеров РС. Эти три вируса распространены повсеместно, заражая почти всех людей в ранние годы жизни. Крупные эпидемиологические исследования миграции людей показали, что восприимчивость к РС приобретается в младенчестве или в раннем возрасте, способствуя раннему заражению повсеместно распространенным вирусом. Герпесвирусы остаются в организме в неактивной скрытой форме с периодической реактивацией. Все эти вирусы являются нейротропными, но также и нейровирулентными, то есть они могут инфицировать клетки ЦНС, а также вызывать заболевание ЦНС. Хотя возможно, что вирус, запускающий MS, непосредственно лизирует клетки в ЦНС, более вероятно, что MS ассоциирован с иммунопатогенным иммунным ответом хозяина на вирус.
ЭПШТЕЙН — БАРР ВИРУС (EBV) И МS
EBV (вирус герпеса человека 4) был выделен из лимфобластов пациентов с лимфомой. Первичная инфекция EBV может быть бессимптомной или может вызывать легкое заболевание. ВЭБ является возбудителем инфекционного мононуклеоза. Почти 100% населения в западных странах инфицированы EBV, и он остается латентным в В-клетках [ 29 ] после первичной инфекции. Хотя ранние исследования EBV при MS относятся к началу 70-х годов [ 30 ], связь между MS и EBV-инфекцией усилилась за последние несколько лет. Крупномасштабные популяционные исследования антител к EBV показали неизменно более высокую серопревалентность у пациентов с РС по сравнению с контрольной группой.
ИММУННЫЙ ОТВЕТ НА EBV В MS
Как у пациентов с MS, так и у пациентов с MS отмечены как более высокая серопревалентность, так и более высокие титры антител к ВЭБ по сравнению с контрольной группой. Существуют три основных антигена, которые обычно используются в исследованиях антител к EBV: вирусный капсидный антиген (VCA), комплекс ядерных антигенов EBV (EBNA) (или его часть, например, EBNA-1) и ранний антиген (EA). Есть некоторые общие различия в результатах в зависимости от того, какой антиген был использован. В недавнем метаанализе Santiago et al . [ 31 ] рассмотрели результаты исследований случай-контроль MS антител к различным антигенам по отдельности и обнаружили отношение шансов 5,5 для VCA, 5,4 для комплекса EBNA, 12,1 для EBNA-1 и 1,3 для EA. Следовательно, кажется, что EBNA-1 является наиболее значимым маркером инфекции EBV при MS. Во всех исследованиях, представленных в Таблица 2 Пациенты с MS имели более высокую серопревалентность, чем контрольная группа. Во всех исследованиях, кроме одного, распространенность была близка к 90–100% пациентов с MS и ниже в контрольной группе. Есть только два исследования антител против EBNA-1 в CSF, которые сообщили о более высокой распространенности антител против EBNA-1. Хотя распространенность сывороточных антител к VCA показывает большую вариабельность, чем антител к EBNA-1 (Таблица 3), более высокая серопревалентность VCA все еще наблюдается у пациентов с MS. Таким образом, увеличение распространенности антител к различным антигенам EBV у пациентов с MS по сравнению с контрольной группой является одним из наиболее убедительных доказательств, подтверждающих связь EBV с MS.
Таблица 2
Распространенность антител к EBNA-1 у пациентов с МС по сравнению с контрольными пациентами
| Образец | Ссылка | РС (%) | Контроль (%) |
|---|---|---|---|
| Сывороточный IgG | |||
| Ларсен и др ., 1985 [ 119 ] | 100 | 83,9 | |
| Wandinger et al ., 2000 [ 120 ] | 100 | 90,2 | |
| Munch et al ., 1998 [ 121 ] | 99,3 | 89,9 | |
| Пол и др ., 2006 [ 122 ] | 92,5 | 57,5 | |
| Banwell et al ., 2007 [ 123 ] | 57,9 | 56,3 | |
| Haahr et al ., 2004 [ 124 ] | 100 | 94,3 | |
| Вагнер и др ., 2000 [ 125 ] | 100 | 90,2 | |
| Sundstrom et al ., 2004 [ 126 ] | 99,6 | 95,3 | |
| Линдси и др ., 2010 [ 127 ] | 97,5 | 92,5 | |
| Ingram, et al ., 2010 [ 128 ] | 94,7 | 93,3 | |
| Виллегас и др ., 2011 [ 129 ] | 86,8 | 82,7 | |
| CSF IgG | |||
| Брей и др ., 1992 [ 130 ] | 79,7 | 14,5 | |
| Виллегас и др ., 2011 [ 129 ] | 82 | 69 |
Таблица 3
Распространенность антител против вирусного капсидного вируса (VCA) EBV в MS и контролях
| Образец | Ссылка | РС (%) | Контроль (%) |
|---|---|---|---|
| Сывороточный IgG | |||
| Banwell et al ., 2007 [ 123 ] | 85,7 | 63,5 | |
| Пол и др ., 2006 [ 122 ] | 98,6 | 72,1 | |
| Зивадинов и др ., 2006 [ 131 ] | 95 | 100 | |
| Ponsonby et al ., 2005 [ 132 ] | 100 | 96,5 | |
| Алотаиби и др ., 2004 [ 133 ] | 83,3 | 56,7 | |
| Sundstrom et al ., 2004 [ 126 ] | 100 | 98,7 | |
| Ascherio et al ., 2001 [ 134 ] | 99,3 | 93,4 | |
| Myhr et al ., 1998 [ 135 ] | 97,9 | 81,1 | |
| Shirodaria et al ., 1987 [ 136 ] | 100 | 92,3 | |
| Брей и др ., 1992 [ 130 ] | 57,7 | 24,8 | |
| Брей и др ., 1983 [ 137 ] | 98,7 | 89,4 | |
| Sumaya et al ., 1980 [ 138 ] | 98,7 | 93,8 | |
| Сумайя и др ., 1976 [ 139 ] | 98,6 | 94,6 |
EBV присутствует в головном мозге?
В дополнение к увеличению серопревалентности EBV у пациентов с РС, некоторые сообщения также показали, что иммунный ответ, по крайней мере, в подгруппе пациентов, может быть интратекальным. Это предполагает вирус-специфические ответы в ЦНС и, следовательно, косвенно предполагает присутствие вируса в этом компартменте [ 32 ]. Этот интратекальный ответ, однако, также предположительно является частью полиспецифического ответа при MS [ 33 ]. Наличие EBV в мозге MS и особенно в бляшках MS — важная проблема с противоречивыми сообщениями в литературе. Данные, демонстрирующие наличие или отсутствие EBV в мозге MS, были рассмотрены, и попытки объяснить причины различных опубликованных результатов были рассмотрены рабочей группой NeuroproMiSe EBV [ 34]. Хотя Группа пришла к выводу, что большинство противоречий обусловлено различной спецификой и чувствительностью методов, использованных в разных исследованиях, в разных отчетах все еще имеются противоречивые результаты с использованием одних и тех же методов, то есть гибридизации in situ для РНК EBER [ 35 , 36 ]. , Небольшие некодирующие РНК, EBER, в большом количестве экспрессируемые в каждой латентно инфицированной клетке, служат золотым стандартом для выявления инфекции EBV in situ. Существует соглашение о том, что РНК EBER может быть обнаружена in situ из образцов обильной опухоли EBV. Разница возникает при взгляде на образцы мозговой ткани, которые имеют небольшое количество, если таковые имеются, инфицированных В-клеток. Тем не менее, современные данные свидетельствуют о том, что EBV обычно не присутствует в бляшках головного мозга при MS.
ИНФЕКЦИОННЫЙ МОНОНУКЛЕОЗ И МS
Первичная инфекция EBV может протекать бессимптомно или проявляться как инфекционный мононуклеоз. В недавнем метаанализе [ 37 ], включающем 18 популяционных исследований или исследований типа «случай-контроль», была изучена роль инфекционного мононуклеоза как фактора риска при MS. Общее количество случаев РС, включенных в мета-анализ, составило 19 390, а также было изучено 16 007 контролей. Относительный риск, определенный в этом мета-анализе, составлял 2,17 (95% ДИ 1,97-2,39; р <10 -54 ), подтверждая результаты (ОР 2,3) из предыдущего мета-анализа, проведенного с меньшим количеством пациентов и контрольной группы [ 38 ]. Было высказано предположение, что инфекционный мононуклеоз увеличивает риск рассеянного склероза, и этот риск сохраняется в течение не менее 30 лет после заражения [ 39]. Недостаточно понятно, почему симптоматическая ВЭБ-инфекция повышает риск развития МS по сравнению с пациентами с бессимптомной инфекцией. Одним из возможных объяснений может быть теория гигиены [ 40 ]; население в западных странах контактирует с меньшим количеством микроорганизмов, и поэтому иммунная система может начать реагировать на собственные ткани, что может привести к аутоиммунному заболеванию. Гипотеза о гигиене использовалась для объяснения недавнего роста аллергии и аутоиммунных заболеваний в развитых странах. На самом деле, инфекционный мононуклеоз встречается чаще, если первичная инфекция EBV возникает в более позднем возрасте. Это может свидетельствовать о том, что люди, которые приобретают ВЭБ в более позднем возрасте, также имели меньший контакт с другими микробами и, следовательно, согласно теории гигиены, могут быть более подвержены аутоиммунным заболеваниям, таким как MS.
ПРИСУТСТВИЕ ДНК EBV ПРИ МНОГОКРАТНОМ СКЛЕРОЗЕ
Присутствие ДНК EBV в различных образцах MS обобщено в Таблица 4, В целом, ДНК EBV является редкой находкой в бесклеточных жидкостях организма, таких как плазма или CSF. В опубликованных исследованиях по распространенности ДНК EBV в плазме между пациентами с РС и контрольной группой не было обнаружено никаких различий [ 41 , 42 ]. Поскольку размеры выборки в этих исследованиях были небольшими, трудно сделать какие-либо окончательные выводы на основе этих отчетов. Кроме того, присутствие ДНК EBV в CSF весьма необычно, и не обнаружено различий между MS и контрольным CSF. Поскольку EBV находится в В-клетках во время латентности, ДНК обнаруживается чаще в РВМС. Некоторые исследователи обнаружили значительные различия в распространенности ДНК EBV в РВМС между МС и контрольной группой [ 43 ], в то время как другие этого не сделали [ 44 — 46.]. В заключение, результаты выявления ДНК EBV, отличной от латентной формы, в РВМС редки, и, по-видимому, нет существенных различий в распространенности ДНК EBV, обнаруженной с помощью ПЦР, между пациентами с РС и контрольной группой.
Таблица 4
Распространенность ДНК EBV у пациентов с МС по сравнению с контрольной группой
| Образец | Ссылка | РС (%) | Контроль (%) |
|---|---|---|---|
| Плазменная ДНК | |||
| Höllsberg et al ., 2005 [ 42 ] | 15,2 | 5,5 | |
| Вагнер и др ., 2004 [ 41 ] | 29 | 16,1 | |
| PBMC DNA | |||
| Альварес и др ., 2000 [ 44 ] | 32,2 | 35,3 | |
| Ferrante et al ., 2000 [ 45 ] | 50 | 38,9 | |
| Hay and Tenser, 2000 [ 46 ] | 100 | 100 | |
| Сотело и др ., 2007 [ 43 ] | 84,2 | 63,1 | |
| ДНК мозга | |||
| Морре и др ., 2001 [ 140 ] | 0 | 0 | |
| Сандерс и др ., 1996 [ 141 ] | 27 | 37,8 | |
| ДНК CSF | |||
| Альварес-Лафуэнте и др ., 2008 [ 142 ] | 2,1 | 0 | |
| Это и др ., 2007 [ 143 ] | 0 | 0 | |
| Манкузо и др ., 2007 [ 144 ] | 2.5 | 0 | |
| Martin et al ., 1997 [ 145 ] | 0 | 0 | |
| Морре и др ., 2001 [ 140 ] | 0 | 0 |
ЧЕЛОВЕЧЕСКИЙ ГЕРПЕСВИРУС 6 (HHV-6)
HHV-6 был впервые выделен у пациентов со СПИДом и иммунопролиферативными синдромами в 1986 году [ 47 ]. Два различных типа HHV-6, HHV-6A и HHV-6B, были идентифицированы, и они отличаются друг от друга по биологическим, иммунологическим и клиническим признакам [ 48 ]. HHV-6B приобретается в раннем возрасте, обычно в возрасте до двух или трех лет. После первичной инфекции, которая может протекать бессимптомно или присутствовать в виде exanthema subitum (roseola babyum), вирус становится латентным и в основном обнаруживается в РВМС на всю жизнь. Вирус HHV-6B — это повсеместный вирус с серопревалентностью, достигающий 100% в западных странах. Из-за отсутствия серологических анализов для выявления HHV-6A, распространенность и время приобретения HHV-6A не известны. Перекрестно-реактивный характер антител HHV-6A и HHV-6B, которыйin vivo не являются перекрестно-защитными, так как могут быть обнаружены двойные инфекции, что затрудняет серологические исследования HHV-6A. Тем не менее, было высказано предположение, что HHV-6A является более нейротропным, чем HHV-6B, на основе более распространенного выявления HHV-6A в CSF, чем в РВМС [ 49 ].
ВГЧ-6 И МS
Вскоре после его открытия в 1986 г. [ 47 ] предварительные сообщения предположили возможную связь ВГЧ-6 в патогенезе рассеянного склероза. Sola et al . [ 50 ] исследовали титры сывороточных антител по ИФА и вирусной ДНК в РВМС методом ПЦР от 126 пациентов с РС и 500 контролей. Значительно более высокие титры сывороточных антител были обнаружены у пациентов с РС. Напротив, ДНК HHV-6 была обнаружена только редко у пациентов с РС или контрольных PBMC, и поэтому был сделан вывод, что высокие титры антител к HHV-6 в сыворотке могут быть следствием нарушения иммунитета, а не реактивации HHV-6 скрытой инфекции HHV-6. , В другом исследовании [ 51], ДНК ВГЧ-6 была обнаружена в трех образцах CSF у 21 пациента с РС (14,3%), но не у пациентов с другими неврологическими заболеваниями (OND), включая миалгический энцефалит, менингит и синдром хронической усталости, или у здоровых контрольных пациентов. В этом исследовании титры сывороточных антител против ВГЧ-6, измеренные методом ИФА, также были выше в сыворотке пациентов с МС по сравнению с ОНД или здоровыми контролями, что подтверждает возможную роль ВГЧ-6 в патогенезе рассеянного склероза. Повышенные титры антител в сыворотке к HHV-6, сообщенные Sola et al . [ 50 ] было подтверждено другими исследователями вскоре после первоначальных сообщений [ 51 ]. Тем не менее, более поздние исследования показали гораздо больше различий в вирусных титрах HHV-6 и распространенности антител против HHV-6 при РС и контроле (Таблица 5). Это может объясняться различными группами пациентов и контрольными группами, а также различиями в используемых серологических анализах.
Таблица 5
Результаты поиска антител к вирусу HHV-6 в MS
| Образец | Ссылка | РС (%) | Контроль (%) |
|---|---|---|---|
| Сывороточный IgG | Sola et al ., 1993 [ 50 ] | 71 | 41 |
| Liedtke et al ., 1995 [ 146 ] | 39 | 18 | |
| Солдан и др ., 1997 [ 147 ] | 85 | 72 | |
| Аблаши и др ., 1998 [ 148 ] | 69 | 28 | |
| Энбом и др ., 1999 [ 149 ] | 100 | 100 | |
| Аблаши и др ., 2000 [ 150 ] | 90 | 75 | |
| Таус и др ., 2000 [ 151 ] | 30 | 25 | |
| Дерфусс и др ., 2005 [ 152 ] | 84 | 88 | |
| Виртанен и др ., 2007 [ 153 ] | 100 | 69 | |
| Куусисто и др ., 2008 [ 154 ] | 88 | 86 | |
| Бехзад-Бехбахани и др ., 2011 [ 155 ] | 100 | 73 | |
| Сыворотка IgM | Liedtke et al ., 1995 [ 146 ] | 3 | 2 |
| Солдан и др ., 1997 [ 147 ] | 73 | 18 | |
| Аблаши и др ., 1998 [ 148 ] | 56 | 19 | |
| Фридман и др ., 1999 [ 56 ] | 80 | 16 | |
| Аблаши и др ., 2000 [ 150 ] | 71 | 15 | |
| Энбом и др ., 2000 [ 156 ] | 2 | NT | |
| Таус и др ., 2000 [ 151 ] | 0 | 0 | |
| Риверол и др ., 2007 [ 157 ] | 35 | 34 | |
| Куусисто и др ., 2008 [ 154 ] | 6 | 0 | |
| CSF IgG | Sola et al ., 1993 [ 50 ] | 7 | NT |
| Уилборн и др ., 1994 [ 51 ] | 0 | 0 | |
| Аблаши и др ., 1998 [ 148 ] | 39 | 7 | |
| Фридман и др ., 1999 [ 56 ] | 94 | 100 | |
| Онгради и др ., 1999 [ 158 ] | 43 (6А) 87 (6В) | 17 (6А) 0 (6В) | |
| Аблаши и др ., 2000 [ 150 ] | 4 | NT | |
| Дерфусс и др ., 2005 [ 152 ] | 34 | 12 | |
| Виртанен и др ., 2007 [ 153 ] | 15 | 0 | |
| Куусисто и др ., 2008 [ 154 ] | 0 | 0 |
Первые прямые доказательства участия HHV-6 в патогенезе MS были опубликованы в 1995 году [ 7 ]. Чаллонер и его коллеги использовали репрезентативный анализ различий (RDA), представленный Lisitsyn et al . [ 52]. RDA — это метод субтрактивной гибридизации, который можно использовать для идентификации последовательностей нуклеиновых кислот, которые являются уникальными или присутствуют в большем количестве у больных по сравнению со здоровыми тканями. Содержание ДНК из ткани головного мозга МС сравнивали с ДНК из лейкоцитов периферической крови здоровых доноров. С помощью RDA им удалось идентифицировать последовательность ДНК размером 341 п.о. от одного из пяти пациентов, которая была практически идентична гену HHV-6, кодирующему основной ДНК-связывающий белок HHV-6. Challoner расширил эти результаты, обнаружив присутствие ДНК HHV-6 в образцах мозга с помощью вложенной ПЦР, и обнаружил, что ДНК HHV-6 присутствовала в 78% и 74% случаев MS и контролей, соответственно. Хотя авторы статьи пришли к выводу, что HHV-6, особенно вариант B, является комменсальным вирусом в мозге человека, они также продемонстрировали экспрессию антигена HHV-6B в бляшках MS в олигодендроцитах, но не в контрольном мозге или в областях без бляшек в мозге MS. Поскольку разрушение олигодендроцитов (приводящее к деградации миелина) является отличительной чертой MS, исследования предполагают связь HHV-6 с этиологией или патогенезом MS. Чтобы расширить эти наблюдения, Cermelli и другие [53 ] провели исследование, в котором бляшки МС были выделены с помощью лазерной микродиссекции из образцов мозга, а ДНК была очищена и использована для обнаружения ДНК HHV-6 с помощью вложенной ПЦР. Контроли включали образцы мозга из нормально появляющегося белого вещества (NAWM) от тех же пациентов с MS и образцы мозга от пациентов с другими неврологическими заболеваниями и пациентов с другими воспалительными не неврологическими расстройствами. В то время как скорость ДНК HHV-6 была сходной в образцах NAWM пациентов с РС и в контрольном мозге, частота обнаружения ДНК HHV-6 была значительно выше в бляшках MS. Другие исследовали экспрессию антигена HHV-6 в образцах головного мозга при РС. Карриган и другие [ 54 , 55] продемонстрировал антиген HHV-6 в восьми из 11 образцов мозга от пациентов с РС, но не в любом из семи контрольных образцов мозга. Этот результат был подтвержден другими [ 6 , 56 , 57 ], хотя Коутс и Белл [ 58 ] не смогли идентифицировать антиген HHV-6 ни в одном из 23 образцов мозга пациентов с РС (хотя они успешно идентифицировали HHV-6). антиген в ткани слюнных желез). В совокупности эти исследования показывают, что, хотя HHV-6 обнаруживается в мозге человека, он обнаруживается значительно чаще в бляшках MS. Предполагает ли это, что ВГЧ-6 является причиной или следствием развития зубного налета, остается без ответа.
Результаты ДНК HHV-6 в различных материалах образцов от пациентов с РС по сравнению с контрольными группами также различаются между исследованиями (Таблица 6). В сыворотке уровень обнаружения ДНК колеблется от 0 до 83% и от 0 до 53% в случаях РС и контроле, соответственно. В CSF показатели обнаружения составляют от 0 до 78% и от 0 до 20% в случаях и контролях соответственно. Немногие исследования достигли статистически значимой разницы между группами. В образцах мозга частота обнаружения выше, чем в сыворотке или CSF, и может свидетельствовать о том, что активация HHV-6 ограничена тканями, а HHV-6 обычно не присутствует в виде свободных вирусных частиц в жидкостях организма или только в течение короткого времени в течение вирусного периода. активация возможно во время рецидива.
Таблица 6
Выявление ДНК ВГЧ-6 у пациентов с МС по сравнению с контрольными пациентами
| Образец | Ссылка | РС (%) | Контроль (%) |
|---|---|---|---|
| ДНК сыворотки | Уилборн и др ., 1994 [ 51 ] | 0 | 0 |
| Martin et al ., 1997 [ 145 ] | 0 | NT | |
| Солдан и др ., 1997 [ 147 ] | 30 | 0 | |
| Филе и др ., 1998 [ 159 ] | 6 | 0 | |
| Goldberg et al ., 1999 [ 160 ] | 4 | 0 | |
| Мирандола и др ., 1999 [ 161 ] | 0 | 0 | |
| Техада-Саймон и др ., 2002 [ 162 ] | 67 | 33 | |
| Аль-Шаммари и др ., 2003 [ 163 ] | 0 | 0 | |
| Техада-Саймон и др ., 2003 [ 12 ] | 83 | 55 | |
| Альварес-Лафуэнте и др ., 2006 [ 164 ] | 25 | 0 | |
| Виртанен и др ., 2007 [ 153 ] | 0 | 0 | |
| Куусисто и др ., 2008 [ 154 ] | 0 | 0 | |
| Ахрам и др ., 2009 [ 165 ] | 27 | 24 | |
| Бехзад-Бехбахани и др ., 2011 [ 155 ] | 33 | 5 | |
| PBMC DNA | Sola et al ., 1993 [ 50 ] | 3 | 4 |
| Торелли и др ., 1995 [ 166 ] | 3 | 22 | |
| Мерелли и др ., 1997 [ 167 ] | 5 | 0 | |
| Mayne et al ., 1998 [ 168 ] | 25 | 24 | |
| Ротола и др ., 1999 [ 169 ] | 41 | 29 | |
| Аблаши и др ., 2000 [ 150 ] | 75 | 60 | |
| Hay and Tenser, 2000 [ 46 ] | 7 | 14 | |
| Ким и др ., 2000 [ 170 ] | 21 | 0 | |
| Ротола и др ., 2000 [ 171 ] | 40 | 37 | |
| Таус и др ., 2000 [ 151 ] | 14 | 0 | |
| Альварес-Лафуэнте и др ., 2002 [ 172 ] | 49 | 22 | |
| Альварес-Лафуэнте и др ., 2002 [ 173 ] | 53 | 30 | |
| Чапенко и др ., 2003 [ 66 ] | 62 | 29 | |
| Альварес-Лафуэнте и др ., 2006 [ 164 ] | 81 | 30 | |
| Альварес-Лафуэнте и др ., 2007 [ 174 ] | RRMS 54 SPMS 38 | 30 | |
| ДНК CSF | Уилборн и др ., 1994 [ 51 ] | 14 | 0 |
| Liedtke et al ., 1995 [ 146 ] | 11 | 5 | |
| Martin et al ., 1997 [ 145 ] | 0 | 0 | |
| Аблаши и др ., 1998 [ 148 ] | 17 | 0 | |
| Филе и др ., 1998 [ 159 ] | 6 | 0 | |
| Энбом и др ., 1999 [ 149 ] | 6 | 6 | |
| Goldberg et al ., 1999 [ 160 ] | 0 | 0 | |
| Мирандола и др ., 1999 [ 161 ] | 0 | 0 | |
| Таус и др ., 2000 [ 151 ] | 0 | 0 | |
| Техада-Саймон и др ., 2002 [ 162 ] | 47 | 20 | |
| Cirone et al ., 2002 [ 175 ] | 78 | NT | |
| Виртанен и др ., 2007 [ 153 ] | 0 | 0 | |
| Куусисто и др ., 2008 [ 154 ] | 0 | 0 | |
| Альварес-Лафуэнте и др ., 2008 [ 142 ] | 10 | 0 | |
| Манкузо и др ., 2010 [ 176 ] | 2 | 0 | |
| ДНК мозга | Чаллонер и др ., 1995 [ 7 ] | 78 | 74 |
| Сандерс и др ., 1996 [ 141 ] | 57 | 38 | |
| Мерелли и др ., 1997 [ 167 ] | 0 | 50 | |
| Фридман и др ., 1999 [ 56 ] | 36 | 14 | |
| Cermelli et al ., 2003 [ 53 ] | 58 | 27 |
Активация HHV-6 во время рецидивов
Идея о том, что вирусы могут вызывать рецидивы РС или что они активируются как эпифеномен во время рецидивов, известна давно. Несколько распространенных вирусов были связаны с рецидивами, и действительно, одна треть всех рецидивов MS была связана с распространенными трансмиссивными патогенами [ 59 — 62 ]. Интересно, что прививки не являются фактором риска рецидивов рассеянного склероза или развития болезни [ 63 , 64 ], что свидетельствует о том, что только активация иммунной системы не влияет на риск рецидивов рассеянного склероза.
Зостер и MS
Первичная инфекция VZV вызывает ветряную оспу (ветряная оспа), а реактивация в более позднем возрасте вызывает опоясывающий лишай (опоясывающий лишай). К 15 годам у 95% людей в развитых странах появилась инфекция [ 69 ]. Marrie и Wolfson [ 70 ] проанализировали опубликованные данные об ассоциации VZV и MS в мета-анализе в 2001 году. Большинство сероэпидемиологических исследований и исследований случай-контроль, рассмотренных в мета-анализе, не смогли показать какую-либо корреляцию между VZV-инфекцией или ветряной оспой и MS , Однако некоторые исследования показали более высокую серопревалентность антител к VZV у больных с СМЖ у пациентов с РС [ 71 , 72]. Это, вероятно, отражает полиспецифический ответ на несколько нейротропных вирусов, таких как корь, краснуха и VZV при MS. Кроме того, предполагается, что VZV присутствует в РВМС пациентов во время клинического рецидива с помощью ПЦР [ 43 , 73 ]. Вирусные частицы VZV также наблюдались с помощью электронной микроскопии в CSF во время рецидива [ 74 ], хотя это не было подтверждено другими [ 75 ]. В общенациональном популяционном исследовании, проведенном на Тайване, Kang et al ., [ 76] наблюдали 315 550 пациентов с опоясывающим герпесом и 946 650 случайно выбранных контрольных пациентов в течение одного года. Установлено, что риск развития РС в 3,63 раза выше в группе с опоясывающим герпесом. Этот вывод должен быть подтвержден в других популяциях. Хотя связь VZV с MS не так сильна, как в случае EBV или HHV-6, это крупномасштабное исследование может предположить, что реактивация VZV может выступать также в качестве пускового механизма в начале заболевания MS и требует дополнительных исследований для изучения этой ассоциации.
ЭНДОГЕННЫЕ РЕТРОВИРУСЫ И MS
Эндогенные ретровирусы проникли в геном человека миллионы лет назад. В общей сложности до 8% всего генома человека может состоять из эндогенных ретровирусных последовательностей. Поэтому не удивительно с эволюционной точки зрения, что эти ретровирусные последовательности и возможные белки, которые транслируются из этих вирусных транскриптов, связаны как со здоровьем, так и с болезнью. Некоторые эндогенные вирусные последовательности способны влиять на транскрипцию гена-хозяина или даже трансактивировать другие вирусы. Напротив, было показано, что несколько вирусов регулируют или активируют транскрипцию эндогенных ретровирусных генов, таких как ген env. Кроме того, было высказано предположение, что некоторые герпесвирусы, такие как VZV, HSV-1, EBV и HHV-6, могут активировать ретровирусные элементы HERV-W [ 77 ].
Обратная транскриптазная активность и ретровирусные частицы были выявлены в клетках лептоменингиальных клеток у пациентов с РС [ 78 ]. Сначала считалось, что он связан с известными Т-клеточными лимфотропными вирусами (HTLV), но объясняет сходство между миелопатией, ассоциированной с HTLV-1 / тропическим спастическим парапарезом (HAM / TSP), и РС [ 79 ]. Более поздняя характеристика вирусных элементов, однако, доказала, что он является эндогенным, а не известным экзогенным ретровирусом [ 80 — 82 ], и впервые был назван ассоциированным с МС ретровирусным элементом (MSRV). Позже вирус был идентифицирован как новое семейство HERV, HERV-W [ 83 ]. Наличие HERV-W чаще встречается у пациентов с РС, чем в контрольной группе [ 84] и наличие РНК HERV-W в СМЖ пациентов с МС, как полагают, является краткосрочным [ 85 ], а также долгосрочным [ 86 ] клиническим прогностическим маркером заболевания.Перейти к:
HERVS И НЕЙРОИНПЛАММАЦИЯ
Как могут HERV играть роль в патогенезе MS? Ген env HERV-W кодирует белок, называемый синцитин-1, который чаще экспрессируется при РС, чем в контрольном мозге [ 87 ]. Синцитин-1 обнаружен в астроцитах, периваскулярных макрофагах и активированной микроглии [ 88 ]. Он способствует экспрессии цитокинов и выделению активных форм кислорода в астроцитах, что приводит к повреждению олигодендроцитов. Он также может вызывать врожденный иммунитет через Toll-подобный рецептор 4 (TLR-4), что приводит к высвобождению провоспалительных цитокинов [ 89 ]. Синцитин-1 также может вызывать стресс эндоплазматического ретикулума в астроцитах [ 90]. Эти события, инициированные синцитином-1 (возможно, повышенные из-за чрезмерной экспрессии HERV-W при MS по сравнению с контрольной группой), могут способствовать нейровоспалению в развивающихся бляшках MS.
Вирус кори В МS
Как вирус кори (парамиксовирус), так и вирус краснухи (тогавирус) могут вызывать демиелинизирующее заболевание ЦНС. Корь является причиной подострого склерозирующего панэнцефалита (SSPE), а краснуха является причиной прогрессирующего панэнцефалита краснухи. Повышенные уровни антител к кори в сыворотке и более высокая частота антител в CSF чаще выявлялись у пациентов с РС, чем в контрольной группе [ 91 ]. Попытки обнаружить РНК кори в крови МС [ 92 ] и ткани мозга [ 93 ] были безуспешными. Хотя пациенты с РС, вакцинированные против вируса кори, имеют антитела к кори в CSF, пациенты с РС с естественной корью имеют более высокие сывороточные антитела и антитела к кори CSF, чем те, которые были вакцинированы [ 94 ].
ВНУТРЕННИЙ ОТВЕТ ЧЕЛОВЕКА НА ВИРУСЫ — КОНКРЕТНЫЕ ИЛИ ПОЛИСПЕЦИФИЧЕСКИЕ
Единственным лабораторным маркером в клиническом диагнозе РС является аномальная интратекальная продукция IgG. Есть два метода, которые были использованы для обнаружения интратекальных антител IgG при MS; измерение индекса IgG и выявление олигоклональных полос. Индекс IgG рассчитывается путем определения соотношения CSF и IgG в сыворотке, которые были скорректированы с учетом концентрации альбумина в CSF и сыворотке. Олигоклональные полосы детектируют с использованием методов изоэлектрической фокусировки для разделения различных клонов IgG в CSF и сыворотке. Отделенные молекулы IgG затем обнаруживаются с помощью иммунофиксации или иммуноблоттинга. Сопоставимые образцы CSF и сыворотки проходят параллельно, и положительные результаты определяются двумя или более различными полосами IgG, обнаруженными в CSF, но не в сыворотке. Ни один из этих методов не является специфическим для РС и может быть продемонстрирован при СМЖ от других воспалительных заболеваний ЦНС. Измерение индекса IgG является количественным, а определение олигоклональных полос — качественным. В целом, полиспецифическая продукция IgG в ЦНС увеличивает индекс IgG, но не влияет на количество олигоклональных полос. Олигоклональные полосы считаются более маркером клональной антигенспецифической активации различных В-клеточных клонов. Следовательно, разумно предположить, что олигоклональные ответы CSF должны быть нацелены на соответствующий антиген заболевания.
Как уже упоминалось, олигоклональные полосы не являются специфичными для MS и наблюдаются при других воспалительных, главным образом инфекционных, заболеваниях ЦНС. Важно отметить, что при этих заболеваниях было показано, что олигоклональные полосы специфичны для причинного вируса. Эти заболевания включают, но не ограничиваются ими; SSPE, в которой олигоклональные полосы специфичны для вируса кори, ассоциированного с HTLV-1 неврологического заболевания (HAM / TSP), при котором олигоклональные полосы специфичны для HTLV-1, и энцефалит простого герпеса, в котором олигоклональные полосы специфичны для HSV-1. Зная, что олигоклональные полосы обычно обнаруживаются у пациентов с инфекционными заболеваниями ЦНС, заманчиво предположить, что олигоклональные полосы могут быть биомаркером для инфекционного триггера. Гилден предположил: «если ВЭБ или любой другой вирус вызывает РС,95 ]. Было предпринято несколько попыток идентифицировать инфекционные агенты, ответственные за образование олигоклональных полос при MS. Например, было показано, что некоторые олигоклональные полосы специфичны для Chlamydia pneumoniae [ 96 , 97 ], EBV [ 13 , 98 ] и HHV-6 [ 99 ].
В наших недавних исследованиях мы также обнаружили, что у части (приблизительно одной трети) пациентов с РС были специфические олигоклональные полосы EBV или HHV-6 в CSF (рукопись представлена). Одним интригующим открытием является наблюдение, что олигоклональные полосы при MS остаются одинаковыми во время развития и прогрессирования заболевания MS, даже когда В-клетки истощаются лечением анти-CD20 (ритуксимабом) [ 100 , 101]. В нашем исследовании мы также оценивали продольные образцы CSF и продемонстрировали, что HHV-6-специфичные OCBs, подобно общим OCB IgG, оставались неизменными во времени. Кроме того, мы обнаружили, что у пациентов с олигоклональными полосами, специфичными для герпесвируса, либо EBV, либо HHV-6, было меньше поражающих МРТ поражений, усиливающих контраст. Это открытие может указывать на то, что постоянная продукция интратекальных антител против герпесвирусов, представленных как вирус-специфические OCBs в CSF, может контролировать вирус в ЦНС. Пациенты, у которых нет сильного ответа интратекального антитела на вирус, могут не контролировать вирус, что может привести к вирусной активации и увеличению повреждения ЦНС, отражая увеличение числа контрастных поражающих поражений. Это согласуется с данными о том, что у пациентов с рецидивом более активная инфекция HHV-6 [ 65 —67 ].
ИНФЕКЦИОННЫЕ ЖИВОТНЫЕ МОДЕЛИ МS
Экспериментальный аутоиммунный энцефаломиелит (ЭАЭ) является наиболее часто используемой животной моделью РС. Это вызвано, чаще всего у мышей, использованием миелиновых антигенов или миелиновых пептидов с помощью адъюванта. Заболевание варьируется в зависимости от используемого штамма животных и миелиновых эпитопов. Отличительной чертой этого заболевания является инфильтрация специфических для миелина Th1 CD4 + T-клеток в ЦНС. Было показано, что присутствие Th1 CD4 + T-клеток является важной особенностью в индукции заболевания, поскольку для индукции заболевания достаточно адоптивного переноса миелин-специфических CD4 + T-клеток [ 102].]. При монофазном ЭАЭ удаление воспалительных инфильтратов из ЦНС связано с выздоровлением. Первые попытки создать модель инфекционной демиелинизирующей мыши, индуцированной молекулярной мимикрией, включали рекомбинантный вирус коровьей оспы, экспрессирующий протеолипидный белок [ 103].]. Хотя заболевание не было вызвано инфекцией этим вирусом, у зараженных животных позже развился более тяжелый EAE, когда энцефалитогенные миелиновые пептиды были введены животным. Очевидно, что из ЕАЕ многое узнали о том, как аутоиммунность может играть роль при РС, и ЕАЕ послужила полезной доклинической моделью для клинической терапии РС. Однако, если инфекционный компонент играет роль при РС, то ЭАЭ может не подходить. В дополнение к EAE, есть некоторые инфекционные мышиные модели демиелинизации, которые были изучены.
МЫШЕЧНАЯ ЭНЦЕФАЛОМИЭЛИТА ТЕЛЕРА, ВИРУСНАЯ, ДЕМИЛИНИРУЮЩАЯ БОЛЕЗНЬ ЦНС
TMEV, вирус пикорны мышей, является естественным патогеном мышей. Он обычно поражает желудочно-кишечный тракт, но также способен вызывать демиелинизацию в ЦНС. Способность вызывать демиелинизирующее заболевание зависит от штамма вируса и генетического фона мыши. Две группы TMEV были идентифицированы; один вызывает острый энцефалит, а другой вызывает хроническое прогрессирующее демиелинизирующее заболевание, главным образом в спинном мозге. Внутрицеребральная инфекция вирусами, вызывающими демиелинизирующее заболевание, приводит к персистирующей инфекции ЦНС. Однако основной причиной демиелинизирующего заболевания является инфильтрация иммунных клеток в ЦНС. В общем, вызванная TMEV демиелинизирующая болезнь прогрессирует медленнее, чем EAE. Кроме того, гуморальный ответ, по-видимому, гораздо сильнее при TMEV-индуцированной демиелинизации и при MS, чем при EAE [104 ].
ЯПОНСКИЙ МАКАКОВЫЙ ЭНЦЕФАЛОМИЕЛИТ
Недавно был опубликован интересный отчет о спонтанном заболевании ЦНС, напоминающем МС у японских макак [ 105 ]. Болезнь, японский макак-энцефаломиелит (JME), появилась в Орегонском национальном исследовательском центре приматов через 21 год после создания колонии. Axthelm et al . [ 105] сообщили, что заболевание, как правило, поражает от 1 до 3% колонии каждый год с момента наблюдения первоначального случая. Клинические симптомы JME включают паралич, атаксию и глазной моторный парез. Обычно это заболевание встречается у молодых взрослых приматов, но были также замечены случаи молоди и пожилых животных. Хотя первоначальное начало болезни часто бывает тяжелым и животные JME обычно не могут выздороветь, несколько животных выздоровели и были снова помещены в колонию. Все замененные животные с тех пор имели рецидивы. Патологически, животные с JME имеют многоочаговые области демиелинизации и олигодендроглиоза вместе с некоторой потерей аксонов. В пораженных областях, включая головной мозг, мозжечок, ствол мозга и спинной мозг, наблюдалась клеточная инфильтрация макрофагов и лимфоцитов.
Интересно, что когда повреждения белого вещества от животных с JME культивировали над первичными фибробластами резуса, был выявлен инфекционный агент. При электронно-микроскопическом анализе он проявлялся как герпесвирус и был дополнительно идентифицирован при анализе последовательности как новый гамма-2 герпесвирус, называемый JM rhadinovirus (JMRV). Это наиболее близко связано с rhadinovirus макака резус (RRV). Чтобы доказать причинно-следственную связь, необходимы дальнейшие исследования. Интересно, что JMRV был выделен из активных поражений ЦНС у 5 различных макак с JME, но не из нормально появляющегося белого вещества от макак с JME или без него. Хотя JMRV связан с JME, пока еще ничего не известно о распространенности JMRV и его биологии или возможных патогенетических механизмах, ассоциирующих этот вирус с JME. В итоге,
МАРМОСЕТ КАК МОДЕЛЬ ИНДУЦИРОВАННОЙ НЕВРОЛОГИЧЕСКОЙ БОЛЕЗНИ ВГЧ-6
Мышиный EAE имеет несколько различий по сравнению с человеческим MS. Общие мартышки более тесно связаны с людьми с точки зрения генетики и иммунологии [ 106 ]. Другое важное преимущество использования обычных мартышек в исследованиях EAE заключается в том, что поражения головного мозга у мартышек EAE можно визуализировать с помощью техник МРТ, которые используются в клинических условиях. EAE может быть индуцирован гомогенатом белого вещества, миелиновыми белками или миелиновыми пептидами вместе с адъювантом.
HHV-6 использует CD46 в качестве клеточного рецептора для проникновения вируса в клетку. Поскольку у мышей отсутствует эта молекула, HHV-6 не вызывает инфекции у мышей. Трансгенные мыши, экспрессирующие CD46, сталкивались с трудностями при поддержке инфекции HHV-6, что может указывать на наличие других корецепторов, также не экспрессируемых у мышей. Тем не менее, обычные мартышки экспрессируют CD46 и способны поддерживать инфекцию HHV-6. Возможная роль ВГЧ-6 не только при РС, но и в более общем плане при неврологических заболеваниях, таких как эпилепсия височной доли [ 107 , 108 ] и энцефалит [ 109], усиливает потребность в модели животного для этого вируса. Как уже упоминалось, мартышка также будет идеальной моделью животного, поскольку МРТ может контролировать их мозг. Сообщалось, что HHV-6A, но не HHV-6B, вызывает неврологическое заболевание у мартышек (Genain et al ., 2008, Baltimore, 6- я Международная конференция по HHV-6 & 7). Также было показано, что путь заражения HHV-6 оказывает различное влияние на иммунный ответ и персистенцию вируса у мартышек (Leibovitch et al ., 2011, Amsterdam, ECTRIMS). Мы надеемся, что достижения в этой области помогут прояснить роль HHV-6 в заболевании, а также понять основы биологии и иммунологии, связанные с инфекцией HHV-6.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ С ПРОТИВОВИРУСАМИ В MS
Ясно, что биомаркеры будут необходимы для мониторинга прогрессирования заболевания РС и выбора пациентов с РС для медикаментозной терапии. Течение заболевания MS непредсказуемо, и различные прогрессии заболевания между пациентами затрудняют разработку клинического испытания. Следовательно, очевидно, что необходимы лучшие методы стратификации пациентов. Например, может быть, что только часть пациентов может получить пользу от противовирусной терапии, что подчеркивает роль мониторинга вирусных маркеров до, во время и после антивирусной терапии при МС в дополнение к клиническим маркерам, таким как МРТ, и возникновению рецидивов. , Кроме того, возможно, что ассоциированная вирусная инфекция возникает за годы до клинического начала заболевания, и, таким образом, противовирусная терапия не приносит пользы при РС. Однако, если вирусная инфекция связана с рецидивами,
Было проведено несколько противовирусных клинических испытаний при РС с использованием антигерпесвирусных препаратов. Исследования, опубликованные Bech et al ., [ 110 ] в Скандинавии и Friedman et al ., [ 111 ] в США, оценивали эффект терапии валацикловиром, пероральной формой ацикловира, в рандомизированных, двойных слепых, плацебо-контролируемых исследованиях в РС. Первичной конечной точкой в скандинавском исследовании было количество новых активных МРТ-видимых поражений в течение 24 недель лечения и прогрессирование заболевания в американском исследовании. Оба исследования не смогли достичь первичных конечных точек. Однако Бех и другие [ 110] обнаружили в анализе подгрупп, что лечение валацикловиром было связано с уменьшением количества новых активных поражений у пациентов с высокой активностью МРТ, определяемой более чем одним активным поражением на исходном уровне. Фридман и другие [ 111 ] пришли к выводу, что в тяжелой клинической категории были отмечены тенденции (но не статистически значимые) к эффекту препарата по сравнению с плацебо. Следует отметить, что ацикловир не эффективен против HHV-6 in vitro [ 112 ] или in vivo [ 42].]. Если бы активный HHV6 действительно присутствовал только в подгруппе пациентов с РС, то ацикловир не был бы препаратом выбора. Антивирусные клинические испытания могут быть лучшим (единственным) способом решения вопроса о том, играют ли вирусы роль при РС, если вирус активен во время течения заболевания РС. Однако, чтобы доказать или опровергнуть эту гипотезу, нам нужны хорошо разработанные эффективные противовирусные клинические испытания с безопасными, эффективными и проникающими в ЦНС противовирусными препаратами. Будущие исследования должны включать вирусологическую и иммунологическую стратификацию пациентов до начала терапии для оценки клинических и лабораторных результатов [ 113 ].
ОТКРЫТИЕ ПАТОГЕНОВ В MS
До недавнего времени большинство усилий по эпиднадзору и обнаружению патогенных микроорганизмов в значительной степени основывались на предварительных знаниях нуклеотидной последовательности известных агентов [ 114 ]. Предыдущие методики амплифицировали последовательности-мишени с использованием известных последовательностей праймеров с конкурентной ПЦР и последующим анализом микрочипов, который затем направляет поиск конкретного рассматриваемого агента [ 115 ]. Эта стратегия принимает очевидный уровень предвзятости при поиске патогенных микроорганизмов в качестве возбудителей болезни и не позволяет идентифицировать новые патогенные микроорганизмы и те, которые значительно отличаются от своих родственных предков из-за отсутствия отжига определенной последовательности праймера [ 114 ].
В течение последних нескольких десятилетий были разработаны амплификации нуклеиновых кислот, независимые от последовательности. Целью этих методов является амплификация последовательностей ДНК или РНК, которые обнаруживаются только в пораженных образцах, или в гораздо более высоких уровнях из пораженных образцов по сравнению со здоровой тканью, и дальнейшая идентификация этих последовательностей. Действительно, последовательности HHV-6 были обнаружены в ткани мозга МС с использованием несмещенной методики, называемой репрезентативным дифференциальным анализом, которая представляет собой метод вычитания на основе гибридизации для идентификации дифференциальных фрагментов ДНК между образцами [ 7 ]. Это один из способов выявления «новых» инфекционных агентов, которые могут быть связаны с РС. Другие подходы к выявлению новых инфекционных агентов при РС включают использование патогенных микрочипов [ 116] или секвенирование с помощью платформ секвенирования следующего поколения [ 117]. Оба эти метода были очень успешными в выявлении новых вирусов в здоровых и больных образцах. Несмотря на очевидную силу этих новых методов идентификации новых патогенов, идентификация новых вирусов оказалась более успешной при острых заболеваниях при активной репликации вируса, таких как геморрагические инфекции или инфекции верхних дыхательных путей. Напротив, РС является хроническим заболеванием ЦНС, которое имеет значительные ограничения; (i) если вирусная инфекция является пусковым механизмом рассеянного склероза, то, скорее всего, это персистирующая (или латентная) инфекция низкого уровня (ii) выбор подходящего материала образца для использования при обнаружении патогена при рассеянном склерозе затруднен, поскольку ткани мозга обычно не могут быть получены в начале заболевания. Попытки идентифицировать возможные триггеры должны включать активные поражения, в которых триггерный агент, скорее всего, все еще будет присутствовать.
ЗАКЛЮЧИТЕЛЬНЫЕ ЗАМЕЧАНИЯ
В этом обзоре мы обсудили роль инфекционных агентов, главным образом вирусов, при РС. Несмотря на доказательства связи между РС и несколькими вирусами, на сегодняшний день не доказано, что ни один вирус является причиной этого неврологического заболевания. В последнее время убедительные доказательства были сосредоточены на членах семейства герпесвирусов, а именно EBV и HHV-6. Поскольку эти вирусы распространены повсеместно, это создает уникальные проблемы в установлении причинно-следственной связи с этим (или любым) заболеванием. Выделение предполагаемого агента из ткани болезни MS, такой как активные бляшки в ЦНС, и усиление гуморального и клеточного иммунного ответа на эти вирусы в периферической крови являются сильными аргументами в поддержку этих вирусов как триггеров в процессе болезни MS. Наше недавнее обнаружение специфических для герпесвирусов OCBs у пациентов с РС и создание новой модели инфекции, не относящейся к приматам HHV-6, также подтверждают, что эти вирусы могут играть роль в патогенезе этого заболевания. В конечном счете, только с помощью хорошо контролируемых испытаний противовирусного лечения можно установить причинное или косвенное воздействие, которое эти вирусы оказывают на РС.
Подтверждения
Мы хотели бы поблагодарить Анну Абрамс за помощь в подготовке этого обзора.
СОКРАЩЕНИЯ
| APC | Антигенпрезентирующая клетка |
| ЦНС | Центральная нервная система |
| CSF | Спинномозговая жидкость |
| ОНА | Ранний антиген |
| EAE | Экспериментальный аутоиммунный энцефалит |
| EBER | EBV-кодированная РНК |
| EBNA | EBV ядерный антиген |
| EBV | Вирус Эпштейна-Барра |
| HAM / TSP | HTLV-1-миелопатия / тропический спастический парапарез |
| HERV | Эндогенный ретровирус человека |
| ВГЧ-6 | Герпесвирус человека 6 |
| HSV-1 | Вирус простого герпеса 1 |
| HTLV | Т-клеточный лимфотропный вирус человека |
| ЮМЭ | Энцефаломиелит японской макаки |
| JMRV | Японский макак-хадиновирус |
| LMP-1 | Латентный мембранный белок 1 |
| MHC | Главный комплекс гисто-совместимости |
| MBP | Миелин основной белок |
| MOG | Миелиновый олигодендроцит гликопротеин |
| MSRV | MS связанный ретровирусный элемент |
| NAWM | Нормально появляющееся белое вещество |
| OIND | Другие воспалительные неврологические заболевания |
| ОНД | Другие неврологические заболевания |
| РВМС | Мононуклеар периферической крови |
| PLP | Протеолипидный белок |
| PML | Прогрессирующая мультифокальная лейкоэнцефалопатия |
| RDA | Анализ представительских разностей |
| RRV | Макаки-резус |
| ßPea | Подострый склерозирующий панэнцефалит |
| TLR | Toll-подобный рецептор |
| TMEV-IDD | Вирус мышиного энцефаломиелита, вызванный вирусом демиелинизирования |
| VCA | Вирусный капсидный антиген |
| ВВО | Ветряная оспа — вирус Зостера |












