Особенности
Пациенты c РС придерживались однолетней диеты на растительной основе с очень низким содержанием жира.•
Продолжительность исследования и ограничение объема выборки МРТ, рецидив и инвалидность интерпретации данных.•
Пациенты группы диеты испытали улучшения в усталости РС.•
Диетическое увеличение веса и липидное улучшение могут дать долгосрочные преимущества при РС.
Аннотация
Роль, которую диетические вмешательства могут играть в лечении рассеянного склероза (РС), представляет огромный интерес среди пациентов и исследователей, но данные, оценивающие это, ограничены. Возможные эффекты растительного диетического вмешательства с очень низким содержанием жира на прогрессирование, связанное с рассеянным склерозом, и активность заболевания, измеренную с помощью визуализации мозга и симптомов, связанных с рассеянным склерозом, не были оценены в рандомизированном контролируемом исследовании . Несмотря на использование модифицирующих терапию заболеваний (ПИТРС), низкое качество жизни (QOL) у пациентов с РС может быть значительной проблемой, так как усталость является одним из распространенных симптомов инвалидности. Эффективные варианты лечения от усталости остаются ограниченными. Появляющиеся данные свидетельствуют о диете и факторах риска сосудистых заболеваний, включая ожирение и гиперлипидемию может влиять на прогрессирование заболевания РС и улучшить качество жизни.
Цели
Оценить приверженность, безопасность и влияние растительной диеты с очень низким содержанием жира (диета) на МРТ головного мозга , клинические [рецидивы РС и инвалидность, индекс массы тела (ИМТ)] и метаболические (липиды и инсулин крови) результаты, QOL [Краткая форма-36 (SF-36)] и усталость [Шкала серьезности усталости (FSS) и Модифицированная шкала усталостного воздействия (MFIS)] в РС с рецидивирующей передачей (RRMS).
методы
Это было рандомизированное контролируемое слепое исследование, продолжавшееся один год, с 61 участником, отнесенным либо к группе диет (N = 32), либо к группе ожидания (контроль, N = 29).
Полученные результаты
Средний возраст (годы) [Контроль — 40,9 ± 8,48; Диета — 40,8 ± 8,86] и средняя продолжительность заболевания (годы) [Контроль — 5,3 ± 3,86; Диета-5.33 ± 3.63] была сопоставима между двумя группами. Была небольшая разница между двумя исследовательскими группами в базовом среднем значении расширенной шкалы статуса инвалидности (EDSS) [Контроль-2,22 ± 0,90; Diet-2,72 ± 1,05]. Восемь предметов сняли (Диета, N = 6; Контроль, N = 2). Приверженность к исследуемой диете, основанной на ежемесячном вопроснике о частоте приема пищи (FFQ), была превосходной, в группе диеты была отмечена значительная разница в общем потреблении калорий в жире по сравнению с контрольной группой [общее потребление жиров / общее количество калорий в среднем ~ 15% (диета) по сравнению с ~ 40% (контроль). Две группы не показали различий в МРТ головного мозга результаты, количество рецидивов РС или инвалидность в 12 месяцев. В группе диеты отмечалось улучшение через шесть месяцев холестерина липопротеинов низкой плотности(= -11,99 мг / дл;р= 0,031), общего холестерина(= -13,18 мг / дл;р= 0,027) и инсулина (= -2,82). мг / дл;р= 0,0067), среднемесячное снижение ИМТ (показатель = -1,125 кг / м2 в месяц;р<0,001) и утомляемость [FSS (показатель = -0,0639 баллов / месяц;р= 0,0010); MFIS (ставка = -0,233 балла / месяц;р= 0,0011)] в течение 12-месячного периода.
Выводы
Несмотря на то, что растительная диета с очень низким содержанием жира хорошо соблюдалась и переносилась, это не привело к значительному улучшению МРТ головного мозга, частоты рецидивов или инвалидности, как оценивали по шкале EDSS у субъектов с RRMS в течение одного года. Группа диеты, однако, показала значительное улучшение показателей усталости, ИМТ и метаболических биомаркеров. Исследование было направлено на выявление только очень значительных воздействий на активность МРТ, поэтому нельзя исключать меньшие, но клинически значимые эффекты. Диетическое вмешательство дало положительный эффект на самоутверждаемый результат усталости, но эти результаты следует интерпретировать осторожно, поскольку контрольная группа из списка ожидания может не полностью контролировать эффект плацебо, и между группами наблюдался дисбаланс по баллам усталости. , Если поддерживается, улучшается липидный профиль ИМТ может дать долгосрочную пользу для здоровья сосудов. Для лучшего понимания долгосрочной пользы для здоровья от этой диеты необходимы более длительные исследования с большими размерами выборки.
Ключевые слова
Рассеянный склерозРацион питанияОбезжиренныйУсталостьМагнитно-резонансная томография
1 . Введение
Роль диеты в ослаблении тяжести рассеянного склероза (РС) долго обсуждалась, но все еще остается мало соответствующих исследований. Наблюдательные исследования д-ра Роя Свонка, опубликованные в период с 1953 по 2003 год, позволили предположить, что у людей, соблюдающих диету с низким содержанием общего и насыщенного жира , значительно снижается активность и заболеваемость РС, а также увеличивается выживаемость по сравнению с теми, кто этого не делал ( Swank, 1953 , Swank and Goodwin, 2003 , Swank, 1970 ). Диета Суонка, последняя опубликованная в 1987 году, остается популярной среди пациентов с РС. Однако этот подход к лечению РС никогда не подвергался хорошо контролируемому клиническому испытанию.
Предполагаемый значительный клинический эффект диеты Суонка с низким содержанием жиров привел к нашей гипотезе о том, что растительная диета с очень низким содержанием жира может оказывать большое влияние на активность МРТ. Мы провели пилотное исследование, чтобы изучить переносимость и потенциальные преимущества диеты на основе растительного сырья с очень низким содержанием насыщенных жиров, за которой в течение 12 месяцев следили люди с ремиттирующим рассеянным склерозом (RRMS), причем основной конечной точкой была активность МРТ головного мозга.
2 . методы
Это исследование было направлено на то, чтобы определить, могут ли люди с РС придерживаться растительной диеты с очень низким содержанием жира (диета), и изучить ее влияние на МРТ головного мозга и другие специфические для заболевания РС меры и метаболические меры. Интересующие результаты включали 1) соблюдение диеты, безопасность и переносимость, 2) изменения в МРТ головного мозга , клиническую активность РС, утомляемость и качество жизни (QOL) и 3) липиды крови , инсулин и высокочувствительный С-реактивный белок (hs-CRP) у тех, кто был рандомизирован в диету по сравнению с группой, включенной в список ожидания (контроль). Институциональный контрольный совет Орегонского университета здоровья и науки (OHSU) утвердил протокол исследования. Письменное информированное согласие было получено от всех участников исследования. Исследование было зарегистрировано на www.clinicaltrials.gov (NCT00852722).
2.1 . дизайн
Исследование представляло собой одноцентровое слепое клиническое исследование с участием пациентов, рандомизированных в группу диеты или контрольной группы. После рандомизации участники исследования, заботливые неврологи (VY, DB), координаторы исследования и диетолог знали групповые задания. Слепыми экспертами в исследовании были рентгенологи, изучавшие МРТ в MS / MRI Research Group в Университете Британской Колумбии, EDSS оценивающие неврологов и статистик, анализирующих первичные и вторичные результаты. Рандомизация была стратифицирована в зависимости от использования ПИТРС, причем случайные блоки 2 и 4 генерировались с использованием функции генератора случайных чисел Excel . Субъекты считались находящимися «на лечении», если они принимали одобренный Управлением по контролю за продуктами и лекарствами (FDA) ПИТРС(интерферон бета-1a, интерферон бета-1b,глатирамера ацетат (или натализумаб) в течение 6 месяцев после скрининга или «вне лечения», если они не получали ПИТРС в течение 6 месяцев после скрининга.
2.2 . участники
Субъекты отбирались из Центра РС OHSU и посредством национальной рекламы Национального общества РС. Критерии включения были следующими: RRMS (критерии Макдональда ( McDonald et al., 2001 , Polman et al., 2011 )); МРТ аномалии головного мозга в соответствии с РС; Длительность РС <15 лет; EDSS 6,0 (Курцке , 1983 ); возраст 18–70 лет; документированный клинический рецидив или активное заболевание с помощью МРТ в предыдущие 2 года; базовый рацион с более чем 30% от общего суточного потребления калорий от жиров , как это определено в самоуправляемых питания Quest® Блок 2005 Питание Частота вопросника (FFQ) ( Block и др., 1994). Субъектам было разрешено находиться на ПИТРС во время испытания, если они находились на стабильной дозе в течение по меньшей мере 6 месяцев до скрининга и поддерживали стабильное лечение в течение всего исследования. Мы исключили субъектов, которые были беременны или кормили грудью, а также лиц с любым клинически значимым обострением РС или системным применением кортикостероидов в течение 30 дней после скрининга.
2.3 . Процедура
После зачисления испытуемые в группе диеты проходили обучение на диете в Санта-Розе, штат Калифорния, по программе McDougall ( Anonymous, 2014 ), а затем в течение 12 месяцев. Контрольная группа не получала диеты в начале исследования и продолжала придерживаться обычной диеты на протяжении всего исследования. После окончания исследования через 12 месяцев испытуемым контрольной группы бесплатно предложили 10-дневное обучение диете. Исследование потребовало 6 посещений клиники в OHSU. Предварительный экран телефона был использован для оценки интереса и права на участие. Исходное посещение включало согласие, забор крови [общий анализ крови (CBC), полный метаболический анализ (CMP), витамин B-12 (B12), тиреотропный гормон (TSH); профиль липидов натощак , сывороточный инсулин и hs-CRP (Liposcience, Inc.®)], тест на беременность, если он указан, показатели жизненно важных функций, история болезни, физическое обследование, EDSS, функциональный композит РС (MSFC) ( Cutter et al., 1999), FFQ, шкала тяжести усталости (FSS) (Krupp et al., 1989), РС QOL Inventory (MSQLI) (Cella et al., 1996), Beck Depression Inventory (BDI), Экспресс-оценка физической активности (RAPA) (Topolski et al., 2006 ) , МРТ головного мозга и проверка сопутствующих лекарств. После базового визита субъекты, рандомизированные в группу диеты, проходили обучение диете, а контрольная группа — семинар по обучению физическим упражнениям, проводимый лицензированным физиотерапевтом. В течение трех недель после базового визита. Последующие посещения проводились в месяцы 1, 3, 6, 9 и 12 и включали в себя физические обследования, MSFC, FFQ, FSS, MSQLI, BDI, RAPA, проверку сопутствующих лекарств и отчеты о побочных эффектах (AEs). EDSS был завершен через 3, 6, 9 и 12 месяцев. Биомаркеры сыворотки натощак, включая липидный профиль, были повторно измерены через 6 и 12 месяцев. Визит на выход через 12 месяцев включал CBC, CMP, B12, TSH, МРТ головного мозга и проверку на ослепление.
2.4 . Учебная диета с очень низким содержанием жира и растений
Диета исследования была основана на крахмалистых растительных продуктах (бобы, хлеб, кукуруза, паста, картофель, сладкий картофель и рис с добавлением фруктов и некрахмалистых овощей). Приблизительно 10% калорий были получены из жиров, 14% из белков и 76% из углеводов ( Anonymous, 2014 ). Мясо, рыба, яйца, молочные продукты и растительные масла (такие как кукурузное и оливковое масло) были запрещены.
Мы использовали ежемесячный FFQ и телефонный контакт для оценки соблюдения диеты. Субъекты считались приверженцами диеты, если они потребляли 20% или менее калорий из жира, по крайней мере, 80% времени в течение исследования. Дополнительное консультирование в клинике или по телефону квалифицированным диетологом использовалось, чтобы помочь предмету приверженности. Субъектам диетической группы было разрешено обсуждать диетические проблемы с другими субъектами диетической группы или с неослепленными членами исследовательской группы через безопасную интерактивную доску обсуждений или личные встречи. Неослепленные члены исследовательской группы задокументировали всю переписку между субъектами. Субъекты, у которых возникли проблемы с соблюдением диеты, не были исключены или дисквалифицированы после получения согласия.
2.5 . Упражнение
Субъектам обеих групп было рекомендовано, по крайней мере, пять минут в неделю выполнять упражнения с умеренной интенсивностью не менее 30 минут, как рекомендовано Американской кардиологической ассоциацией ( Anonymous, 2014 ). Физическая активность (интенсивность, продолжительность и частота) и приверженность были оценены с использованием вопросника RAPA, заполненного при каждом посещении клиники. Приверженность к физической нагрузке была определена как «постоянно активная более 30 минут (оценка RAPA> 5) в течение по меньшей мере 80% посещений клиники».
2.6 . Результаты
Цели исследования оценивались с помощью утвержденных вопросников или объективных показателей ( Приложение A ).
МРТ проводилось в OHSU, а слепой МРТ-анализ проводился исследовательской группой РС / МРТ в Университете Британской Колумбии. Для каждого посещения МРТ были получены следующие последовательности в осевой плоскости: трехмерное градиентное эхо-сигнал T1, взвешенная плотность протонов (PD) / T2, восстановление с инверсией с ослаблением жидкости (FLAIR) и T1 до и после гадолиниевого усиления. Результаты МРТ включали: а) количество новых очагов Т2 за 12 месяцев, б) количество очагов, усиливающих гадолиний Т1, на исходном уровне и через 12 месяцев, в) количество увеличивающихся очагов Т2 за 12 месяцев, г) изменение (%) объема очага Т2 от исходного уровня до 12-го месяца и e) изменение (%) объема мозга от исходного уровня до 12-го месяца [Использование SIENA с трехмерным градиентным эхо-сканированием T1 и паренхиматозной долей мозга (BPF) со сканированием PD / T2].
2.7 . Размер выборки и статистический анализ
Исследование было основано на использовании количества новых Т2-МРТ- поражений головного мозга, которые развиваются в течение года, в качестве основного результата на основе пилотного набора данных из 22 субъектов, участвующих в клиническом исследовании поведенческого вмешательства для снижения стресса при РС ( Mohr et al., 2012 ). , Три размера эффекта «маленький», «средний» и «большой», соответствующие сокращению числа субъектов с новыми поражениями T2 на 44%, 78% и 89% соответственно, были смоделированы с использованием начальной загрузки. Согласно исследованию, проведенному Суонком, у субъектов, соблюдающих диету с низким содержанием жира, частота рецидивов снизилась на 70% в первый год (базовый средний показатель рецидивов составил 1,0 на пациента в год, а в течение первого года после диета ( Суонк, 1970)). Основываясь на значительном уменьшении рецидивов РС, о которых сообщал Свонк, мы выдвинули гипотезу о снижении образования новых Т2-образований на 90% и, таким образом, значительный размер эффекта был вероятным. При двустороннем значении, установленном на 0,05 и мощности 80%, при условии наибольшего размера эффекта, соответствующего снижению на 90%, после корректировки на 10% потерь на последующее наблюдение и 10% несоблюдения, мы определили требуемый размер выборки быть 27 предметов в группе.
В основном статистическом анализе использовались линейные смешанные модели в схеме «намерение лечить», чтобы определить влияние диеты на результаты, представляющие интерес. Исследовательский анализ данных включал в себя простую продольную регрессию исходных переменных на основе распределения рук и сравнения исходных демографических показателей между группами с использованием t- тестов Стьюдента. Окончательные сравнения были скорректированы с учетом возраста, пола и тяжести заболевания (оценка по шкале EDSS). С учетом большого числа переменных отклика и множественных сравнений с использованием такой же дизайн модели регрессии, коррекция Holm-Sidak ступенчато был применен к наборам модельных р -значения внутри каждого из основных результатов доменов (физических результатов, в сыворотке крови биомаркеров, МРТ).
Целостность модели оценивали с использованием стандартных диагностических процедур для моделей регрессии со смешанным эффектом. Потенциальные выбросы и точки воздействия были определены с использованием расстояния Кука и визуального осмотра остаточных участков с выбросами, оцененными на предметной основе. Норма набора результатов оценивалась с использованием квантильных-квантильных графиков, сравнивая наблюдаемые квантили вероятности остатков модели с ожидаемыми квантилями функции кумулятивного распределения нормальной вероятности. Однородность дисперсии ошибок оценивали визуально с использованием графиков остатков модели по сравнению с прогнозируемыми ответами. Все диагностические процедуры были выполнены итеративно для проверки согласованности и надежности скорректированных моделей.
На основании предварительных анализов связь между диетой и усталостью (MFIS) была дополнительно исследована на предмет причинно-следственной связи из-за изменений ИМТ, общего холестерина в сыворотке и уровней инсулина . Мы использовали модели для посредничества и исхода из описанных выше многомерных моделей линейной регрессии . В анализе использовалось назначение руки в зависимости от времени в качестве независимых переменных, ИМТ, уровень холестерина и инсулина в качестве медиаторов и показатель MFIS в качестве опосредованного результата. Оценка дисперсии среднего причинного посредничества была сделана с использованием начальной загрузки с 10000 итераций выборки на модель, чтобы гарантировать устойчивость. Откорректированные множественным сравнением p- значения указаны в тексте. Все анализы были выполнены с использованием R 3.1 ( анонимный) с дополнительной полезностью из влияния ‘lme4’ ( Bates et al., 2014 ), ‘. Пакеты « ME» ( Nieuwenhuis et al., 2012 ), «ggplot2» ( Wickham, 2009 ) и «mediation» ( Tingley et al., 2014 ).
3 . Полученные результаты
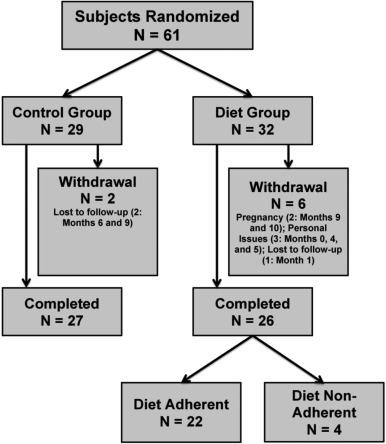
Зачисление испытуемых началось в июле 2009 года, а последний испытуемый завершил исследование в марте 2013 года. Шестьдесят один субъект был рандомизирован либо с диетой (N = 32), либо с контрольным (N = 29) вмешательством. Сорок четыре процента (27/61) участников исследования проживали за пределами Орегона и ездили в OHSU для ознакомительных поездок ( Приложение B ). Среди тридцати четырех субъектов из Орегона двадцать пять были пациентами, направленными из Центра РС OHSU. Восемь субъектов сняли (Диета N = 6; Контроль N = 2). Детали расположения предмета представлены на рис. 1 . Остальные предметы завершили исследование.
Таблица 1 описывает базовые характеристики участников исследования. Большинство субъектов находились на ПИТРС с 24/32 (75%) в группе диеты и 20/29 (69%) в контрольной группе, принимающей ПИТРС. Группы были схожими на исходном уровне, за исключением значительных различий в утомляемости, EDSS и гадолиния, усиливающих поражения при МРТ головного мозга . Группы также имели аналогичное диетическое потребление жиров. На исходном уровне субъекты диетической группы имели 1) большую утомляемость [модифицированная шкала воздействия усталости — короткая версия (MFIS) и FSS], чем субъекты контрольной группы (FSS – контроль: 3,92 ± 1,51, диета: 4,89 ± 1,39; t = -3,56, р <0,001; MFIS – Контроль: 6,10 ± 4,52, диета: 9,87 ± 3,47; t = -2,59, р = 0,014), 2) более высокие баллы по шкале EDSS.(Контроль: 2,22 ± 0,90, Диета: 2,72 ± 1,05, t = 2,36, р = 0,043) и 3) более высокая доля с усилением поражений (Контроль: 2/29 (6,9%), Диета, 9/23 (28%) ; р = 0,045) и большее среднее число усиливающих поражений (W = 259; р = 0,037). Не было никаких существенных различий между диетой и контрольной группой по частоте рецидивов перед зачислением, ИМТ, общему холестерину, ЛПНП, уровням инсулина натощак и общему бремени Т2 головного мозга. Базовые различия контролировались в последующих анализах.
Таблица 1 . Исходная демография участников исследования.
| Демографические характеристики | контроль | Рацион питания |
|---|---|---|
| (Среднее ± стандартное отклонение) | N = 29 | N = 32 |
| Возраст (лет) | 40,9 ± 8,48 | 40,8 ± 8,86 |
| Пол | ||
| Женский, % | 89,7 | 96,9 |
| Мужчина, % | 10,3 | 3,10 |
| Гонка — нет. (%) | ||
| кавказец | 25 (86,2) | 26 (81,25) |
| афроамериканец | 4 (13,8) | 2 (6,25) |
| Испанец / выходец из Латинской Америки | — | 2 (6,25) |
| Другой | — | 2 (6,25) |
| EDSS оценка * | 2,22 ± 0,90 | 2,72 ± 1,05 |
| Длительность заболевания (годы) | 5,30 ± 3,86 | 5,33 ± 3,63 |
| Рецидивы в предыдущие 2 года | 1,38 ± 0,73 | 1.69 ± 1.33 |
| Время с момента последнего рецидива (месяцы) | 11,7 ± 5,82 | 12,0 ± 6,92 |
| ПИТРС | ||
| Никто | 9 | 8 |
| Интерферон бета-1а | 9 | 8 |
| Интерферон бета-1b | 1 | 3 |
| Глатирамер ацетат | 10 | 12 |
| Natalizumab | 0 | 1 |
| Артериальное давление | ||
| Систолическое (мм рт.ст.) | 127 ± 16.1 | 124 ± 14,1 |
| Диастолический (мм рт. Ст.) | 75,4 ± 11,0 | 74,9 ± 11,3 |
| ИМТ (кг / м 2 ) | 28,4 ± 6,76 | 29,3 ± 7,42 |
| Оценка МФИС * | 6.10 ± 4.52 | 9,87 ± 3,47 |
| Оценка ФСС * | 3,92 ± 1,51 | 4,89 ± 1,39 |
| Инсулин (мг / дл) | 9,88 ± 6,09 | 12,7 ± 10,5 |
| Общий холестерин (мг / дл) | 172,8 ± 26,5 | 169,7 ± 34,9 |
| Холестерин ЛПНП (мг / дл) | 114,0 ± 31,0 | 101,1 ± 34,1 |
| Процент потребления калорий из: | ||
| Жир | 39,67 ± 4,92 | 37,05 ± 4,54 |
| Насыщенный жир | 11,51 ± 2,15 | 10,58 ± 2,48 |
| белка | 16,59 ± 3,13 | 15,31 ± 2,88 |
| Углеводы * | 43,82 ± 5,16 | 47,93 ± 5,87 |
| МРТ Т2 бремени болезни (мм 3 ) | ||
| Среднее ± SD | 2643,26 ± 2578,83 | 4959,97 ± 7279,03 |
| Медиана {IQR} | ||
| 1620 {1132,3100} | 2662 {1418,4152} | |
| Усиление поражений МРТ ** | ||
| Среднее ± SD | 0,11 ± 0,42 | 0,78 ± 2,23 |
| Медиана {IQR} | 0 {0,0} | 0 {0,1} |
| N (%) Участники с исходными усиливающими поражениями *** | 2/29 (6,9) | 9/32 (28) |
| МРТ БПФ | 0,82 ± 0,04 | 0.83 ± 0.03 |
EDSS = расширенная шкала состояния инвалидности, MFIS = модифицированная шкала усталостного воздействия — короткая версия, FSS = шкала тяжести усталости, BMI = индекс массы тела, LDL = липопротеин низкой плотности, ПИТРС= модифицирующая болезнь терапия, BPF = паренхиматозная фракция головного мозга, sd = стандарт отклонение.*
Различия в средней руке наблюдаются на исходном уровне к t- тесту, р <0,05.**
Различия в средней руке, наблюдаемые в начале исследования Уилкокса, р <0,05.***
Точный критерий Фишера р = 0,045.
3.1 . Соблюдение, безопасность и переносимость диеты
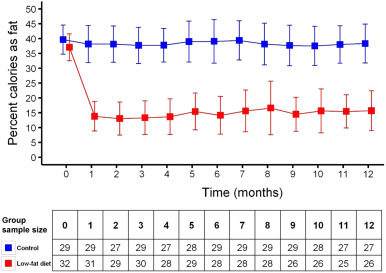
Значительные и устойчивые изменения в рационе наблюдались у большинства субъектов диетической группы в течение 12-месячного периода исследования, измеренного по изменениям жировых калорий на FFQ ( рис. 2 ). Важно отметить, что 85% (22/26) субъектов диетической группы придерживались диеты в течение 12-месячного исследования (% потребления калорий в виде жира в течение 12 месяцев: среднее значение = 14,4% ± 6,13%; медианное значение = 12,8%; межквартильный диапазон [IQR = (10,6-16,7%); Рис. 2 ]. АЕ были сопоставимы между группами [76 АЕ (диета, N = 41; контроль, N = 35); Приложение C, D]. Группы имели сходную приверженность упражнениям (диета: 13/26; контроль: 12/27) и не показали различий в оценках RAPA на исходном уровне [контроли: 6,17 ± 2,70, диета: 6,0 ± 2,27; t = 0,27, р= 0,79) или через 12 месяцев (контроль: 6,97 ± 2,80, диета: 6,19 ± 3,98; t = 0,89, р = 0,38)]. Используя моделирование со смешанными эффектами, ни контрольная группа (показатель = 0,037 баллов / месяц, t = 0,79, р = 0,27), ни группа диеты (показатель = -0,081 баллов / месяц, t = -0,93, р = 0,17) не изменили свои активность (RAPA) значительно в течение 12-месячного периода обучения.
3.2 . МРТ головного мозга
После контроля базовых различий в МРТ, количество новых Т2, вновь увеличивающихся Т2, усиливающих Т1 или комбинированных уникальных активных поражений не выявило различий между двумя группами через 12 месяцев ( Таблица 2 ). Мы также не обнаружили существенных изменений между группами в бремени болезни T2 и объеме мозга (как для SIENA, так и для BPF) за 12 месяцев. Исключение не придерживающихся диеты субъектов (N = 4) не изменило результаты МРТ.
Таблица 2 . Конечные значения параметров МРТ. Средние и средние 12-месячные изменения в объемах головного мозга, бремени болезней белого вещества и объеме поражений достоверно не различались у контрольных и диетических субъектов. Подсчет различных поражений через 12 месяцев также показал отсутствие различий в патологии поражения между исследуемыми плечами и анализ был скорректирован с учетом базовых показателей. 95% доверительные интервалы для групповой разницы в средних / медианных результатах были определены для определения клинической верхней границы потенциального улучшения результатов в результате диетического вмешательства.
| МРТ объем 12 месяцев смена | Контроль (N = 27) | Диета (N = 26) | Государственный тест | 95% CI Клиническое улучшение Верхняя граница | р- значение | |
|---|---|---|---|---|---|---|
| Паренхиматозная фракция мозга | ||||||
| Среднее (SE) (контроль N = 26) | -0,00419 (0,00197) | −0,00484 (0,00194) | т = 0,24 | 0,00620 | 0,81 | |
| Медиана {IQR} | −0.004 {−0.011,0} | −0.002 {−0.0075,0.0035} | W = 326 | 0,00502 | 0,84 | |
| SIENA изменение объема мозга в% | ||||||
| Среднее (SE) | -0,129 (0,213) | -0,313 (0,226) | т = 0,59 | 0,809 | 0,56 | |
| Медиана {IQR} | −0.4 {−0.96,0.39} | −0.07 {−1.37,0.53} | W = 379 | 0,850 | 0,62 | |
| Т2 заболеваемость (мм ( Swank, 1970 )) | ||||||
| Среднее (SE) | 275,7 (151,0) | 30,5 (247,0) | т = 0,85 | 829,6 | 0,40 | |
| Медиана {IQR} | 23,7 {-104,1, 321,4} | 104,1 {−400,4, 332,6} | W = 369 | 442,5 | 0,76 | |
| % Изменения бремени Т2 | ||||||
| Среднее (SE) | 11,1 (6,02) | 10,7 (7,62) | т = 0,04 | 19,9 | 0,97 | |
| Медиана {IQR} | 1.6 {−7,18} | 7,8 {−12,19} | W = 358 | +13,9 | 0,91 | |
| Поражение патологии 12 месяцев | Контроль (N = 26) | Диета (N = 26) | Государственный тест | р- значение | ||
| Новые поражения T2 | ||||||
| Среднее (SE) | 2.04 (1.11) | 2,35 (1,19) | т = 0,19 | 2,96 | 0,85 | |
| Медиана {IQR} | 0 {0,1} | 0 {0,2} | W = 302 | 0 | 0,45 | |
| Недавно увеличенные поражения T2 | ||||||
| Среднее (SE) | 0,423 (0,243) | 0,923 (0,693) | т = 0,68 | 0,997 | 0,50 | |
| Медиана {IQR} | 0 {0,0} | 0 {0,0} | W = 325 | 0 | 0,73 | |
| Недавно T1 усиливающие поражения | ||||||
| Среднее (SE) | 0,308 (0,206) | 0,962 (0,692) | т = 0,91 | 0,821 | 0,37 | |
| Медиана {IQR} | 0 {0,0} | 0 {0,0} | W = 301 | 0 | 0,30 | |
| Новые уникальные поражения | ||||||
| Среднее (SE) | 2,46 (1,33) | 3,53 (2,19) | т = 0,42 | 4,09 | 0,68 | |
| Медиана {IQR} | 0 {0,1} | 0 {0,2.75} | W = 292 | 0 | 0,34 |
Среднее (SE) проверено с использованием t- теста; Медиана (IQR) проверена с использованием теста Вилкокса.a
Примечание: на базовом МРТ-сканировании было чрезвычайно большое поражение, которое значительно исчезло к 1 году последующего посещения. Все другие поражения для этого отдаленного субъекта были в целом стабильными между двумя сканированиями, поэтому все изменения нагрузки поражения можно отнести к этому одному очень активному разрешающему поражению.
3.3 . Клиническая активность РС (частота рецидивов и прогрессирование инвалидности)
EDSS существенно не изменился в течение учебного курса ни для одной из групп. В то время как показатели MSFC в обеих группах значительно улучшились в ходе исследования (стандартизированная скорость = 0,0211 SD в месяц; t = 3,34; p adj = 0,0046), в частности, тест на 9 отверстий (9HPT) (показатель = -0,111 баллов / месяц; t = -3,61; p adj = 0,0020) и Paced Слуховой тест последовательного добавления (PASAT) (показатель = 0,380 баллов / месяц; t = 5,20; p adj <0,001), эти улучшения не различались между группами. Пятнадцать субъектов (диета, N = 7; контроль, N = 8) имели один или несколько рецидивов во время исследования. Не было различий между группами по количеству рецидивов (χ2 = 1,04, р= 0,59) или между назначением руки и наличием хотя бы одного рецидива (χ2 = 0,00, р = 1,0). Среднее количество рецидивов за 12-месячное исследование для двух групп было одинаковым [Контроль: 0,47 (± 0,62); Диета: 0,37 (± 0,48), t = 0,58, р = 0,56).
3.4 . Усталость и качество жизни
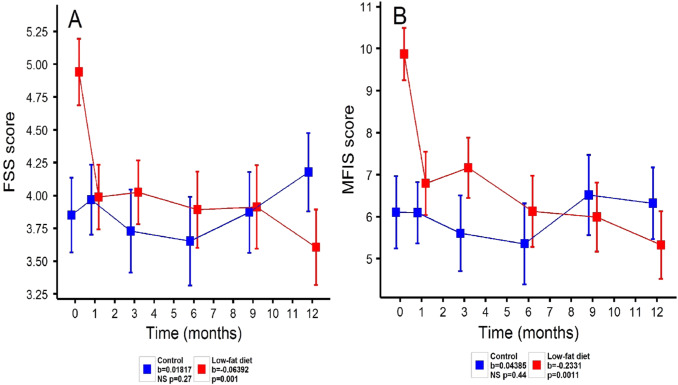
Усталость (FSS и MFIS) значительно улучшилась в группе диеты с течением времени со средним улучшением FSS на 0,06 балла / месяц и MFIS на 0,23 балла / месяц. Эти улучшения были более значительными, чем в контрольной группе, несмотря на контроль различий по базовой линии (FSS t = -3,88; p adj = 0,0010, рис. 3 A; MFIS t = -3,85; p adj = 0,0011, рис. 3 B). После полного удаления базовых значений темпы изменения MFIS (контроль: 0,0654 балла / месяц, диета: -0,112 балла / месяц; t = -2,49, p прил = 0,041) оставались значительно выше в группе диеты, чем в контрольной группе, и было тенденция к разнице в FSS (контроль: 0,0250 баллов / месяц; диета: -0,245 баллов / месяц, t = -2,37, рприл = 0,064).
Мы обнаружили тенденцию к большему улучшению умственной шкалы Short Form-36 (SF-36) в группе диеты по сравнению с контрольной группой (контроль: 0,0752 балла / месяц, диета: 0,298 балла / месяц; t = 2,19, p adj = 0,077 ), но не обнаружил улучшений в других QOL и субъективных показателях, включая шкалу болевых эффектов (PES), опросник воспринимаемого дефицита (PDQ), шкалу контроля кишечника (BWCS) и физический SF-36 .
3.5 . Изменения ИМТ, сывороточных маркеров воспаления и липидного обмена
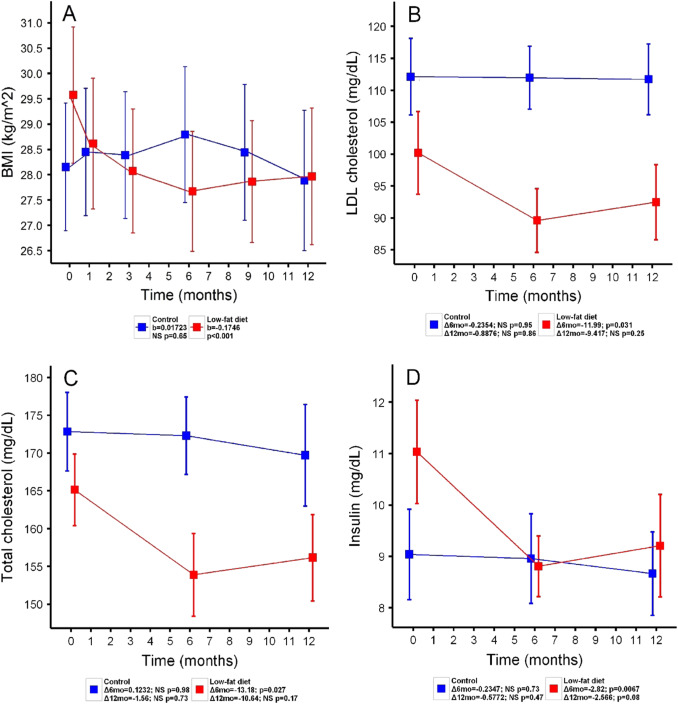
ИМТ ниже в группе диеты значительно в течение 12 месяцев учебного курса в среднем на 0,18 кг / м 2 в месяц (0,5 кг / месяц) с большей частью потери веса происходит в течение первых шести месяцев ( рис. 4 А). Этот показатель потери веса для группы диеты был значительным после коррекции для их исходного веса (t = -3,94; p adj <0,001) и был быстрее, чем для контрольной группы (контроль: 0,0172 балла / месяц; диета: -0,18 балла / месяц; t = -3,68; р прилаг. <0,001).
Несколько уровней метаболических биомаркеров сыворотки изменились в группе диеты через 6 месяцев ( рис. 4 ). Они включали снижение уровня холестерина ЛПНП (контроль: -0,235 мг / дл, диета: -11,99 мг / дл; t = -2,79; р прил = 0,031, рис. 4 B), общий холестерин (контроль: 0,123 мг / дл, диета). : -13,18 мг / дл; t = -2,88; р прил = 0,027; фиг. 4 C) и уровни инсулина натощак (контроль: -0,235 мг / дл, диета: -2,82 мг / дл; t = -3,37; р прил. = 0,0068; рис. 4D). Хотя величина эффекта этих изменений в основном сохранялась после полных 12 месяцев вмешательства, окончательные изменения при лечении по сравнению с исходным уровнем в описанных биомаркерах в группе диеты достоверно не отличались от контроля. Группа диеты показала незначительную тенденцию снижения hs-CRP через 6 месяцев по сравнению с контрольной группой (контроль: 2,20 мг / дл, диета: -2,00 мг / дл; t = -2,48, p adj = 0,059); однако измерения через 12 месяцев не отличались. Мы не обнаружили групповых различий в других биомаркерах.
3.6 . Посредничество потери веса на усталость и биомаркеры
Мы не обнаружили ассоциативной взаимосвязи между утомляемостью и уровнем ЛПНП, уровнем общего холестерина или инсулина, что позволяет предположить, что улучшение утомляемости и снижение этих биомаркеров были независимыми. Тем не менее, мы обнаружили значительную связь между диетическим вмешательством, потерей веса и усталостью от MFIS Анализ общего влияния величины диеты на улучшение утомляемости [d = -0,646; ДИ = (- 1,389; -0,163); р <0,01] выявили значительную причинную медиацию, которая произошла из-за потери веса [d = -0.201; ДИ = (- 0,386, -0,061); p <0,01], в то время как диетическое вмешательство было напрямую связано с незначимой тенденцией [d = -0,468; CI = (- 1,016, 0,044), р = 0,08]. Из общего влияния диеты на улучшение утомляемости MFIS 42,5% были связаны с потерей веса.
4 . обсуждение
В этом исследовании изучалась растительная диета с очень низким содержанием жира, поскольку предыдущие исследования, проведенные Суонком, предполагали долгосрочную пользу у людей с РС после диеты с низким содержанием жира . Основываясь на результатах Свонка, мы полагали, что возможен большой эффект воздействия на образование новых очагов поражения при МРТ головного мозга, и проводили это пилотное испытание. Текущее исследование было разработано для обнаружения очень большого влияния на новые поражения T2 на МРТ ( Swank, 1953 , Swank and Goodwin, 2003 , Swank, 1970). Мы выбрали группу «лист ожидания» в качестве контроля, поскольку мы изучали эффекты вмешательства с низким содержанием жира по сравнению со «стандартной американской диетой». В этом предварительном экспериментальном испытании мы не обнаружили различий между диетой и контрольной группой по первичному исходу образования нового Т2 в головном мозге и другими конечными точками МРТ. Кроме того, клиническая инвалидность РС, измеренная с помощью EDSS и MSFC и рецидивов, не отличалась между диетой и контрольной группой. В ходе исследования ожидалась низкая частота рецидивов в обеих группах, так как большинство пациентов получали ПИТРС. Тем не менее, это исследование показало, что диета была безопасной, большинство субъектов в группе диеты придерживались диеты с очень низким содержанием жира на растительной основе, а в группе диеты наблюдалось снижение ИМТ, сывороточного ЛПНП и общего холестерина, а также голодание уровень инсулина . В ретроспективе было слишком оптимистично подкреплять исследование, основанное на исследовании Суонка, которое было сделано до появления ПИТРС. Даже если растительная диета с низким содержанием жира может снизить активность заболевания на 90%, этот эффект будет трудно обнаружить у пациентов с ПИТРС, что значительно снижает новые поражения МРТ головного мозга и частоту рецидивов.
Хорошее соблюдение диеты в этом исследовании, вероятно, отражало эффективность 10-дневной программы обучения диете в жилых помещениях и постоянную поддержку со стороны персонала исследования и онлайн-форума. По завершении исследования большинство (25/29) субъектов контрольной группы бесплатно посещали 10-дневную программу обучения. Во время периода обучения диете субъекты в группе диеты сообщали о трудностях ограничения потребления жира , но обнаружили, что устранение продуктов животного происхождения легче. Кроме того, по мере того, как исследование продвигалось и субъекты сообщали о благоприятных изменениях в своих энергетических уровнях, они, по-видимому, становились все более мотивированными для соблюдения диеты.
Несколько проблем повлияли на набор студентов. Причины медленного набора предметов были следующими: 1) строгие критерии включения, которые допускали только людей с RRMS и признаками активного заболевания в предыдущие 2 года; 2) люди, заинтересованные в таком вмешательстве в образ жизни, были в основном клинически стабильными пациентами или пациентами с прогрессирующим РС; 3) люди были обеспокоены потреблением белка в растительной и нежирной диете; 4) временное выделение предметов для посещений, связанных с изучением; 5) пациентам, стремящимся изменить свою диету, не понравился риск быть рандомизированными в группу ожидания в течение года. В то время как будущие исследования этой и других диет должны следовать этой парадигме обучения и поддержки участников, необходимо решить проблемы с изучением набора и удержания.
Хорошо известно, что, несмотря на наличие одобренных FDA методов лечения, РС по-прежнему является заболеванием с инвалидностью ( Noseworthy et al., 2000 ), и растет интерес к пропаганде здорового образа жизни при лечении РС ( Wingerchuk and Carter, 2014 , Marrie and Hanwell, 2013 , Anonymous Wellness для людей с РС: что мы знаем о диете, 2015 ). Появляется все больше свидетельств того, что факторы риска сосудистых заболеваний, такие как гиперлипидемия , гипертония, диабет и сердечные заболевания, часто встречаются у людей с рассеянным склерозом, что, в свою очередь, может увеличить риск прогрессирования инвалидности и увеличения бремени поражения и атрофии головного мозга (Marrie et al., 2010 , Kappus et al., 2015 ). Недавнее пятилетнее исследование показало, что избыточный вес и ожирение значительно увеличивают риск прогрессирования рассеянного склероза ( Ben-Zacharia, 2015 ). Кроме того, избыточный вес или ожирение увеличивают риск развития сахарного диабета, гипертонии, гиперлипидемии и сосудистых заболеваний ( Pi-Sunyer, 1996 , Prospective Studies Collaboration et al., 2009 ). Важно отметить, что даже небольшая потеря веса на 5–10% может снизить риск развития заболеваний, связанных с ожирением ( Исследовательская группа по профилактике диабета и др., 2009 г.). Участники диетического вмешательства испытали снижение веса, ИМТ, ЛПНП и общего уровня холестерина и инсулина. Эти улучшения, вероятно, улучшат их общее состояние здоровья в долгосрочной перспективе, если они останутся на диете. Хотя это и не доказано, наблюдение того факта, что факторы риска сосудистых заболеваний могут ускорять прогрессирование РС, долгосрочное наблюдение Суонком людей с РС, которые следовали его диете с низким содержанием жиров, согласуется с этой возможностью ( Swank and Goodwin, 2003 , Swank, 1970 ).
Усталость является основной проблемой для людей с РС и ее трудно лечить ( Kos et al., 2008 ). Примечательно, что это исследование показало улучшение утомления среди участников после диетического вмешательства. Влияние активного вмешательства на утомляемость в нашем исследовании было очевидно в течение одного года. Хотя в клинических исследованиях трудно предсказать продолжительность или влияние эффекта плацебо, некоторые исследования болезни Альцгеймера предполагают, что этот эффект, скорее всего, невелик ( Wilcock et al., 2000 ). Кроме того, величина эффекта, наблюдаемого с помощью диеты в нашем исследовании, является клинически значимым 2 баллом FSS, влияющим на эффект, выходящий за пределы плацебо. Хотя сравнение между испытаниями затруднительно, в предыдущем плацебо-контролируемом испытании модафинила (Moller et al., 2011 ) в группе плацебо наблюдалось улучшение на 0,4 балла по шкале FSS. Из-за субъективного характера усталости, возможно, что улучшения произошли в результате увеличения социализации, участия в диетическом вмешательстве и ожидания выгод, которых не имела контрольная группа списка ожидания. Таким образом, наши результаты, свидетельствующие о том, что растительная диета с низким содержанием жира может снизить утомляемость, можно считать лишь очень предварительным, хотя и интересным, наблюдением, которое требует дополнительного исследования.
Недавние исследования предполагают возможную связь между более высоким ИМТ и утомляемостью при РС ( Weiland et al., 2015 ). Упражнения могут также улучшить утомляемость ( Motl and Pilutti, 2012 ), но обе группы в этом исследовании выполняли в одинаковой степени. Анализ причинно-следственного влияния в исследовании показал, что 42,5% улучшений в показателях усталости по MFIS были объяснены потерей веса. Потенциальная роль массы тела при утомляемости при рассеянном склерозе не изучена и может быть важной для пациентов с избыточным весом или ожирением. Эти данные предполагают, что в будущих исследованиях по диетическому вмешательству необходимо будет включить изокалорическую контрольную группу, которая не испытывает потери веса.
Многие люди, страдающие РС, заинтересованы в диетических вмешательствах, помогающих справиться с РС ( Yadav et al., 2006 ). К сожалению, из-за нехватки надежных исследований у неврологов мало информации, которая могла бы помочь им при составлении рекомендаций по питанию ( Yadav et al., 2014 , Farinotti et al., 2012 ). Кроме того, американские медицинские школы и учебные больницы не имеют достаточной подготовки для студентов и практиков по вопросам здорового питания и их применения в общей помощи пациентам. Мы считаем, что этот тренинг может стать важной возможностью для улучшения здоровья ( Lenders et al., 2013). Диетические исследования по своей природе трудны, так как диетические вмешательства предполагают серьезные изменения для участников, а методология — сложная, потому что, хотя оценщики могут быть слепыми, субъекты не могут, и определение соответствующей контрольной группы может быть затруднено. Тем не менее, могут быть проведены надежные клинические испытания диетических вмешательств, что иллюстрируется обширной литературой по диетическому подходу к прекращению гипертонии (DASH) ( Appel et al., 1997 ) для факторов сердечно-сосудистого риска .
5 . Вывод
Это исследование демонстрирует практическую целесообразность использования растительной диеты с очень низким содержанием жира у людей с РС. Хотя мы не увидели влияния диеты на активность заболевания РС (МРТ и клинические исследования), исследование было ограничено небольшим размером выборки, короткой продолжительностью и использованием ПИТРС среди большинства участников. В течение 12 месяцев диета была безопасной, снижала ИМТ, уровень липидов и инсулина и, по-видимому , снижала утомляемость. В будущих крупных исследованиях следует изучить потенциальные положительные эффекты такой диеты от усталости. В настоящее время остается неясным, будет ли диета с низким содержанием жиров и растений положительно изменит течение РС.
Раскрытие информации
В. Ядав работал в качестве редактора секций для текущих отчетов по неврологии и нейробиологии , в качестве консультанта для Bayer Healthcare Pharmaceutical, Teva Neurosciences, Biogen Idec, в бюро докладчиков Novartis, а также получал поддержку в исследованиях от Фонда Макдугалла, NIH, National Multiple Фонд Общества склероза (NMSS), Фонд Нэнси Дэвис без стен и Biogen Idec.
Дж. Марраччи не сообщает о соответствующих раскрытиях.
Э. Ким не сообщает о соответствующих раскрытиях.
R. Испания получила исследовательскую поддержку от Службы исследований и разработок по делам ветеранов (VA), NMSS и Фонда медицинских исследований штата Орегон; и получил гонорары от NMSS и Общества РС Портленда.
М. Камерон получил научную поддержку от Департамента VA США, NMSS, Фонда Коллинза, Acorda Therapeutics и Международной федерации рассеянного склероза; работал консультантом в Acorda Therapeutics и Adamas Pharmaceuticals; получил финансирование на поездки от Консорциума центров РС (CMSC), парализованных ветеранов Америки и NMSS, а также гонораров от Genzyme Corporation, DJO Global, Ассоциации MS Америки, Общества РС Портленда и CMSC.
С. Оверс получил личную компенсацию от Biogen Idec за поездки и работу в консультативном совете.
A. Riddehough является операционным директором UBC MS / MRI Research Group, с которой был заключен контракт на проведение централизованного анализа МРТ- сканирования для терапевтических исследований с Genzyme, Hoffmann-LaRoche, Merck-Serono, Nuron Biotech, Parexel и Sanofi-Aventis.
DKB Li получил финансирование исследований от Канадского института исследований здоровья и Общества рассеянного склероза Канады. Он является директором исследовательской группы UBC MS / MRI, с которой был заключен контракт на проведение централизованного анализа МРТ-сканирования для терапевтических испытаний с использованием Genzyme, Hoffmann-LaRoche, Merck-Serono, Nuron Biotech, Parexel и Sanofi-Aventis. Он также выступал в качестве консультанта Vertex Pharmaceuticals и служил на данный и Консультативном совете по безопасности для Opexa терапии и научных консультативных советов для Novartis, Nuron и Roche.
Дж. Макдугалл является президентом Фонда исследований и образования Макдугалла, основателем и директором Медицинского и медицинского центра Макдугалла, а также занимал должность 2010–2014 гг.) Членом Консультативного совета по научным исследованиям всего рынка продовольствия.
Дж. Ловера получил исследовательскую поддержку от NIH, NMSS и LaCats.
C. Мерчисон не сообщает о соответствующих раскрытиях.
Д. Бурдетт получил гонорар докладчиков и гонорары консультантов от Biogen Idec и Teva Neurosciences, гонорар консультантов от Elan Pharmaceuticals, гонорар ораторов от Genzyme и исследовательские гранты от департамента VA, NIH и NMSS США.
Финансирование обучения
Научно-образовательный фонд Макдугалла, подарок семьи Бергер.
Подтверждения
Авторы выражают благодарность Лорен Штубер, BA, Эрин Дэвис, BA, Кортни Церизеф, BA, Александр Льюис, BA, и Rajesh Gunaji, BA, за поддержку координации обучения; Кэтрин Фишер, BA и Кристиана Пирс, RD для диетического консультирования; Синда Хугос, PT, для тренировок, Майкл Шапиро, DO для руководства по анализу биомаркеров, и Роджер Там, доктор философии, Алекс Мазур, MD, RT (R) и Guojun Zhao, доктор медицины для помощи в анализе МРТ. Liposcience, Inc.® для высокочувствительного тестирования CRP, и Брук Моррис Харкнесс, OD и Эдвинас Поцюс, BS для помощи в обработке образцов пациентов.
Приложение А . Критерии оценки
FFQ: FFQ из 147 пунктов является модифицированной версией блочного вопросника ( Kurtzke, 1983 ). Он основан на обширных обследованиях населения и подтвержден записями о продуктах питания.
RAPA ( Cella et al., 1996 ) использовали для оценки приверженности упражнениям. Анкета из 9 пунктов определяет виды деятельности от легких до энергичных и оценивает объем физической активности с помощью простых утверждений да / нет.
FSS ( Cutter et al., 1999 ) и MFIS являются хорошо проверенными шкалами для измерения усталости при РС. MFIS вводили как часть более крупного вопросника MSQLI ( Krupp et al., 1989 ).
EDSS ( Polman et al., 2011 ) и MSFC ( Anonymous, 2014 ) являются хорошо подтвержденными показателями инвалидности и прогрессирования заболевания при РС. Оценка EDSS проводилась слепым врачом, а MSFC — обученным координатором исследования. MSFC включает три измерения: ходьба по времени в 25 футов (T25FW), 9HPT и PASAT . Каждое измерение оценивает прогрессирование РС на основе выполнения заданий по времени для нижней конечности (T25FW), верхней конечности (9HPT) и когнитивной (PASAT).
Качество жизни измерялось с использованием SF-36- части MSQLI , вопросника из 36 пунктов, который оценивает психическое здоровье и способность выполнять повседневные задачи. Другими коэффициентами качества, измеренными в MSQLI, были PES, PDQ и BWCS.
Биомаркеры сыворотки измеряли воспаление с помощью hs-CRP и метаболизм липидов с помощью анализа сывороточного липопротеина (ЯМР-спектроскопия) и концентраций инсулина. Анализ этих биомаркеров был проведен в Liposcience, Inc.®, компании с опытом в области расширенного анализа липидов .
Рецидив рассеянного склероза : мы определили рецидив рассеянного склероза как возникновение новых неврологических симптомов, связанных с рассеянным склерозом, или обострение предшествующих неврологических симптомов рассеянного склероза, которое длилось более 24 часов в отсутствие болезни / инфекции или необычного стресса.
Приложение B . Географическое расположение резиденции участников исследования

Приложение C . Неблагоприятные события
Большинство АЕ были неврологическими (n = 33, включая рецидивы, усталость, уравновешенность и другие сенсорные и моторные явления) или инфекционными (n = 25, включая верхние дыхательные, мочевые, желудочно-кишечные, системные и кожные) по происхождению (Приложение D). В целом ОПЗ включен 2 дерматологических (контроль: 1; Diet: 1), 2 желудочно — кишечный тракт (Control: 2; Diet: 0), 25 инфекционная (Control: 12; Diet: 13), 8 опорно — двигательный аппарат (Control: 3; Диета: 5) 33 неврологических (контроль: 15; диета: 18), 1 психиатрический (контроль: 1; диета: 0), 2 беременности (контроль: 0; диета: 2) и 3 от других систем (контроль: 1; диета: 2) , Не было никакой существенной связи между назначением руки и типом системы органов (χ 2 = 5,91; р = 0,55), а также не наблюдалось различий в назначении в общем количестве АЕ ( р = 0,57).
Приложение D . Неблагоприятные события по системам органов
АЭ по системам органов и рецидивам
За 12-месячный интервенционный период было зарегистрировано 76 общих АЕ, которые были в основном неврологического или инфекционного происхождения. Не было никакой существенной связи между назначением руки и типом системы органов (χ 2 = 5,91; р = 0,55), а также не наблюдалось различий в назначении в общем количестве АЕ ( р = 0,57). Кроме того, не было отмечено связи между назначением руки и количеством рецидивов (χ 2 = 5,21; p = 0,16). Ни в одной из групп не было зарегистрировано тяжелых АЕ.
| Неблагоприятные события и системы органов | контроль | Рацион питания |
|---|---|---|
| дерматологический | ||
| крапивница | — | 1 |
| высыпание | 1 | — |
| желудочно-кишечный | ||
| Боли в животе с запором | 1 | — |
| Колоноскопия | 1 | — |
| инфекционный | ||
| Холодный | 5 | 1 |
| Мочеиспускательный канал | — | 4 |
| Грипп | 2 | 2 |
| Синусная инфекция | 3 | 2 |
| Пневмония | 1 | — |
| Опоясывающий лишай | — | 1 |
| Горло | — | 3 |
| Другие верхние дыхательные пути | 1 | — |
| Опорно-двигательный | ||
| Полная замена колена | 1 | — |
| Удлинение зубной коронки | 1 | — |
| Травма плеча | 1 | — |
| Ушиб колена | — | 1 |
| Хейлэктомия, операция с остеотомией | — | 1 |
| Другие скелетно-мышечные боли | — | 3 |
| неврологический | ||
| РС рецидив | 9 | 7 |
| Усталость | 2 | 1 |
| Онемение | 1 | 3 |
| Парестезию | 1 | 1 |
| мигрень | 1 | — |
| Неспецифические нарушения зрения | 1 | — |
| Слабость | — | 1 |
| Трудность при ходьбе / дисбаланс | — | 2 |
| Головокружение | — | 1 |
| падать | — | 2 |
| Другой | ||
| боль | — | 2 |
| Нарушение сна | 1 | — |
| депрессия | 1 | — |
| беременность | — | 2 |