Абстрактный
Рассеянный склероз (РС) проявляется демиелинизацией, воспалительной инфильтрацией, дегенерацией аксонов и глиозом, поражая обширные области центральной нервной системы (ЦНС). В то время как поражения белого вещества при рассеянном склерозе хорошо охарактеризованы патологически, данные указывают на то, что мозг при рассеянном склерозе может быть глобально изменен с небольшими отклонениями, обнаруженными в почти нормальном внешнем белом веществе (NAWM). Эти тонкие изменения трудно исследовать с помощью обычных методов, таких как гистохимическое окрашивание и обычная магнитно-резонансная томография. Таким образом, прототипное воспалительное поражение, вероятно, представляет собой наиболее очевидное проявление более широкого поражения ЦНС. Мы описываем применение микроскопии спектрального когерентного антистоксова комбинационного рассеяния (sCARS) для изучения таких изменений в ткани хронического РС, особенно при NAWM.
Выводы
В отличие от других методов ( например,MRI, объемный биохимический анализ тканей), sCARS предоставляет химически специфичную информацию о биологической ткани с высоким пространственным и спектральным разрешением, не требуя внешних зондов или меток. Использование нашей системы классификации анализа спектрального рассеяния предоставило эффективный способ сопоставления, отображения и количественной оценки очень больших наборов спектральных данных, генерируемых sCARS. Этот метод также обеспечивает упрощенный количественный показатель за счет присвоения скалярного индекса или «балла» любой области, генерируя индекс патологической классификации. Такой индекс может оказаться очень полезным для обеспечения более объективного измерения патологии по сравнению с произвольным характером обычных методов окрашивания и визуального осмотра, увеличивая при этом чувствительность и специфичность гистопатологии рассеянного склероза. Наши предварительные данные демонстрируют, как sCARS может быть мощным дополнением к традиционному патологическому исследованию биологических тканей, давая информацию о тонкой биохимической патологии в отсутствие явных морфологических аномалий, что может способствовать нашему фундаментальному пониманию патогенеза.
Что касается РС человека, наши данные sCARS предполагают, что ранние широко распространенные биохимические нарушения липидов миелина могут быть важным ранним дегенеративным изменением, которое может дополнительно способствовать аутоиммунному воспалению, обеспечивая хронический источник биохимически модифицированных антигенных липидов. Помимо рассеянного склероза, чувствительность sCARS к липидным изменениям может быть использована для исследования широкого спектра неврологических расстройств, при которых липидные аномалии играют патофизиологическую роль.
Вступление
Рассеянный склероз (РС) является ведущей причиной нетравматической неврологической инвалидности у молодых людей 1 с глобальной распространенностью ≈2,3 миллиона человек. 2Основная причина остается спорной, несмотря на десятилетия расследования. Пациенты с диагнозом различных клинических форм рассеянного склероза (рецидивирующе-ремиттирующий, первично-прогрессирующий и вторично-прогрессирующий) проявляют признаки неврологической дисфункции, приводящей к снижению сенсорной, моторной, когнитивной функции, функции кишечника / мочевого пузыря и походки. Традиционно РС считается первичным аутоиммунным воспалительным заболеванием, при котором дисрегулируемая периферическая иммунная система способствует атаке на ЦНС, особенно на изолирующий слой миелина вокруг аксонов. Однако альтернативная модель предполагает, что РС может начаться как первичный дегенеративный процесс с аутоиммунными и воспалительными реакциями, возникающими вторично в ответ на дегенерирующий миелин. 3–5Наиболее распространенным фенотипом РС при представлении является ремиттирующее заболевание (РЕ), при котором пациенты в значительной степени выздоравливают во время ремиссии. Однако примерно через 25 лет после начала заболевания у большинства пациентов развивается вторично-прогрессирующая (SP) фаза с накоплением необратимой инвалидности. 4,6–11 Постепенный переход от RRMS к SPMS не может быть определен с помощью каких-либо окончательных клинических, визуализирующих, иммунологических или патологических критериев. 9 Меньший, но значительный процент присутствующих с самого начала первично-прогрессирующего РС (ППРС), характеризующийся постепенным прогрессирующим клиническим течением без рецидивов или ремиссий и с менее выраженной воспалительной патологией. 12Продольные исследования также показали, что пациенты с SPMS и PPMS страдают клиническим снижением с одинаковой скоростью. 13 Для более распространенного RRMS за последние два десятилетия появилось несколько вариантов иммуномодулирующего лечения. Однако этого нельзя сказать о прогрессирующих фенотипах РС, поскольку вышеупомянутые противовоспалительные терапевтические средства, как правило, неэффективны для замедления накопления инвалидности.
Поражение рассеянного склероза хорошо изучено со времени доклада Шарко в 1868 году. 14 Характерная патология включает комбинацию очаговой демиелинизации, воспаления, образования глиотических рубцов и разной степени разрушения аксонов. Хотя эти поражения являются наиболее очевидным признаком повреждения ЦНС, окружающие области, традиционно обозначаемые как «нормально выглядящее» белое вещество (NAWM), представляют особый интерес. В NAWM головного мозга с рассеянным склерозом тонкие аномалии были обнаружены с помощью расширенной магнитно-резонансной томографии (МРТ), включая увеличенное время релаксации T 1 и T 2 , 15 пониженные коэффициенты передачи намагниченности (MTR) 16 и аномалии на визуализации тензора диффузии.17 Эксперименты с корреляцией MTR и иммуногистохимии показывают, что эти аномалии, по-видимому, зависят от близости к очаговым поражениям белого вещества с набуханием аксонов и увеличением количества микроглии / макрофагов, обнаруживаемых далеко от поражений. 18 Однако уменьшение количества записей MTR также было обнаружено до образования поражения. 19 У пациентов с относительно умеренной нагрузкой на повреждение признаки прогрессирующей атрофии головного мозга указывают на более обширные аномалии в NAWM 20, и было обнаружено, что новые поражения формируются в NAWM еще до разрушения гематоэнцефалического барьера. 21 год Взятые вместе, эти наблюдения позволяют предположить, что патология более распространена, чем предполагалось ранее, и выходит далеко за рамки классической демиелинизирующей бляшки.
Миелиновая оболочка, необходимая для распространения потенциала действия, представляет собой высокоупорядоченную структуру, состоящую из ≈70% липидов по сухому весу, которая существует в строго согласованном балансе с основными белками миелина, чтобы сформировать изолирующий слой вокруг аксона. Исторически липиды миелина исследовались менее широко, чем белки миелина in situ из-за их гидрофобности и сложного разнообразия различных видов липидов. Однако было показано, что липидный состав миелина у пациентов с РС отличается от такового у здоровых людей. 6,22 Более конкретно, сообщалось о снижении общего содержания липидов и фосфолипидов, особенно этаноламиновых плазмалогенов, цереброзидов, сульфатидов и сфинголипидов. 6,23–28Напротив, сложные эфиры холестерина, продукты распада холестерина, увеличиваются в головном мозге с рассеянным склерозом. 27–30 В совокупности это предполагает, что аномалии липидов могут быть критически важными ранними событиями, достигающими высшей точки в демиелинизации. Ткань мозга при посмертном рассеянном склерозе традиционно исследовали с использованием обычных гистологических красителей, таких как гематоксилин и эозин, вместе с красителями, определяющими миелин, такими как Luxol Fast Blue (LFB). Хотя эти красители хорошо подходят для морфологии тканей, клеточной инфильтрации и явной демиелинизации, они менее чувствительны к тонким потенциально более широко распространенным биохимическим аномалиям. LFB связывается с некоторыми биологическими липидами, не реагируя на холестерин, сложные эфиры холестерина или цереброзиды, 31что является ограничением, учитывая, что эти компоненты изменены в MS. Другие липофильные красители, используемые для окрашивания миелина (Oil Red O, Sudan Black и Nile Red), демонстрируют противоречивое связывание и не обладают специфичностью. 32,33Иммуногистохимия может использоваться для оценки морфологии миелина путем нацеливания на основные белковые комплексы миелина, такие как основной белок миелина (MBP) и протеолипидный белок (PLP), и, хотя эти метки являются высокоспецифичными, эти метки сообщают о морфологических изменениях и потере / увеличении белка, но не предоставляют информации относительно фактические изменения липидов миелина. Более того, такие методики маркировки требуют обширной обработки тканей, включающей агрессивные растворители и / или этапы повышения проницаемости детергентов, которые нарушают тканевую среду и, что более важно, изменяют основные липидные компоненты ткани, которые могут нести важную патологическую информацию. Более прямое, химически специфическое считывание липидных изменений даст нам большое преимущество в нашей способности исследовать тонкие биохимические изменения в больном мозге.
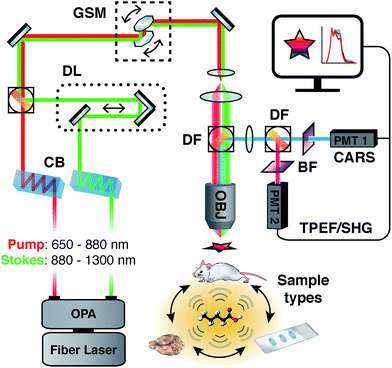
Методы визуализации без меток, такие как когерентное комбинационное рассеяние, которое включает варианты когерентного антистоксова комбинационного рассеяния (CARS) и стимулированного рамановского рассеяния (SRS) 34 , стали жизнеспособными методами для исследования богатых липидами структур, таких как миелин. Эти методы основаны на спектроскопии комбинационного рассеяния света, методе неупругого рассеяния, который используется для исследования колебательных и вращательных мод молекул и их химических связей. С помощью CARS длины волн двух импульсных лазеров настраиваются для когерентного возбуждения целевой колебательной моды, тем самым значительно улучшая интенсивность сигнала и скорость сбора данных по сравнению со спонтанным комбинационным рассеянием. В качестве метода нелинейной визуализации, использующего источники импульсного возбуждения, CARS обладает отличным осевым разрешением и ограниченным дифракцией, субмикронным пространственным разрешением.35 без необходимости использования красителей, репортеров или этапов химической обработки, при этом дополнительно предоставляя уникальную биохимическую информацию о молекулярной колебательной среде образца. Вкратце, CARS включает в себя процесс смешивания четырех волн, требующий взаимодействия возбуждающего луча «накачки» на частоте ω p и стоксова пучка на частоте ω s . Когда разность частот между ω p и ω s настроена так, чтобы соответствовать частоте конкретной рамановской активной молекулярной вибрации, резонансные осцилляторы в образце когерентно управляются нелинейной комбинацией полей возбуждения ε p и ε s., генерирующий антистоксов сигнал с синим смещением, задаваемый ω как = 2 ω p — ω s . Наиболее распространенный способ генерации сигнала КАРС с помощью вырожденной схемы, в результате чего поле возбуждения насоса служит и насосом и датчиком одновременно, в результате чего интенсивность антистоксова сигнала пропорциональна квадрату числа имеющихся колебательных генераторы в образце. Богатая липидами миелиновая оболочка хорошо подходит для исследования с помощью CARS путем возбуждения сильных колебательных мод в области растяжения СН (углерод-водород) с высоким волновым числом, расположенной между 2800 и 3100 см -1., хорошо подходят для нацеливания на длинные ацильные цепи, которые составляют липиды миелина. Большинство исследований на сегодняшний день либо на периферических нервах 36-40, либо на центральной нервной системе 41-50 были сосредоточены на одночастотной визуализации для максимальной интенсивности и контраста, при этом нацелено одно волновое число, обычно сильное симметричное растяжение CH 2 на ~ 2850 см — 1 . Хотя этот метод обеспечивает изображения без меток с хорошим соотношением сигнал / шум, он не дает никакой дополнительной информации о биохимическом состоянии образца, кроме колебаний интенсивности, указывающих на увеличение или уменьшение липидов по отношению к симметричному участку CH 2 и наблюдаемым морфологическим показателям. вариации. 51И наоборот, некоторые инструменты отдают предпочтение захвату спектрального содержимого с помощью спектрометров и фреймграбберов, однако они требуют многомерного извлечения данных или математических преобразований для воссоздания изображений. 52,53 Кроме того, их конфигурация обнаружения прямого распространения создает проблемы при анализе толстых целых образцов или образцов in vivo . Наша спектральная адаптация CARS (sCARS) включает в себя временное растяжение двух фемтосекундных импульсов с высокой пиковой энергией через настраиваемый, индуцированный стеклом 54установка спектральной фокусировки, комбинированная спектральная полоса пропускания и разрешение которой способны когерентно управлять большим диапазоном колебательных мод в образце. Это обеспечивает высокое пространственное разрешение без меток, которое можно получить с помощью стандартного изображения CARS, но с дополнительной спектральной избирательностью и генерацией спектральных данных для каждого пикселя полученного изображения ( рис. 1 ).
Вибрационная спектроскопия для изучения аспектов рассеянного склероза в основном сосредоточена на моделях животных, таких как экспериментальный аутоиммунный энцефаломиелит 48,49 или на моделях искусственно индуцированной демиелинизации и ремиелинизации. 41,55 Однако ни одна модель не дает полной картины РС, и лишь немногие из них точно имитируют прогрессирующий фенотип РС, что важно, учитывая, что большинство пациентов с ремиттирующим РС со временем переходят во вторично прогрессирующее (SP) заболевание. Многие из этих моделей также не учитывают лежащий в основе дегенеративный компонент, который может быть важным фактором развития болезни. С этой целью более полное представление о РС, особенно о прогрессирующих фазах, лучше получить путем прямого анализа образцов головного мозга человека.
Здесь мы используем новый широкополосный спектральный микроскоп CARS (sCARS) для анализа посмертной ткани мозга человека с рассеянным склерозом. Эти принципиальные результаты демонстрируют биохимические изменения липидов в миелине в областях, окружающих поражения, у конкретных пациентов, и, что важно, мы демонстрируем тонкие, но широко распространенные отклонения липидов миелина в регионах, удаленных от демиелинизирующих бляшек. Эти наблюдения проливают свет на обширные биохимические аномалии, влияющие на миелин в головном мозге с рассеянным склерозом, которые не могут быть обнаружены обычными методами, и предполагают, что такие изменения могут отражать самые ранние события, в конечном итоге приводящие к воспалительной демиелинизации.
Материалы и методы
Подготовка ткани
Человеческая ткань была получена из Нидерландского банка мозга (таблица S1 † ). Вскрытие проводилось с задержкой вскрытия не более 24 часов. Образцы были получены от четырех пациентов с хроническим вторично-прогрессирующим РС. Первоначальные коронковые полусферические срезы толщиной 10 мм были вырезаны из головного мозга, а мозолистые тела иссечены с использованием ориентации с помощью МРТ. 56 образцов фиксировали в нейтральном забуференном формалине и переносили в 30% сахарозу для криозащиты и последующего мгновенного замораживания. Образцы подвергали криосрезу при 100 мкм и поддерживали в свободном плавании до установки на положительно заряженные предметные стекла (Menzel-Gläser) для окрашивания и визуализации. Соответствующие области контрольные образцы головного мозга были также получены от двух контролей с неневрологическим заболеванием и обработаны идентично.
Иммуногистохимия
Иммуногистохимическое окрашивание проводили, как описано ранее. 57 Вкратце, срезы инкубировали с первичными антителами, нацеленными на основной белок миелина PLP (протеолипидный белок — Serotec, Оксфорд, Великобритания) и рецептор клеточной поверхности HLA-DR (человеческий лейкоцитарный антиген) для активированной микроглии. Затем срезы инкубировали с меченными Alexa Fluor® 488 козьими антимышиными иммуноглобулинами (1: 400) (Invitrogen, Paisley, UK) или хромогеном DAB. Все окрашенные срезы закрывали и оценивал невропатолог. Поражения белого вещества, границы серого вещества и области NAWM были отмечены для анализа, как показано на рис.3 . Соседние неокрашенные срезы для визуализации sCARS помещали на предметные стекла и хранили замороженными при -20 ° C до анализа.
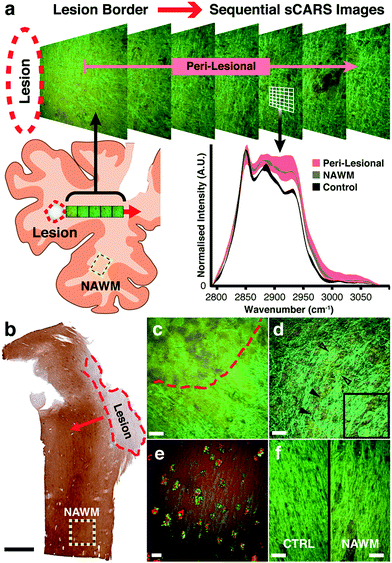
Были получены последовательные пошаговые псевдоокрашенные изображения sCARS, начиная с границы демиелинизированного поражения и двигаясь кнаружи.
Спектры sCARS были извлечены из каждого пикселя изображений для дальнейшего анализа.
В качестве примера показан наложенный график спектров из перипоральной последовательности, нормального белого вещества (NAWM) и контрольных областей, показывающих их соответствующее распределение.
(b) Пример среза MS, иммуноокрашенного на протеолипидный белок (PLP).
Красная пунктирная область представляет собой демиелинизированную бляшку;
красная стрелка показывает направление дискретизации спектрального изображения наружу;
желтый пунктирный квадрат представляет область, выбранную для получения данных о белом веществе «нормального» вида.
Черная шкала = 2 мм.
(c) Псевдоцветное спектральное изображение sCARS, полученное на границе или поражении с глиотической демиелинизированной тканью над красной пунктирной линией и частично демиелинизированной тканью под ней.
(d) Характерные аксональные сфероиды (черные стрелки), обнаруженные по всему диффузному поражению.
Врезка: увеличение аксональных сфероидов.
(e) Активированная микроглия в краю поражения, окрашенная на HLA-DR (красный), содержащая расщепленный миелин / липидный остаток, показана с помощью sCARS (зеленый) (f) бок о бок сравнение псевдоокрашенных изображений sCARS, показывающих морфологическое сходство между областями -подобный здоровый контрольный образец и белое вещество «нормального вида».
Все белые шкалы = 20 мкм.
(d) Характерные аксональные сфероиды (черные стрелки), обнаруженные по всему диффузному поражению.
Врезка: увеличение аксональных сфероидов.
(e) Активированная микроглия в краю поражения, окрашенная на HLA-DR (красный), содержащая расщепленный миелин / липидный остаток, показана с помощью sCARS (зеленый) (f) бок о бок сравнение псевдоокрашенных изображений sCARS, показывающих морфологическое сходство между областями -подобный здоровый контрольный образец и белое вещество «нормального вида».
Все белые шкалы = 20 мкм.
(d) Характерные аксональные сфероиды (черные стрелки), обнаруженные по всему диффузному поражению.
Врезка: увеличение аксональных сфероидов.
(e) Активированная микроглия в краю поражения, окрашенная на HLA-DR (красный), содержащая расщепленный миелин / липидный остаток, показана с помощью sCARS (зеленый) (f) бок о бок сравнение псевдоокрашенных изображений sCARS, показывающих морфологическое сходство между областями -подобный здоровый контрольный образец и белое вещество «нормального вида».
Все белые шкалы = 20 мкм.
(e) Активированная микроглия в краю поражения, окрашенная на HLA-DR (красный), содержащая расщепленный миелин / липидный остаток, показана с помощью sCARS (зеленый) (f) бок о бок сравнение псевдоокрашенных изображений sCARS, показывающих морфологическое сходство между областями -подобный здоровый контрольный образец и белое вещество «нормального вида».
Все белые шкалы = 20 мкм.
(e) Активированная микроглия в краю поражения, окрашенная на HLA-DR (красный), содержащая расщепленный миелин / липидный остаток, показана с помощью sCARS (зеленый) (f) бок о бок сравнение псевдоокрашенных изображений sCARS, показывающих морфологическое сходство между областями -подобный здоровый контрольный образец и белое вещество «нормального вида».
Все белые шкалы = 20 мкм.
система sCARS
Система sCARS управляется усиленным фемтосекундным волоконным лазером, легированным иттербием (Clark-MXR — MI, США), генерирующим 100 фемтосекундных импульсов с частотой повторения 1 МГц и энергией импульсов 10 мкДж. Этот лазер накачивает изготовленные на заказ двойные неколлинеарные оптические параметрические усилители (Clark-MXR — MI, США), обеспечивающие три выхода, два с диапазоном настройки от 650 до 1300 нм и остаточный сигнал, фиксированный на уровне 1040 нм. Для текущих экспериментов выходы были настроены на 750 нм и 963 нм для накачки и Стокса, соответственно, для нацеливания на область волновых чисел CH. Оба импульса чирпировались с использованием специально разработанных многопроходных стеклянных блоков S-TIH53 (BMV Optical Technologies — Оттава, Канада). В сочетании с импульсами высокой энергии теоретически достижимо спектральное разрешение ниже 1 см -1 . 58Чтобы обеспечить оптимальную спектральную фокусировку, возбуждающие лучи должны быть одинаково растянуты в зависимости от длительности импульсов, ограниченных их начальным преобразованием. Поэтому пучки накачки и Стокса проходили через 450 мм и 650 мм стекла соответственно, что растягивало импульсы до ≈6,9 пс и 2,8 пс ( ссылка 59 ), обеспечивая спектральное разрешение ≈15 см −1, чтобы наилучшим образом соответствовать ширине рамановской линии область волновых чисел СН. Это позволило нам сканировать диапазон волновых чисел 300 (2800–3100 см −1).) путем управления временным перекрытием и мгновенным частотным взаимодействием между двумя импульсами с помощью оптической линии задержки и шагового каскада. Лучи вводились в сканирующую головку гальванометра С1 (Nikon — Токио, Япония). Пучки накачки и Стокса проходили через дихроический фильтр длиной 700 нм (Семрок, штат Нью-Йорк, США) и фокусировались на образец водно-иммерсионным объективом 25 × 1,1NA (Nikon, Токио, Япония). Излучение разделялось вторичным короткопроходным дихроичным фильтром 600 нм (BMV Optical) и собиралось парой фотоумножителей (город Хамамацу — Хамамацу, Япония) (CARS> 600 нм и флуоресценция с двухфотонным возбуждением, генерация второй гармоники <600 нм. ). Полосовые фильтры (Semrock — Нью-Йорк, США) 624/40 нм и 535/70 нм соответственно предшествуют детекторам для дополнительной очистки сигнала. Изображения размером 512 × 512 были получены с временем задержки пикселя 2 мкс и полем зрения ≈170 × 170 мкм. Все аппаратные интерфейсы контролировались с помощью LabVIEW (National Instruments — Остин, штат Техас, США), за исключением сканирования изображений, которое контролировалось с помощью собственного программного обеспечения EZ-C1 (Nikon — Токио, Япония). Калибровку проводили с использованием смеси полимерных микросфер: полиэтилена 20 мкм, полиметилметакрилата 11 мкм (Cospether LLC — Санта-Барбара, Калифорния, США) и шариков полистирола FocalCheck ™ 15 мкм (Molecular Probes — Eugene OR, США), установленных на стекле. скользить с помощью силиконового эластомера Sylgard® 184 (Dow Corning — Midland MI, США). который контролировался с помощью собственного программного обеспечения EZ-C1 (Nikon — Токио, Япония). Калибровку проводили с использованием смеси полимерных микросфер: полиэтилена 20 мкм, полиметилметакрилата 11 мкм (Cospether LLC — Санта-Барбара, Калифорния, США) и шариков полистирола FocalCheck ™ 15 мкм (Molecular Probes — Eugene OR, США), установленных на стекле. скользить с помощью силиконового эластомера Sylgard® 184 (Dow Corning — Midland MI, США). который контролировался с помощью собственного программного обеспечения EZ-C1 (Nikon — Токио, Япония). Калибровку проводили с использованием смеси полимерных микросфер: полиэтилена 20 мкм, полиметилметакрилата 11 мкм (Cospifer LLC — Санта-Барбара, Калифорния, США) и шариков полистирола FocalCheck ™ 15 мкм (Molecular Probes — Eugene OR, США), установленных на стекле. скользить с помощью силиконового эластомера Sylgard® 184 (Dow Corning — Midland MI, США).
Обработка данных и анализ изображений
Спектральные изображения CARS были проанализированы с использованием комбинации специального программного обеспечения, написанного PK Stys и Matlab (Mathworks, 2014a). Вкратце, спектральные изображения были получены таким же образом, как и суммирование флуоресценции лямбда, путем последовательного нацеливания на каждое волновое число области CH. С помощью этого метода было получено 101 изображение, содержащее попиксельную спектральную информацию CARS. Затем эти изображения были объединены в одно изображение и псевдоокрашены, чтобы отразить форму и интенсивность спектра CARS в каждом пикселе. Для анализа спектры были только нормированы. Для отображения спектры были сглажены с использованием биномиальной фильтрации (однопроходной), нормализованы и удалена базовая линия с использованием подгонки кубическим сплайном.
Результаты и обсуждение
Широкополосная спектральная биохимическая визуализация
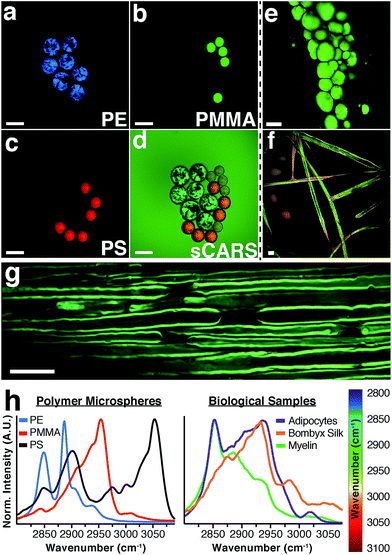
Чтобы проиллюстрировать способность нашего прибора разрешать химические различия с помощью микроскопии sCARS, мы визуализировали смесь микросфер, состоящих из трех различных полимеров: полиэтилена (PE), полиметилметакрилата (PMMA) и полистирола (PS). Эти материалы имеют характерные и неизменные рамановские спектры, которые также служат для калибровки прибора. Путем визуализации всей спектральной области между 2800–3100 см -1 мы смогли построить спектр для каждого пикселя изображения, дифференцируя каждый полимер в смеси по его характерным колебательным пикам ( рис. 2a – d ). Комбинируя спектральную серию изображений, охватывающих всю область CH, можно получить изображение sCARS, где каждый пиксель содержит спектр в диапазоне от 2800–3100 см -1.. Изображения sCARS были закодированы цветом по интенсивности и спектральному содержанию. С более сложными образцами, такими как биологическая ткань, эти псевдоцветные изображения с высоким разрешением позволяли одновременно отображать морфологию и химический состав. Несколько примеров sCARS-изображений биологических образцов показаны на рис. 2e – g . Мышиные адипоциты и миелин, хотя и богаты липидами, производят очень разные спектры sCARS из-за разного липидного состава 22 и структурной сборки липидных молекул. В качестве примера визуализации чистого белка на рис. 2f показано изображение в формате sCARS депарафинированных, богатых белком шелковых волокон шелкопряда Bombyx .
Соответствующие спектры, извлеченные из каждого изображения, показывают высокое спектральное разрешение, достигаемое нашим прибором, начиная от четких спектров полимеров ( рис. 2h — слева) до четких различий, наблюдаемых между различными типами богатых липидами структур и белкового образца ( Рис. 2h — справа). Такая спектральная специфичность позволяет точно определять тонкие молекулярные изменения и порядок упаковки липидов на изображениях с разрешением, ограниченным дифракцией.
sCARS-визуализация ткани вторичного прогрессирующего рассеянного склероза
Затем мы применили нашу технику для изучения биохимических липидных изменений в мозге человека с вторичным прогрессирующим РС. Под контролем иммуноокрашенных параллельных срезов PLP ( рис. 3b и S1 † ) была записана серия изображений sCARS как с МС, так и с контрольного мозга человека. Для ткани с рассеянным склерозом рабочий процесс состоял из последовательного получения соседних изображений, движущихся наружу от границы демиелинизированных очаговых поражений ( рис. 3а).). С полем зрения 170 × 170 мкм было сделано не менее 10 перекрывающихся изображений sCARS, простирающихся до> 1,53 мм от поражения для образцов A, B и C. Образец D (из-за характера поражения, описанного ниже) отбирали 16 раз каждые 500 мкм. Для контрольной ткани поочередно делали три копии изображений с Ctrl1 или Ctrl2. На основе изображений sCARS со спектральной цветовой кодировкой последовательность изображений пери-очага поражения показала заметный цветовой градиент, движущийся наружу от поражения в некоторых образцах, что свидетельствует об изменениях в сигнатуре колебаний липидов. Следующий шаг включал извлечение попиксельных спектров, взятых из миелин-специфичных областей, в то время как вклады от тел клеток и внеклеточного матрикса не учитывались на основании различных спектральных сигнатур. Классические очаги рассеянного склероза проявляют очаговую демиелинизацию и сопутствующее воспаление, что приводит к разным степеням повреждения аксонов и рубцеванию астроцитов. Хотя эти поражения гистологически очевидны, наша цель состояла в том, чтобы исследовать биохимические изменения в миелине окружающих перипоральных и гистологически нормально нормальных областей, чтобы обнаружить незначительные отклонения. В то время как поражения в образцах A, B и C были полностью демиелинизированы с четкими границами (Рис. 3c ), образец D имел много сохранившихся миелинизированных аксональных трактов внутри поражения, которые также имели очень диффузную границу. В этом образце также наблюдались многочисленные аксональные сфероиды различных размеров ( Рис. 3e ). Поскольку наше внимание было сосредоточено на липидах миелина, анализ в этом конкретном образце начался в приблизительном центре поражения и продолжился за пределами диффузной границы. Наш инструмент также был в состоянии одновременно собирать другие нелинейные методы визуализации; например, иммуноокрашенная микроглия по краю поражения была визуализирована с помощью двухфотонно возбужденной флуоресценции, в то время как проглоченные липидные остатки миелина, содержащиеся внутри, были одновременно визуализированы с помощью sCARS ( рис. 3e).). Спектральные изображения были также записаны из области на том же соответствующем срезе, морфологически не имеющей явной демиелинизации или глиоза (желтый пунктирный квадрат — рис. 3b ), что мы назвали «нормальным по внешнему виду» белым веществом (NAWM). В качестве контроля мы выбрали подходящие по региону образцы ткани, полученные от пациентов с неневрологическими причинами смерти. При стандартной гистологической окраске NAWM морфологически сходен с контрольными образцами. Псевдоокрашенные sCARS-изображения NAWM и контрольных образцов, хотя и схожи по морфологии, демонстрировали небольшую разницу в цвете ( рис. 3f ), предполагающую спектральные различия. Спектры, полученные в перипоральных областях для образцов A, B и C, показали значительную гетерогенность, что свидетельствует о значительных вариациях в биохимии липидов миелина (рис. S2).† ). Напротив, набор перипоральных спектров образца D был более однородным, но сильно отличался от контроля. Общее наблюдение во всех образцах было одним из повышенных асимметричных удлинений СН 2 и симметричных концов цепи СН 3 (2880 см -1 и 2935 см -1 соответственно) в пораженных областях (рис. S2 † ) по сравнению с контролями без МС. Наиболее интригующим было обнаружение того, что все четыре образца демонстрируют аномальные спектральные характеристики в областях NAWM, которые отчетливо отличаются от контрольных образцов, соответствующих регионам (рис. S2 † ).
Спектральный анализ для классификации патологических изменений
Для высокоупорядоченных липидов в биологических мембранах, таких как миелин, измерение соотношений интенсивностей в режимах растяжения СН было классическим способом наблюдения конформационного нарушения, 23,24особенно после экзогенного оскорбления. Однако этот метод имеет дело только с необработанными изменениями интенсивности для отдельных волновых чисел и не принимает во внимание возможные тонкие рамановские сдвиги, широкие плечи и общую форму спектральной кривой. Имея доступ ко всей области волновых чисел СН в каждом пикселе (до 262144 спектров для изображения размером 512 × 512), спектры липидов миелина были проанализированы с использованием специального алгоритма для учета любых произвольных спектральных изменений, происходящих во всей области волновых чисел СН. Путем заключения соответствующих спектров липидов миелина в скобки между контрольным спектром и наиболее патологически аномальным спектром миелина, была рассчитана оценка, отражающая биохимические изменения. Рис. 4описывает процесс анализа данных, начиная с sCARS-изображений перипоральных областей, NAWM и неневрологических контролей. Для анализа учитывались только миелинизированные аксоны. Пиксели были выбраны и визуально замаскированы (синим цветом) на основе спектрального сходства с использованием эталонного спектра и наименьших квадратов разницы спектральных сходств в изображении с выбираемыми допусками и порогами интенсивности для устранения нечетких деталей изображения ( рис. 4a и b ). Затем все соответствующие спектры были извлечены из каждого изображения, затем классифицированы и оценены с использованием набора определенных спектральных параметров брекетинга, при этом контроль = 0 и поражение / патологическое = 1 ( рис. 4c.). Это было достигнуто с помощью нелинейного преобразования, основанного на единственном скалярном значении, которое было передано в качестве подгоночного коэффициента стандартному алгоритму подбора нелинейной кривой наименьших квадратов Левенберга-Марквардта. Оптимизированный коэффициент, полученный при подгонке, представляет собой «патологический балл». Затем результаты отображали на двумерном графике разброса плотности ядра интегральной интенсивности сигнала на оси y по сравнению с патологическим баллом на оси x . Рис. 4dпоказывает комбинированный график плотности ядра из анализа образца C с кластером, созданным из спектров 17 наложенных изображений sCARS (11 перипоральных, 3 NAWM и 3 контрольных). Путем корреляции с положениями пикселей на микрофотографиях sCARS выделяются кластеры, принадлежащие перипоральным областям, NAWM и элементам управления, показывая отдельные популяции для каждой группы. Затем мы построили гистограмму каждого отдельного кластера / изображения, показывающую распределение их патологических баллов для дальнейшего извлечения любых биохимических вариаций, с акцентом на перипоральную последовательность изображений sCARS за пределами края поражения. Рис. 4eпоказывает кумулятивную функцию распределения образца C, где спектральные кластеры, принадлежащие перипоральным изображениям, попадают в стробированные спектральные параметры «контроль» и «поражение / патологический». Интересно, что кластеры NAWM отличались от контрольных образцов, что указывает на аномалию биохимии липидов. Последний шаг включал построение патологических баллов для каждого спектрального кластера, взятого при 95% нормализованного частотного распределения. При этом каждый спектральный кластер теперь представлен скалярным индексом, представляющим тяжесть заболевания. Если расположить ось x по расстоянию от границы поражения, полученный график показывает четкий патологический градиент по мере удаления от поражения ( рис. 4f).). Анализ этих данных на ткани SPMS показал четкие различия в распределении ядер на графиках плотности ( рис. 5 — первая строка). Гистограммы распределения, проанализированные по кластеру / изображению, показали дальнейшие различия между образцами ( рис. 5 — вторая строка), которые были дополнительно выделены при построении патологических баллов на 95- м процентиле ( рис. 5).— третий ряд). По отдельности образцы от А до С имеют аналогичную картину уменьшения патологии при удалении от поражения, однако незначительные различия в патологических оценках видны в различных местах вдоль их перипоральной последовательности. С его в основном все еще миелинизированным поражением, характеризующимся обилием аксональных сфероидов и диффузным ободком, образец D показал высокие патологические баллы или болезненное состояние, которое оставалось неизменным до и после прохождения через диффузную границу поражения. Единственная константа, наблюдаемая во всех образцах, была аномальной спектральной сигнатурой для NAWM по сравнению с неневрологическим контролем.
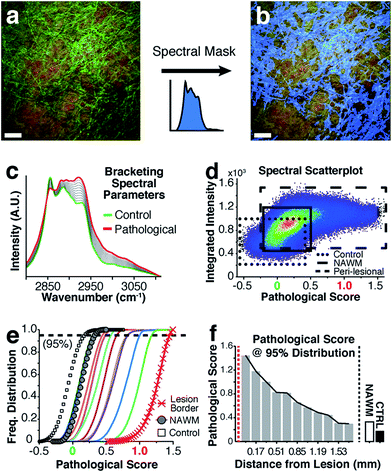
(б) Для анализа рассматриваются только миелинизированные аксоны.
Синяя маска спектрального выделения применяется на основе подобия спектральной кривой.
(с) Контролируемая классификация всех соответствующих спектров с
использованием брекет определены спектральные параметры: контроль оценка = 0 и поражение / патологическая оценка = 1. (г) ядра плотности рассеяния график интенсивности
VS.спектральный индекс, включая перипоральные серии, NAWM и контроль.
Каждое изображение sCARS = 1 кластер.
Этот пример содержит 17 кластеров.
(e) Кумулятивные функции распределения, отображающие нормированную частоту патологических баллов для каждого спектрального изображения.
Каждая линия представляет собой определенное расстояние от границы поражения (пери-поражения), если не указано иное.
Пунктирная линия указывает 95% -ный порог нормализованного распределения.
(f) Гистограмма, показывающая «Патологический балл» каждого кластера изображений, снятого с 95% нормализованной частоты, упорядоченной по расстоянию от поражения (пери-поражения), по сравнению с усредненным NAWM и контрольными образцами.
Красная пунктирная линия обозначает границу поражения.
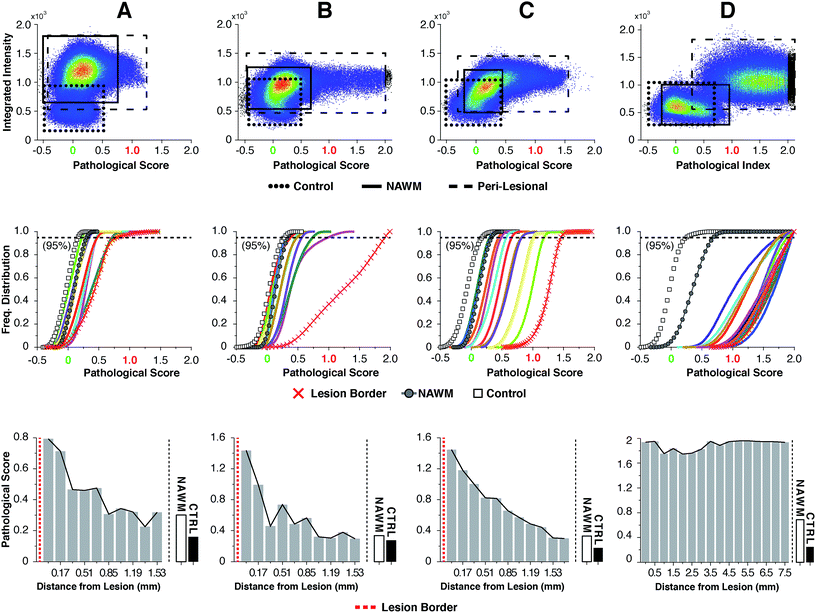
Первая строка: диаграмма разброса плотности ядра для всех релевантных спектров, классифицированных по параметрам брекетинга.
Прямоугольниками показаны группы перипоральных, NAWM и контрольных кластеров.
Вторая строка: нормализованная частотная гистограмма каждого изображения sCARS по патологическому баллу.
Изображение sCARS, ближайшее к поражению, NAWM и контрольные области выделены.
Третий ряд: графики 95-го процентиля ядер по патологическому баллу, расположенные по расстоянию от очага поражения.
Обсуждение
Хотя окончательная причина рассеянного склероза неизвестна, преобладающая теория предполагает наличие аберрантной периферической иммунной системы, побуждающей миелин-реактивные Т-лимфоциты проникать в ЦНС, атаковать миелин и приводить к мультифокальной воспалительной демиелинизации. 60,61 Этот иммуноцентрический подход стимулировал разработку ряда методов лечения, которые доказали свою высокую эффективность в уменьшении воспалительных поражений. 62,63 Однако большинство пациентов с РС приобретают прогрессирующее течение через несколько десятилетий, и иммуносупрессивные агенты не приносят особой пользы на этой стадии, когда наблюдается наиболее необратимая инвалидность. 4,5,8Это вызвало вопросы о полноте иммуноцентрической модели, что привело к альтернативной гипотезе, согласно которой первичная дегенерация белого вещества ЦНС вторично вовлекает повторяющиеся воспалительные демиелинизирующие атаки; позже, когда иммунная дерегуляция утихает с возрастом, прогрессирующая дегенерация продолжается без маски. 5,20,64 Новые более чувствительные методы обнаружения биохимической патологии белого вещества до явной демиелинизации и при отсутствии воспалительной инфильтрации могут помочь решить фундаментально важные вопросы, касающиеся патогенеза рассеянного склероза. Используя нашу систему sCARS, мы непосредственно нацелились на характерные молекулярные колебательные сигнатуры различных липидов, которые являются основными компонентами миелина, путем исследования спектральной области углерод-водород (СН).
Эта область CH (2800–3010 см –1 ) приписывается модам растяжения колебаний CH и обертонам деформации H – C – H 67 и обычно используется для исследования упорядочения длинных углеводородных цепей липидов ( Таблица 1 ). Взаимодействие между различными колебательными модами в этой области чрезвычайно чувствительно к упаковке молекул липидов и системным возмущениям, вызывающим беспорядок как внутри, так и между молекулами. 23,68–70 Благодаря высокой чувствительности метода к различным аспектам липидных аномалий и расстройства упаковки, мы намеренно сосредоточились на областях, выходящих за рамки обычных (по стандартной нейропатологии) поражений белого вещества РС, особенно NAWM, представляющих области, далекие от демиелинизированных бляшек.Таблица 1 Отнесение рамановского сдвига колебательной области CH 23,65,66
| Рамановский сдвиг (см -1 ) | Вибрационное отнесение |
|---|---|
| 2845 | CH 2 симметричная растяжка |
| 2886 | CH 2 асимметричное растяжение / резонанс Ферми CH 2 растяжение |
| 2935 | Симметричное растяжение конца цепи CH 3 |
| 2960 | Асимметричный участок цепи СН 3 / белок вне плоскости |
| 2970 | Холестерин / эфир холестерина |
| 3010 | Ненасыщенный = СН растяжение |
Подробные исследования NAWM показывают, что белое вещество РС поражено более широко, чем считалось ранее. 21 Как отмечалось выше, исследования, посвященные аномалиям липидов в NAWM, сообщают о заметных изменениях 6,25,26,28,29,71предполагая, что изменения в молекулярном упорядочении липидов миелина могут представлять важные и проксимальные шаги в сложном патогенезе этого нарушения. В настоящее время не существует надежных гистохимических средств для специфического исследования биохимических изменений липидов миелина. Кроме того, фундаментальная гидрофобная природа липидов ограничивает методологии, которые можно использовать для непосредственного исследования богатых липидами структур, таких как миелин, без использования растворителей и меток, которые могут повредить образец. Недавние сравнительные исследования традиционных липофильных красителей поставили под сомнение их специфичность. 32,33Чтобы обойти эти проблемы, рамановская спектроскопия и, в частности, когерентное антистоксово комбинационное рассеяние (CARS), была предложена в качестве привлекательной альтернативы для исследования молекулярных составляющих миелина путем исследования колебательных и вращательных мод молекул и их химических связей в пределах образец. Измерение основано на взаимодействии между возбуждающим светом и внутренними молекулярными связями в данной системе, не требуя никаких экзогенных меток или обработки образца (кроме простой фиксации). Более того, CARS чрезвычайно чувствителен к колебательным изменениям как внутри, так и между молекулами.
Извлечение и анализ данных о молекулярных колебаниях, полученных с помощью нашей методики, включал анализ каждого релевантного спектрального пикселя всей области волнового числа СН через систему классификации, которая обеспечивала скалярный индекс или патологический «балл». Посредством систематического анализа мы показываем, что перипоральное белое вещество является биохимически ненормальным с точки зрения нарушения липидов, причем такие отклонения иногда распространяются на большие расстояния ( например, образец D, рис. S1D †). Паттерны географической аномалии были специфичными для поражения и / или пациента, что позволяет предположить, что наша методика может различать тонкую биохимическую патологию, выявляя неоднородность среди субъектов, которую невозможно выявить с помощью традиционных гистологических методов. Важно отметить, что все измерения NAWM, далеко удаленные от поражений, демонстрировали стойкие липидные биохимические аномалии по сравнению со здоровым контролем, что подчеркивает идею о том, что бляшки при рассеянном склерозе, обнаруженные при обычной патологии, представляют собой только наиболее очевидное проявление гораздо более распространенной патологии ЦНС при этом заболевании.