РС является нейровоспалительным заболеванием, а флавоноиды являются иммуномодулирующими соединениями природного происхождения, которые могут ограничивать демиелинизацию, снижать нейровоспалительное состояние и снижать иммунную функцию. Исследования показали, что флавоноиды, такие как лютеолин ( 66 ) и EGCG (10 мкг / мл) ( 67 ), обеспечивают нейропротекцию, уменьшая нейровоспаление и повреждение аксонов. Кроме того, флавоноиды, такие как лютеолин, кверцетин и физетин в концентрациях 20–80 мкМ, способны уменьшать количество фагоцитозируемого макрофагами миелина, и таким образом могут предотвращать РС ( 68 ). При РС IL-1 в основном отвечает за активацию Т-клеток, а TNF-α в основном отвечает за демиелинизацию ( 69). Было обнаружено, что кверцетин контролирует иммунный ответ посредством контроля мононуклеарных клеток периферической крови IL-1 и TNF-α, выделенных от пациентов с РС ( 70 ). Потенциал флавоноидов в ограничении демиелинизации, уменьшении нейровоспаления и подавлении иммунной функции делает их выдающимися терапевтическими агентами при РС.
| Рассеянный склероз | EGCG | 10 мкг / мл | ( 67 ) |
| лютеолин | 20–80 мкМ | ( 68 ) | |
| кверцетин | 20–80 мкМ | ( 68 ) | |
| физетин | 20–80 мкМ | ( 93 ) |
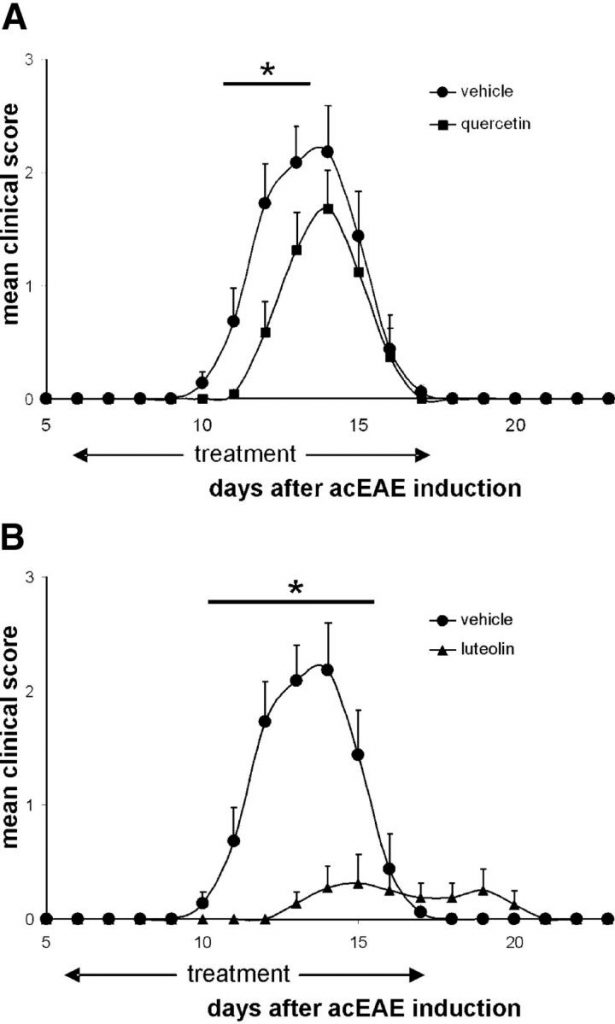
(A и B) Животным, сенсибилизированным к acEAE (
n = 11), вводили внутрибрюшинно либо кверцетин (A, n = 11), либо лютеолин (B,n = 11) с 6 дня. Как кверцетин (A, ▪), так и лютеолин ( B, ▴) лечение задержалось и значительно уменьшило клинические симптомы acEAE по сравнению с контрольными группами, получавшими носитель (A и B, •).
(C) Иммуногистохимический анализ макрофагов ED1 + в спинном мозге животных, получавших носитель, кверцетин и лютеолин, на 14 день. Первоначальное увеличение 100, контрастирующее с гематоксилином.
(D) Количественная оценка ED1 +макрофаги у трех репрезентативных крыс из каждой группы лечения.
Данные представляют собой среднее ± SEM. *, P <0,05.
Студенческий т тест.
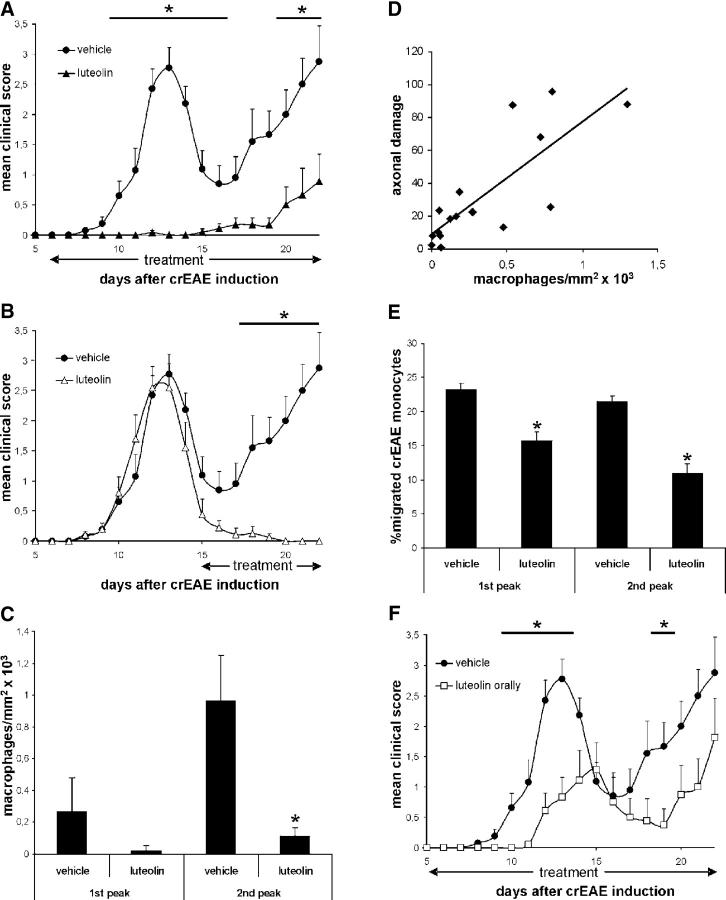
(A) животные с crEAE, получавшие внутрибрюшинное введение лютеолина (
n = 13, ▴) с 6-го дня, демонстрируют сниженные клинические признаки по сравнению с контрольными животными, обработанными наполнителем crEAE (
n = 13, •).
(B) Обработка животных с crEAE лютеолином в дозе 50 мг / кг (
n = 10, ▵) внутрибрюшинно после начала заболевания (с 15-го дня) быстро устраняла клинические симптомы по сравнению с животными, получавшими носитель (
n = 13, •), у которых развился тяжелый рецидивы.
(C) Лютеолин-обработанные животные показали пониженное количество ED1
+макрофаги в спинном мозге.
Макрофагальные инфильтраты определяли количественно у трех представительных крыс из каждой группы лечения.
(D) Количество макрофагов, присутствующих в спинном мозге крыс, получавших носитель и лютеолин, коррелировало с наличием повреждения аксонов, определяемого накоплением АРР, и оценивали с помощью рангового коэффициента корреляции Спирмена (P <0,01).
(E) Моноциты периферической крови, выделенные на 12 и 22 дни от животных с crEAE, получавших лютеолин с 6 и 15 дней соответственно, были лишены способности мигрировать через эндотелиальные клетки головного мозга in vitro по сравнению с моноцитами, полученными от контрольных животных с crEAE.
Эксперименты проводились в присутствии 50% сыворотки, полученной от тех же животных (А и В). (F) Пероральное лечение лютеолином (
n= 10, □) с 3-го дня отсроченное начало заболевания и уменьшение клинических симптомов по сравнению с контрольными животными cEAE (•).
Данные выражены как среднее значение ± SEM.
*, P <0,05. Студенческий т тест.
Мы продемонстрировали, что флавоноид лютеолин существенно подавляет клинические симптомы и предотвращает рецидив при введении до или после начала заболевания. Лечение лютеолином привело к уменьшению воспаления и повреждения аксонов в ЦНС путем предотвращения миграции моноцитов через эндотелий мозга. Лютеолин влиял на миграцию, модулируя активность Rho GTPases, сигнальных преобразователей, участвующих в трансэндотелиальной миграции. Пероральное введение лютеолина также значительно уменьшало клинические симптомы.
Молекулярные механизмы нейропротекции флавоноидами
Известно, что флавоноиды оказывают нейропротекторное действие, взаимодействуя с тканями мозга в нескольких местах. Нейропротективное действие пищевых флавоноидов включает их потенциал для защиты нейронов от окислительного стресса и повреждения нейронов благодаря их потенциалу в качестве антиоксидантов, способности подавлять нейровоспаление и возможность модулировать клеточные сигнальные пути. Флавоноиды являются хорошо известными антиоксидантами, и они могут защищать клеточные компоненты от окислительного стресса и, следовательно, снижать риск нейродегенеративных заболеваний, связанных с окислительным стрессом. Флавоноиды также защищают нейроны от некоторых нейротоксических лекарств, токсичность которых связана со стимуляцией окислительного стресса. Различные флавоноиды, такие как тангеретин ( 48 ), EGCG ( 42 ), генистеин ( 44)) и рутин ( 43 ) могут ослаблять вызванную 6-OHDA нейротоксичность при БП. Кроме того, индуцированная МРТР нейротоксичность также снижается с помощью EGCG ( 40 ) и кверцетина ( 37 ). Флавоноиды взаимодействуют не только благодаря своему антиоксидантному потенциалу в защите нейронов, но также модулируют различные пути передачи сигналов в клетках ( 3 ). Стало очевидным, что флавоноиды взаимодействуют с критическими нейрональными внутриклеточными сигнальными путями и способны оказывать нейропротекторное действие ( 11). Флавоноиды и их метаболиты могут оказывать модулирующее действие на клетки посредством воздействий на сигнальные пути протеинкиназы и липидкиназы. Ингибирующие или стимулирующие действия на этих сигнальных путях сильно влияют на функцию нейронов, изменяя состояние фосфорилирования молекул-мишеней и модулируя экспрессию генов ( 71 ). Важные пути передачи сигналов выживания клеток включают следующие: фосфатидилинозитол-3 киназа / Akt (PI3K / Akt), внеклеточная регулируемая сигналом протеинкиназа (ERK), протеинкиназа C (PKC) и пути гибели клеток p38 и c-Jun N- терминальная киназа (JNK). Различные флавоноиды взаимодействуют с этими путями и обеспечивают защиту от нейродегенерации ( рис. 1 ).
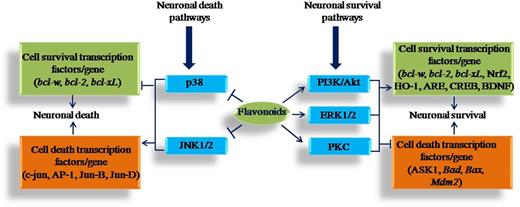
Активация путей PI3K / Akt, ERK1 / 2 и PKC стимулирует выживание нейронов путем индукции генов просурвливания или антиапоптоза и ингибирования проапоптотических белков.
JNK и p38 являются стресс-активируемыми путями и вызывают гибель нейронов посредством активации c-Jun и других белков AP-1;
они приводят к апоптозу и гибели нейронов.
Кроме того, ингибирующее действие флавоноидов на пути JNK и p38, вероятно, будет нейропротекторным при наличии сигналов стресса.
Однако флавоноиды обладают нейропротекторными и нейромодулирующими свойствами и предотвращают функцию нейронов посредством ингибирующего и стимулирующего действия на этих сигнальных путях.
АР-1, активированный белок 1;
АР, антиоксидантный ответный элемент; ASK1,
регулирующая сигнал апоптоза киназа 1;
Bad, Bcl-xL / Bcl-2-ассоциированный промотор смерти;
Bax, BCL2-ассоциированный X-белок;
bcl-w, BCL2-подобный 2; bcl-xL, BCL2-подобный 1;
bcl-2, B-клеточная CLL / лимфома 2;
BDNF, нейротрофический фактор мозга;
CREBP, белок, связывающий элемент ответа cAMP;
ERK, внеклеточная сигнально-регулируемая протеинкиназа;
HO-1, гем-оксигеназы 1; JNK, c-Jun N-терминальная киназа;
Mdm2, мышиная двойная минута 2; Nrf2, NF-E2-связанный фактор 2;
PI3K / Akt, фосфатидилинозитол-3-киназа / Akt; PKC, протеинкиназа С.
двойная минута мыши 2; Nrf2, NF-E2-связанный фактор 2;
PI3K / Akt, фосфатидилинозитол-3-киназа / Akt; PKC, протеинкиназа С.
двойная минута мыши 2; Nrf2, NF-E2-связанный фактор 2;
PI3K / Akt, фосфатидилинозитол-3-киназа / Akt; PKC, протеинкиназа С.
Было обнаружено, что флавоноиды, такие как EGCG ( 72 ) и гесперетин ( 73 ), экстракт черники, богатый флавоноидами ( 74 ), и флавоноид байкалеин ( 75 ) активируют пути PI3K / Akt, ERK и PKC. Активация путей этими флавоноидами оказывает благотворное влияние на выживание клеток за счет активизации антиапоптотических или просурвивающих генов, таких как B-клеточная лимфома 2 ( Bcl2 ), BCL2-like 2 ( Bclw ) и BCL2-like 1 ( BclxL ) ( 72 , 75 ); ингибирование проапоптотических белков (активация каспазы 9 и каспазы 3); и ингибирование апоптоз-регулирующей сигнал киназы 1 (ASK1) ( 73) и нетранскрипционное ингибирование BclxL / Bcl2 -ассоциированного промотора смерти ( Bad ), BCL2-ассоциированного Х-белка ( Bax ) и мышиной двойной минуты 2 ( M dm2 ) ( 72 ). Флавоноиды также оказывают защитное воздействие на выживание клеток благодаря механизмам, которые могут включать активацию фосфорилирования белка, связывающего элемент реакции cAMP (CREBP) ( 74 ), увеличение количества нейротрофического фактора, происходящего из мозга (BDNF) ( 74 ), и увеличение экспрессия белка, связанного с фактором транскрипции NF-E2 (Nrf2) / гемоксигеназы 1 (HO-1), и усиление транскрипционной активности элемента антиоксидантного ответа ( 75)). Стимулирующее действие всех этих флавоноидов может предотвращать нейродегенерацию и защищать функции мозга ( рис. 1 ).
JNK и p38 считаются путями гибели клеток, поскольку они прочно связаны с транскриптозависимой апоптотической передачей сигналов ( 76 ) посредством активации c-Jun ( 77 ) и других белков активированного белка 1 (AP-1), включая JunB и Джунд. Флавоноиды оказывают антиапоптотическое действие посредством ингибирования путей JNK и p38 ( рис. 1 ). Флавоноиды, такие как кверцетин ( 78 ), эпикатехин и 3′- O- метил-эпикатехин ( 79 ), и гесперетин и его структурные аналоги изорхамнетин и изосакуранетин ( 80)было обнаружено, что он ингибирует активность JNK. Кверцетин, гесперетин и его структурные аналоги изорхамнетин и изосакуранетин могут подавлять активность JNK и апоптоз, вызванный перекисью водорода ( 78 , 80 ). Эпикатехин и 3′- O- метил-эпикатехин также защищают нейроны от окислительного повреждения посредством механизма, включающего подавление JNK и его нижестоящих партнеров c-Jun и прокаспазы-3 ( 79 ). Существует очень мало исследований, которые предполагают, что флавоноиды модулируют передачу сигналов нейронов через путь р38. Путь р38 ингибируется генистеином ( 81 ) и экстрактом какао и его основным флавоноидным эпикатехином ( 82)). Genistein защищает нейроны от Aβ-индуцированной гибели клеток, предотвращая окислительный стресс, который, в свою очередь, ингибирует активацию p38, защищая нейроны от гибели клеток ( 81 ). Эпикатехин также является важным флавоноидом, который защищает от нейродегенерации, вызванной окислительным стрессом ( 82 ). Однако вышеупомянутые флавоноиды активируют или подавляют различные клеточные сигнальные пути и, таким образом, демонстрируют способность индуцировать морфологические изменения, которые оказывают непосредственное влияние на работу памяти и функцию мозга.
Предполагается, что нейровоспалительные процессы играют критическую роль в развитии различных нейродегенеративных заболеваний ( 83 ), в которых глиальные клетки играют значительную роль. Активированные глиальные клетки (микроглия и астроциты) приводят к выработке цитокинов и других медиаторов воспаления, которые могут способствовать апоптотической гибели клеток нейронов ( 84 ). Различные флавоноиды, такие как экстракты черники с высоким содержанием флавоноидов ( 85 ), лютеолин ( 86 ), кемпферол ( 87 ), вогонин, бакалеин ( 88 ), EGCG ( 89 ) и кверцетин ( 90 , 91)), было обнаружено, что они ингибируют продукцию провоспалительных медиаторов, таких как экспрессия NO, TNF-α, IL-1β и iNOS, экспрессия циклооксигеназы-2, активация NADPH-оксидазы и продуцирование активных форм кислорода. Все эти эффекты флавоноидов проявляются благодаря их способности непосредственно модулировать сигнальные пути клеток ( 3 ): например, ингибирование клеточных сигнальных каскадов, таких как p38 и ERK, посредством флавоноидов, которые контролируют экспрессию iNOS и TNF-α в активированных глиальные клетки ( 92 ). Кроме того, физетин ингибировал фосфорилирование р38 ( 93 ) Кроме того, fisetin уменьшал цитотоксичность стимулированной LPS микроглии по отношению к клеткам нейробластомы B35 в системе совместного культивирования. Эти результаты показывают, что физетин обладает сильной противовоспалительной активностью в микроглии мозга и может быть потенциальным терапевтическим средством для лечения нейровоспалительных заболеваний. Фисетин снижал цитотоксичность стимулированной ЛПС микроглии по отношению к клеткам нейробластомы В35 в системе совместного культивирования. Эти результаты показывают, что физетин обладает сильной противовоспалительной активностью в микроглии мозга и может быть потенциальным терапевтическим средством для лечения нейровоспалительных заболеваний. Фисетин снижал цитотоксичность стимулированной ЛПС микроглии по отношению к клеткам нейробластомы В35 в системе совместного культивирования. Эти результаты показывают, что физетин обладает сильной противовоспалительной активностью в микроглии мозга и может быть потенциальным терапевтическим средством для лечения нейровоспалительных заболеваний, а лютеолин ингибировал продукцию IL-6 посредством ингибирования пути JNK ( 94). Также было обнаружено, что флавоноиды предотвращают активацию транскрипционного фактора; например, кверцетин ослаблял нейровоспаление посредством механизмов, которые включали подавление транскрипции гена iNOS путем ингибирования NF-κB, который ответственен за транскрипцию iNOS ( 90 ). Таким образом, все эти молекулярные механизмы предполагают, что флавоноиды могут обладать терапевтическим потенциалом в поддержании оптимальной функции нейронов и нейрокогнитивных функций при различных нейродегенеративных заболеваниях.
Выводы
Пищевые добавки с флавоноидами показали несколько нейропротекторных действий в мозге, включая предотвращение токсичности в отношении различных нейротоксинов, уменьшение нейровоспалительного и окислительного стресса, а также способность улучшать память и улучшать когнитивные функции. Эти полезные эффекты на функцию мозга модулируются механизмами, которые включают взаимодействие с ключевым нейрональным сигнальным процессом, приводящим к экспрессии генов выживания и дифференцировки нейронов и подавлению генов, ответственных за нейродегенерацию. Таким образом, регулярное добавление в пищу продуктов, богатых флавоноидами, на соответствующей стадии нейродегенерации обещает стать естественным средством для предотвращения многих нейродегенеративных заболеваний и улучшения когнитивных и других функций мозга.












