Считается, что ремиелинизация ЦНС при рассеянном склерозе важна для восстановления проводимости и защиты аксонов от дегенерации. И все же роль ремиелинизации в клиническом восстановлении функции остается недоказанной. Здесь мы показываем, что у кошек, получавших облученную диету во время беременности, развилось тяжелое неврологическое заболевание, возникающее в результате интенсивной вакуолизации миелина и последующей демиелинизации. Несмотря на тяжелую миелиновую дегенерацию, аксоны оставались практически нетронутыми. Был отмечен быстрый эндогенный ответ клеток линии олигодендроцитов на демиелинизацию, причем ремиелинизация происходила одновременно.Кошки, которые были возвращены к нормальной диете, восстанавливались медленно, так что к 3-4 месяцам они были неврологически нормальными.Гистологическое исследование ЦНС в этот момент показало обширную ремиелинизацию, что было особенно заметно в зрительном нерве, где почти весь нерв был ремиелинизирован. Биохимический анализ рациона и тканей пораженных кошек не выявил дефицита рациона или накопления токсических веществ. Таким образом, хотя этиология этого замечательного заболевания остается неизвестной, она однозначно показывает, что при сохранении аксонов ремиелинизация является основным путем в ЦНС при неиммунно-опосредованном демиелинизирующем заболевании. Самое главное, это подтверждает клиническую значимость ремиелинизации и ее способность восстанавливать функции.
Демиелинизация ЦНС является основной патологической находкой при многих приобретенных и унаследованных неврологических расстройствах человека. Рассеянный склероз (MS), в частности, характеризуется острой и хронической демиелинизацией, которая приводит к замедлению или блокированию нервной проводимости с последующей неврологической дисфункцией. Как острая, так и хроническая демиелинизация могут привести к потере аксонов с возможным клиническим прогрессированием заболевания до хронической стадии, с которой клиническое выздоровление не происходит. ЦНС может реагировать на демиелинизацию путем эндогенного восстановления или ремиелинизации, с восстановлением нервной проводимости к пораженным волокнам ( 1 ). Ремиелинизация также приведет к защите демиелинизированных нервных волокон от их потери при продолжающемся заболевании, как было показано как при MS ( 2 ), так и на экспериментальной модели демиелинизации мозолистого тела ( 3 ). Тем не менее, остается недоказанным, может ли только ремиелинизация привести к полному функциональному восстановлению, особенно если задействованы обширные области ЦНС. Было высказано предположение, что другие механизмы, такие как пластичность нервных волокон посредством перераспределения натриевых каналов Nav 1.6 и 1.2, могут восстанавливать проводимость к демиелинизированным аксонам и могут также быть важными для функционального восстановления ( 4 ).
На сегодняшний день нет моделей неврологической дисфункции, вызванной широко распространенной демиелинизацией ЦНС, которые однозначно определяют ремиелинизацию как механизм функционального восстановления. Здесь мы опишем модель у кошки, в которой тяжелая неврологическая дисфункция, включая атаксию, парез, паралич и потерю зрения, наблюдается у беременных кошек, получавших облученную диету. Удаление этой диеты приводит к отсроченному, но полному неврологическому выздоровлению, связанному с обширной ремиелинизацией по всему спинному мозгу и по всему зрительному нерву. Аксоны остаются в основном неповрежденными, доказывая, что только ремиелинизация больших областей ЦНС может восстановить функцию. Это открытие подтверждает, что ремиелинизация должна быть основной терапевтической мишенью при РС и наследственных миелиновых нарушениях у человека.
РЕЗУЛЬТАТЫ
Клинические признаки.
Неврологическая дисфункция началась приблизительно через 4 месяца после введения облученной диеты и представляла собой медленно прогрессирующее расстройство. У кошек развилась атаксия и парез задних конечностей. Эти признаки ухудшились, и у 2 кошек появилась паралич. У некоторых кошек зрение, проверенное рефлексом угрозы, было снижено или потеряно. Таким образом, неврологическое исследование показало, что эти нарушения были вызваны главным образом заболеванием спинного мозга с поражением зрительного нерва. В течение 2–4 месяцев кошки, которых вернули на необлученную диету, постепенно восстанавливали амбулаторное состояние и проходили нормальное неврологическое обследование с нормальным зрением.
Патологические изменения во время неврологической дисфункции.
В ходе наблюдения за этим заболеванием были изучены пораженные ткани от 10 кошек во время активного заболевания. Грубые повреждения не были обнаружены ни в головном, ни в спинном мозге, ни в других органах ни у одной из кошек. Первичной аномалией в головном мозге и особенно в спинном мозге была белая маточная вакуоль. Спинной мозг поражен на всех уровнях, но наиболее заметно в вентральном и латеральном столбцах, где демиелинизированные аксоны всех размеров были видны разбросанными по всему нейропилю ( рис. 1 ). В дорсальных столбах в некоторых случаях была отмечена лишь легкая вакуолизация в фасцикуле кинеатусе. Тем не менее, у некоторых кошек в дорсальных столбах наблюдались изменения, аналогичные изменениям в остальной части белого вещества позвоночника, и демиелинизированные аксоны можно было наблюдать в больших группах ниже пии ( рис. 1 ). Примечательно, что, несмотря на сильную вакуолизацию, аксоны оказались неповрежденными в дегенерирующих миелиновых оболочках; часто макрофаги, связанные с остатками миелина, были замечены в вакуолях ( рис. 1 ). Сохранение аксонов было подтверждено на окрашенных серебром срезах (см. Рис. S1 ). Хотя вакуолизация и демиелинизация были глубокими, аксоны с тонкими миелиновыми оболочками, указывающими на ремиелинизацию, также были распространены в областях миелиновой дегенерации. Ремиелинизация была особенно выраженной в дорсальной колонке у некоторых кошек, где было отмечено множество аксонов малого диаметра с тонкими миелиновыми оболочками при наличии продолжающегося разрушения миелина. У кошек, которые потеряли зрение, зрительные нервы показали обширную миелиновую дегенерацию с небольшим количеством оставшихся неповрежденными миелиновых волокон ( рис. 2 ). Эти изменения были более серьезными, чем в спинном мозге, с демиелинизированными аксонами по всему зрительному нерву, связанными с миелиновыми макрофагами ( рис. 2 ).
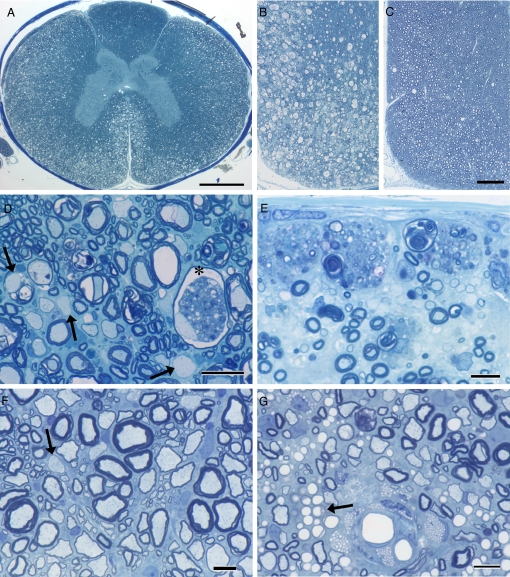
Демиелинизация и ремиелинизация в спинном мозге. Во время острого заболевания обширные изменения наблюдаются в белом веществе спинного мозга ( A , B , D и E ). В шейном отделе миелиновой вакуолизации можно наблюдать по всей боковой и вентральной колоннам ( A и B ) и при большей мощности ( D ). Глубокая белая материя и дорсальный столб менее затронуты ( A ). Вакуолизация миелина неизбежно приводила к демиелинизации, но без потери аксонов ( D ). В одном миелинизированном аксоне миелиновый мусор присутствует рядом с интактным аксоном (*); другие аксоны можно увидеть в соседних волокнах, подвергающихся миелиновой вакуолизации. Существуют многочисленные разбросанные ремиелинизированные аксоны (тонкие миелиновые оболочки) и два демиелинизированных аксона ( D , стрелки). В дорсальной колонке второго кота макрофаги, заполненные миелиновым мусором, выстилают пиа над многочисленными соседними демиелинизированными аксонами. В отличие от этого, кошка, которой в течение 6 месяцев давали нормальную диету, показала почти полное восстановление миелина ( C и F ). Несколько вакуолей сохранялось, и плотность миелинизированного волокна была нормальной ( С ). При более высокой мощности ( F ) можно видеть, что многие волокна всех диаметров были ремиелинизированы с оставшимися только редкими демиелинизированными аксонами (стрелка). У 2 кошек, хотя ремиелинизация также была обширной в дорсальных колоннах ( G ), многочисленные макрофаги, заполненные липидами, сохранялись рядом с кровеносными сосудами, хотя также присутствовали многие ремиелинизированные аксоны.Также, по-видимому, имеются скопления капилляров, прилегающих к этим макрофагам (стрелка). Толуидин синий. (Шкала: A , 1,0 мм; B и C , 200 мкм; D, 20 мкм; E – G , 10 мкм.)
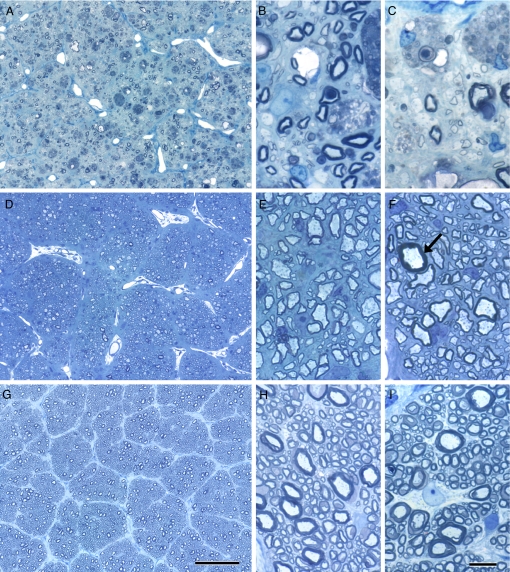
Изменения зрительного нерва во время активной болезни ( A – C ), во время выздоровления ( D – F ) и в контроле ( G – I ). В центре зрительного нерва ( A ) наблюдается почти полная потеря миелина, что свидетельствует об изменениях по всему зрительному нерву от субпиальной области ( B ) до центра нерва ( A и C ). Немногие миелинизированные волокна остаются со многими демиелинизированными аксонами (стрелки) и частыми наполненными миелином макрофагами ( В и С ). Напротив, зрительный нерв у выздоровевшей кошки, по-видимому, имеет почти нормальную плотность миелинизированных аксонов ( D – F ), хотя практически все миелиновые оболочки тонкие, как по сравнению с субпиальным ( E ), так и в центре нерва (F ). с контрольным зрительным нервом кошки ( G – I ), взятым на тех же уровнях, что и пораженные и выздоровевшие кошки ( A – F ). Единственное волокно с неповрежденной, толстой миелиновой оболочкой ( F , стрелка) представляет собой единственный аксон, не ремиелированный. Толуидин синий. (Шкала: A , D и G , 100 мкм; B , C , E , F , H и I , 10 мкм.)
В головном мозге у всех 10 обследованных кошек отмечалась различная степень вакуолизации белой матки в лучистой короне и голени головного мозга. Это открытие было отмечено, хотя и менее выраженным, в мозолистом теле у 2 кошек, а также в нижних мозжечковых ножках, каудальных колликулах и пирамидном или медиальном расслаивании в отдельных случаях ( рис. S2 ). Реактивный астроглиоз наблюдался у всех кошек, в большинстве случаев с макрофагом / микроглиозом. Как в головном, так и в спинном мозге наблюдалась нечастая периваскулярная манжета, состоящая преимущественно из макрофагов с менее частыми лимфоцитами и плазматическими клетками. В отличие от широко распространенной вакуолизации в ЦНС, никаких признаков миелиновой патологии в периферической нервной системе обнаружено не было.
Миелиновая оболочка меняется после выздоровления.
В 2 случаях кошки, которых больше не кормили облученной пищей в течение по крайней мере 6 месяцев и которые клинически оправились от параплегии и слепоты до состояния амбулаторного состояния и со зрением, были изучены морфологически. Примечательно, что, по-видимому, наблюдается почти полное разрешение вакуолизации и демиелинизации как в спинном мозге, так и в зрительном нерве ( рис. 1 и 2). 2 ) В вентральной колонне было много рассеянных, тонко миелинизированных (ремиелинизированных) аксонов, присутствующих только с несколькими оставшимися миелиновыми вакуолями и редкими демиелинизированными аксонами ( рис. 1 ). Важно отметить, что плотность миелинизированных аксонов оказалась нормальной.Подсчет количества ремиелинизированных аксонов в белом веществе показал, что у первой кошки 46%, 58% и 53% аксонов в вентральном и латеральном белом веществе шейного, грудного и поясничного отдела, соответственно, были ремиелинизированы по сравнению с 46%, 41% и 30% аксонов у второй кошки. В зрительном нерве плотность миелинизированных аксонов также выглядела нормальной, но большинство аксонов по всему нерву имели тонкие миелиновые оболочки по сравнению с неповрежденным нервом (т.е. все они были ремиелинизированы) ( рис. 2 ). Разбросанные аксоны с толстыми миелиновыми оболочками, которые предположительно не были демиелинизированы, подтвердили, что большинство были ремиелинизированы. Это было подтверждено количественным определением, в котором убедительно показано, что большинство аксонов зрительного нерва имеют тонкие миелиновые оболочки ( рис. 3 ).Соотношение g в обоих участках зрительных нервов (центральное и субпиальное) значительно отличалось от контроля; средние значения составили 0,789 и 0,793 от пораженной кошки и 0,654 и 0,677 от контроля.Случайные демиелинизированные аксоны все еще присутствовали.Единственным белым веществом, которое, по-видимому, имеет стойкий дефект, несмотря на клиническое разрешение, была область в центральной дорсальной колонке, где были видны рассеянные демиелинизированные волокна вместе со многими пенистыми макрофагами ( рис. 1 ). В этих областях нейропил оказался глиотическим, и была очевидна некоторая потеря аксонов.
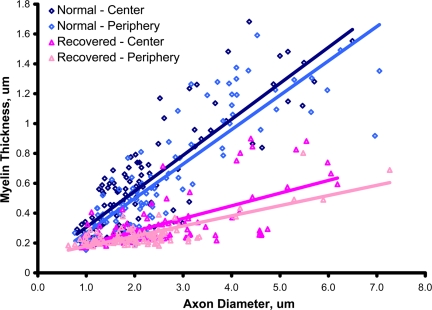
Толщина миелиновой оболочки уменьшается по зрительному нерву. График толщины миелиновой оболочки против диаметра аксона демонстрирует значительную разницу как на периферии, так и в центре нерва. Линии регрессии у = 0,241 х + 0,0648 ( R 2 = 0,6926) для нормального центра; y = 0,2304 x + 0,0376 ( R 2 = 0,7428) для нормальной периферии; y = 0,0851 x + 0,1088 ( R 2 = 0,4111) для восстановленного центра; и y = 0,0681 x + 0,1096 ( R2 = 0,6018) для восстановленной периферии. Различия между g- отношением дикого типа и восстановленным g- соотношением как в центре, так и на периферии нерва были рассчитаны как значимые с помощью критерия суммы рангов Манна-Уитни ( P <0,001).
ОБСУЖДЕНИЕ
Представленные здесь данные предоставляют убедительные доказательства того, что глобальная ремиелинизация ЦНС при тяжелом демиелинизирующем расстройстве может обеспечить полное восстановление клинической функции. Ремиелинизация в этой модели кошки включала весь спинной мозг и зрительный нерв и, вероятно, также некоторые пораженные участки головного мозга. Хотя связь между облученной диетой, беременностью и обширной дегенерацией миелина остается неизвестной, это заболевание кошачьих служит отличной моделью для будущего изучения эндогенной ремиелинизации in vivo с использованием современных методов визуализации и изучения клеточных и молекулярных аспектов, которые способствуют восстановлению.
Окончательное доказательство того, что ремиелинизация приведет к восстановлению функции при рассеянном склерозе, было в значительной степени косвенным ( 5 ), и на экспериментальных моделях демиелинизации не было продемонстрировано восстановление с точки зрения неврологической инвалидности. При воспалительных заболеваниях ЦНС, таких как МС, и экспериментальном аутоиммунном энцефаломиелите, сопутствующие факторы в патологической среде, которые включают демиелинизацию, воспаление, глиоз и потерю аксонов, затрудняют приписывание выздоровления разрешению какого-либо одного или всех этих параметров. Другие модели на животных, такие как токсичность купризона, полезны для изучения демиелинизации и ремиелинизации ( 6 ), однако животные, получающие купризон и другие миелинотоксические химические вещества, не демонстрируют явной и явной неврологической дисфункции. У мышей, инфицированных вирусом Тейлера ( 7 ), и в очаговых демиелинизированных поражениях, возникающих в результате инъекции бромида этидия ( 8 ), для выявления улучшений, связанных с ремиелинизацией, использовались поведенческие тесты (ротация и ходьба луча). Однако первоначальный дефицит не был клинически явным в каждом случае, и восстановление не обязательно было полным. Аналогичным образом, после приема купризона использовалось усовершенствованное поведенческое тестирование, чтобы показать улучшение при ремиелинизации ( 9 ). Явное различие в нашей модели состоит в том, что кошки выздоровели от тяжелого парапареза или даже параплегии и нарушения зрения до неврологического нормального состояния. Похоже, что заболевание, которое мы описываем здесь, требует некоторого времени для развития и разрешения. Потребовалось 3–4 месяца приема облученной диеты для развития неврологических признаков и такое же время возобновления нормальной диеты для развития и разрешения заболевания. Что касается восстановления, несмотря на тот факт, что активная ремиелинизация происходила параллельно с демиелинизацией, возможно, что разрушение миелина продолжалось некоторое время после прекращения диеты, поскольку для клинического выздоровления потребовалось 3-4 месяца.Альтернативно, ремиелинизация могла быть отсрочена, но это кажется менее вероятным, учитывая заметную ремиелинизирующую активность, наблюдаемую во время активного заболевания. Для ответа на этот вопрос понадобятся дальнейшие исследования, изучающие различные моменты времени после прекращения облученной диеты.
Было показано, что восстановление миелиновой оболочки как эндогенными клетками-предшественниками олигодендроцитов (OPC), так и из экзогенных источников OPCs или клеток Шванна однозначно восстанавливает проводимость в пораженных волокнах ( 10 , 11 ). Ясно, что получающиеся тонкие миелиновые оболочки и более короткие междоузлия поддерживают быструю и надежную солевую проводимость даже в аксонах с всего лишь 5 ламелями ( 12 ). Таким образом, с физиологической точки зрения ремиелинизация важна. Однако это не единственное средство выздоровления, поскольку перераспределение натриевых каналов может также способствовать более медленной (непрерывной) проводимости, возможно, формируя основу для пластичности ЦНС при демиелинизирующем заболевании ( 4 ). Перераспределение ионных каналов в этой модели может быть маловероятным, учитывая очевидное быстрое повторное миелинирование, которое уменьшит потребность в перераспределении Na-каналов для стимулирования проводимости. В модели кошек у выздоровевших кошек явно отмечалась распространенная ремиелинизация с очень небольшим количеством устойчивых демиелинизированных аксонов, что подтверждает, что ремиелинизация была основой клинического выздоровления. Мы также подтверждаем, что тонко миелинизированных аксонов достаточно для нормального функционирования.
Специфичность миелиновой оболочки как мишени при этом заболевании замечательна. Несмотря на сильную миелиновую вакуолизацию, аксоны оказались почти полностью незатронутыми с результирующей обширной демиелинизацией. Окончательное подтверждение этому дают две выздоровевшие кошки, у которых плотность миелинизированных аксонов оказалась нормальной как в спинном, так и в зрительном нерве.Единственным исключением из этого является фасцикул грацилиз спинного мозга, где наблюдается некоторая потеря аксонов и постоянная демиелинизация, что свидетельствует о возможном снижении поступления OPC на этот сайт. Неудача полного удаления миелиновых остатков могла препятствовать восстановлению миелина ( 13 ) и выживанию аксонов.Поскольку функция аксонов в этой части пуповины является проприоцептивной, неудивительно, что эти хронические поражения не приводили к клиническому дефициту. Активная ремиелинизация, которая наблюдалась во время острого заболевания, была замечательной. Таким образом, эндогенные клетки у кошки могут быстро реагировать на демиелинизацию. Хотя источник этих клеток неизвестен, имеются убедительные доказательства ( 14 , 15 ), что OPC существует в ЦНС взрослой кошки, в частности в зрительном нерве, и является весьма вероятным источником ремиелинизирующих олигодендроцитов при очаговых поражениях. Однако здесь, по-видимому, происходит небольшая клеточная гибель, с лишь редкими TUNEL-меченными клетками, поэтому возникает вопрос о том, играют ли зрелые олигодендроциты, лишенные своих миелиновых оболочек, какую-либо роль в восстановлении. Это бросит вызов общепринятому мнению, согласно которому ремиелинизация является следствием только пролиферации и дифференцировки OPC, а не взрослых олигодендроцитов ( 16 ), которые, несмотря на одно сообщение ( 17 ), считаются постмитотическими.
Предыдущий отчет о кошках, получавших облученную диету, показал некоторые изменения, подобные описанным здесь, с широко распространенным вакуолизацией белого вещества ( 18 ). Тем не менее, существуют значительные различия, включая, в нашем случае, связь между беременностью и развитием болезни. Кроме того, Cassidy et al. ( 18 ) описали преимущественно аксональное заболевание, тогда как здесь показано, что миелин является мишенью. У норвежской чернобурки зарегистрировано наследственное заболевание, приводящее к широко распространенной вакуолизации с демиелинизацией и ремиелинизацией. Тем не менее, распределение миелиновой вакуолизации отличается, и есть другие отличия от кошачьего расстройства ( 19 ). Миелиновая вакуолизация — это неспецифическая находка, наблюдаемая во многих других патологиях ЦНС: от мутаций митохондриальной ДНК у людей ( 20 ) и животных ( 21 ) до широкого спектра нейротоксических расстройств, включая интоксикацию гексахлорфеном и триэтилоловом ( 22 ). Однако ключевое различие между этими расстройствами и описанным здесь заключается в том, что вакуолизация миелина приводит к незначительной демиелинизации по сравнению с моделью кошки. Механизмы повреждения миелиновой оболочки или олигодендроцитов, наблюдаемые при этих различных расстройствах, по-видимому, различны и еще предстоит определить.
www.ncbi.nlm.nih.gov/pmc/articles/PMC2672502/