Нейровоспалительное заболевание — рассеянный склероз (MS) — вызвано аутоиммунной патологией центральной нервной системы. Однако триггер аутоиммунного патогенного процесса неизвестен. Модели рассеянного склероза у иммунологически наивных грызунов, не содержащих специфических патогенов, поддерживают экзогенный триггер, такой как инфекция. Обоснованность этой патогенетической концепции «извне-внутрь» для MS часто ставится под сомнение из-за трудности перевода патогенных концепций, разработанных в этих моделях, в эффективные методы лечения пациентов с MS. Исследования на хорошо проверенных моделях рассеянного склероза приматов, не относящихся к человеку, где, как и у людей, аутоиммунный патогенный процесс развивается из опытной иммунной системы, обученной предшествующими инфекциями, скорее поддерживают эндогенный триггер.
Рассмотренные здесь данные подтверждают обоснованность этой вывернутой наизнанку патогенетической концепции рассеянного склероза. Они также обеспечивают правдоподобную последовательность событий, напоминающую теорию первичного поражения Уилкина: (i) аутоиммунитет — это физиологический ответ иммунной системы против избыточного обмена антигена в пораженной ткани (первичное поражение) и (ii) индивидуумы, у которых развивается аутоиммунное заболевание, являются (генетически предрасположенные) высокий ответ на критические антигены.
Данные, полученные в головном мозге с рассеянным склерозом, показывают присутствие в обычно появляющемся белом веществе миелинизированных аксонов, где миелиновые оболочки локально отделились от обернутого ими аксона (т. Е. Образовались пузыри). Последующая дезинтеграция аксон-миелиновых единиц потенциально вызывает избыточное системное высвобождение посттрансляционно модифицированного миелина.
Первичное поражение: данные о предиммунных аномалиях мозга при рассеянном склерозе
Растущее количество данных микроскопических исследований показывает структурные аномалии в нормально выглядящих частях белого вещества мозга (NAWM), которые не обнаруживаются в здоровом мозге. Недавние исследования выявили типичное набухание аксон-миелиновых единиц. Хотя они довольно часто встречаются в стареющем головном мозге, а также при нейровоспалительных (MS, энцефалит) и нейродегенеративных (Альцгеймер) расстройствах, мы обнаружили, что при РС преобладает один тип опухоли, а именно «волдыри», образованные очаговыми отслоениями миелиновые оболочки от нормальных явившехся аксонов (Рисунок. 2). Причина образования пузырей миелина неизвестна и является предметом наших текущих исследований. Возникает соблазн предположить, что набухание аксон-миелиновых единиц может быть причинно связано с недавно задокументированными нарушениями нервного развития и энергетического метаболизма.
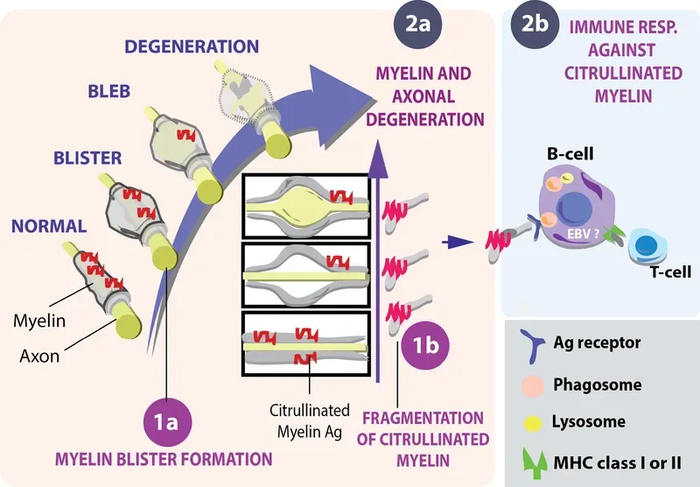
Типы набухания аксон-миелиновой единицы.
На рисунке 1а показаны три типа набухания миелинизированных аксонов, идентифицированных в нормальном белом веществе РС, расположенные в предполагаемой последовательности: нормальная единица аксон-миелин => отслоение миелина от аксона (волдырь) => набухание демиелинизированного сегмента аксона ( bleb) => дегенерация аксона и миелина, приводящая к высвобождению миелиновых остатков (1b).
В областях, обогащенных такими набуханиями, белки миелина посттрансляционно модифицируются цитруллинированием, то есть ферментативным замещением положительно заряженного аргинина на нейтрально заряженный цитруллин. 2b.
Миелиновые остатки, содержащие цитруллинированный MOG, захватываются EBV-инфицированными В-клетками и обрабатываются внутриклеточно в фаголизосомных компартментах.
Представление сильно иммуногенного цитруллинированного MOG приводит к аутореактивной активации Т-клеток.
Вокруг и внутри миелиновых пузырей была обнаружена сильная тканевая иммунореактивность с mAb, обнаруживающим цитруллинированные белки, что указывает на посттрансляционную модификацию белков миелина. Эти изменения происходят в отсутствие инфильтрированных иммунных клеток или микроглии, экспрессирующей HLA-DR, что позволяет предположить, что миелиновые пузыри возникают в результате эндогенного патологического процесса, предшествующего аутоиммунной атаке. Эти данные, по-видимому, подтверждают наблюдение, что распад миелиновых оболочек, охватывающих аксоны, при MS начинается не на поверхности оболочки, как можно было бы ожидать в случае аутоиммунной атаки со стороны иммунных факторов, вторгающихся в ЦНС, а на внутренних ламеллах. намекая на дефектное аксон-миелиновое взаимодействие.
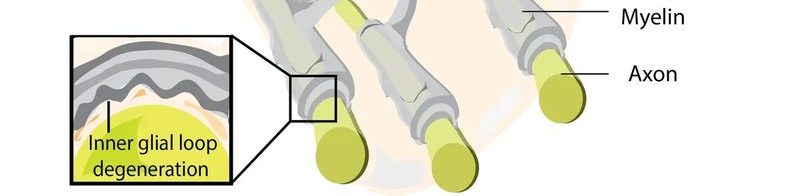
На молекулярном уровне в NAWM образуются пузырьковые набухания, демонстрирующие, помимо других морфологически значимых изменений (например, набухание аксонов), измененную экспрессию адгезионных и связывающих белков, таких как контактины, которые обеспечивают стабильность аксон-миелиновых единиц, и связывающий сиаловую кислоту лектин-миелин-ассоциированный гликопротеин (MAG / Siglec4), который опосредует компактное связывание внутренних миелиновых пластинок с ганглиозидами на поверхности аксона. Свидетельства также указывают на изменение полярности миелина, связанное с опухолью.
Мы полагаем, что миелиновые пузыри являются ранним признаком дегенерации миелина, из которого высвобождаются фрагменты, несущие цитруллинированные антигены. Свободные фрагменты миелина действительно были обнаружены в мозговых оболочках и дренажных жидкостях мозга, страдающего рассеянным склерозом. Интересно, что лептоменинги в мозге с рассеянным склерозом демонстрируют выраженное окрашивание на цитруллин. Следует отметить, что посттрансляционная модификация аутоантигена цитруллинированием (измененное «я») является приемлемым объяснением их иммуногенности.
Еще одна интригующая особенность — наличие небольших скоплений микроглии (узелков), сосредоточенных на дегенерирующем аксоне. Причина дегенерации аксонов до сих пор неясна. Исследования на модели EAE приматов, не относящейся к человеку, где такие структуры также были обнаружены, выявили присутствие IL- 1β в подмножестве кластеров микроглии, что указывает на активацию инфламмасом. Эта функция позволяет микроглии поддерживать воспалительную активность аутореактивных Т-клеток против миелина. Концептуально комбинация свободного миелинового антигена и активированного APC, которые присутствуют до аутоиммунной атаки, обеспечивает благодатную почву для реактивации периферически активированных инфильтрирующих Т-клеток.
Обсуждение
Данные, обсуждаемые в этой публикации, склоняют чашу весов к представлению о том, что основной патогенный процесс при MS по существу представляет собой последовательность событий изнутри наружу. Очевидно, это не исключает того, что рецидивы могут быть спровоцированы экзогенными факторами, такими как инфекции или стрессовые жизненные события, как предложено в Ref. [58 , 59 ].
Представленная здесь концепция патогенности MS «наизнанку» имеет значение для лечения MS. Важной особенностью концептуального первичного поражения является то, что миелиновые антигены посттрансляционно модифицируются цитруллинированием. Из ответственного фермента пептидиларгининдеиминазы (PAD) выделяют 5 изоформ, которые имеют различное тканевое распределение: PAD2 активен в ЦНС, а PAD4 активен в иммунных клетках. Ингибирование PAD в качестве терапии MS будет сложной задачей с точки зрения их роли в нормальной физиологии кожи и иммунной системе. Более безопасный подход может заключаться в том, чтобы проверить, какие из лекарств, используемых в настоящее время для лечения рассеянного склероза, можно безопасно применять для подавления активности PAD.
Это сложная перспектива для смягчения гиперреактивного состояния иммунной системы. Основываясь на центральной патогенной роли CalHV3-инфицированных B-клеток в модели EAE мартышки, мы предположили, что EBV-инфицированные B-клетки могут быть ахиллесовой пятой патогенного процесса MS и по этой причине могут быть основной целью иммунотерапии. Недавно опубликованные данные Пендера и его соавторов иллюстрируют замечательные клинические эффекты, которые могут быть достигнуты при MS за счет физического истощения В-клеток, инфицированных EBV.
Заключение
Обсуждаемые здесь данные подчеркивают актуальность теории первичного поражения Уилкина для понимания аутоиммунитета при MS. Главный кандидат на концептуальное «первичное поражение» — это поврежденный аксон-миелиновый блок (пузыри и пузырьки), который можно повсеместно обнаружить в NAWM. Миелин, связанный с этим ранним повреждением ЦНС, посттрансляционно модифицируется цитруллинированием. Мы утверждаем, что цитруллинированные фрагменты миелина, высвобождаемые из первичного поражения, вызывают вторичную атаку ЦНС гиперреактивными аутоагрессивными Т-клетками, присутствующими в иммунном репертуаре. Модель EAE мартышки подтверждает глубокие последствия цитруллинирования для патогенности иммунодоминантного миелинового антигена MOG.
В модели EAE мартышки иммунодоминантным миелиновым антигеном является MOG, но при РС другие миелиновые антигены могут играть основную патогенную роль.
© 2021 Авторы. Анналы клинической и трансляционной неврологии, опубликованные Wiley Periodicals LLC от имени Американской неврологической ассоциации.
Источник pubmed.ncbi.nlm.nih.gov/34156169/












