В настоящее время одобрено три пероральных препарата для лечения рассеянного склероза (РС). Два из этих лекарств, финголимод и терифлуномид, считаются противовоспалительными средствами, в то время как диметилфумарат (ДМФ), как полагают, вызывает устойчивый антиоксидантный ответ, защищая уязвимые клетки во время атаки рассеянного склероза. Ранее мы предположили, что эпсилон-токсин кишечной бактерии Clostridium perfringens может инициировать вновь формирующиеся очаги рассеянного склероза из-за его тропизма к сосудистой сети гематоэнцефалического барьера (ГЭБ) и миелину центральной нервной системы. Поскольку микробиота кишечника будет подвергаться пероральному лечению до системной абсорбции, мы попытались определить, влияют ли эти соединения на рост C. perfringens in vitro.. Здесь мы показываем, что финголимод, терифлуномид и ДМФ действительно подавляют рост C. perfringens . Кроме того, несколько соединений, сходных с ДМФА по химической структуре, а именно α, β ненасыщенные карбонилы, также известные как акцепторы Михаэля, ингибируют C. perfringens . Сфингозин, гомолог финголимода с известными антибактериальными свойствами, оказался мощным ингибитором C. perfringens с минимальной ингибирующей концентрацией, аналогичной таковой у финголимода. Эти результаты показывают, что одобренные в настоящее время пероральные препараты для лечения рассеянного склероза и структурно родственные соединения обладают антибактериальными свойствами, которые могут изменять микробиоту кишечника. Кроме того, ингибирование C. perfringens рост и, как следствие, блокада выработки эпсилон-токсина могут способствовать клинической эффективности этих модифицирующих болезнь лекарств.
Вступление
Рассеянный склероз (РС) является наиболее распространенным нетравматическим неврологическим заболеванием молодых людей в Западной Европе и Северной Америке ( Conway and Cohen, 2010 ). Хотя традиционно считается аутоиммунным заболеванием, которое конкретно нацелено на миелин центральной нервной системы ( Frohman et al., 2006 ), исследователи все чаще придерживаются идеи о том, что взаимодействия хозяин-патоген могут играть роль в процессе болезни MS ( Collins et al., 2012 г.). Действительно, в настоящее время ведутся исследования того, как микробиота кишечника может вызывать или модулировать рецидивы рассеянного склероза. С появлением первых пероральных препаратов для лечения рассеянного склероза, финголимода, терифлуномида и диметилфумарата (ДМФ) возникает резонный вопрос. Обладают ли эти пероральные препараты антибактериальными свойствами, и если да, может ли модуляция кишечных бактерий способствовать защите от рецидива рассеянного склероза?
Ранее мы предположили, что бактериальный нейротоксин, эпсилон-токсин, из анаэробной кишечной бактерии Clostridium perfringens , может играть ключевую роль в запуске вновь формирующихся очагов рассеянного склероза ( Rumah et al., 2013 , 2015 ; Linden et al., 2015 ). Эпсилон-токсин (ЕТХ) является рациональным кандидатом в триггер РС из-за его тропизма к гематоэнцефалическому барьеру (ГЭБ) и миелиновой оболочке; оба из них специфически повреждаются во время каждого рецидива рассеянного склероза ( Dorca-Arévalo et al., 2008 ; Rumah et al., 2013 ; Linden et al., 2015). Примечательно, что новообразованные очаги РС демонстрируют доказательства разрушения ГЭБ, гибели клеток олигодендроцитов и ранней активации микроглии в отсутствие периферического воспалительного инфильтрата ( Barnett and Prineas, 2004 ). Хотя триггерный агент этих ранних патологических изменений остается неизвестным, эпсилон-токсин C. perfringens служит провокационным кандидатом из-за его тканевой специфичности и вытекающей из этого механистической достоверности ( Rumah et al., 2013 , 2015 ; Linden et al., 2015 ).
C. perfringens — анаэробная, спорообразующая, грамположительная палочка, которая подразделяется на пять различных токсинотипов на основе дифференцированного производства экзотоксина (Таблица 1 ). C. perfringens типа A обычно колонизирует кишечник человека с распространенностью 63% среди здоровых людей ( Carman et al., 2008 ), в то время как C. perfringens типов B и D, продуценты ETX, обычно обнаруживаются в кишечнике жвачных животных. животные, такие как овцы, козы и крупный рогатый скот, но не люди ( Popoff, 2011 ). Токсин ЕТХ представляет собой мощный нейротоксин, секретируемый в виде неактивного предшественника массой 33 кДа во время фазы логарифмического роста C. perfringens.в кишечнике млекопитающих. Этот малоактивный предшественник расщепляется кишечным трипсином, химотрипсином и / или дополнительным клостридиальным экзотоксином, ламда-токсином. Продукт ферментативного расщепления 28,6 кДа проникает в эпителий кишечника, попадает в кровоток и связывается с рецепторами на просветной поверхности эндотелиальных клеток головного мозга. После связывания с микрососудами мозга ЕТХ олигомеризуется и образует гептамерную пору в плазматической мембране эндотелиальных клеток. Повреждение эндотелиальных клеток головного мозга приводит к разрушению ГЭБ ( Popoff, 2011 ). Было обнаружено, что помимо известного воздействия на сосудистую сеть ГЭБ, ETX специфически связывается с миелином и повреждает его при инкубации с срезами мозга млекопитающих ( Dorca-Arévalo et al., 2008 ; Linden et al., 2015 ; Wioland et al., 2015).). Эта уникальная способность специфически взаимодействовать с тканями, поврежденными при РС, ГЭБ и миелине ЦНС, делает его многообещающим кандидатом в качестве триггера РС окружающей среды.ТАБЛИЦА 1
Таблица 1. Токсинотипы, генотипы и ассоциированные заболевания Clostridium perfringens .
Финголимод был первым пероральным препаратом, одобренным для лечения РС. Он был рационально сконструирован из противогрибковой молекулы мириоцина, которая, как позже было показано, обладает иммунодепрессивными свойствами. Финголимод и мириоцин структурно гомологичны сфингозину, липиду, который является необходимым компонентом сфинголипидов клеточных мембран ( Strader et al., 2011 ). Как и мириоцин, сфингозин также обладает антимикробными свойствами. Однако, хотя мириоцин обладает противогрибковым действием, сфингозин обладает антибактериальными свойствами ( Fischer et al., 2012 ). Интересно, что финголимод, как было показано, имитирует антибактериальные свойства сфингозина, защищая мышей с нокаутом по регулятору трансмембранной проводимости при муковисцидозе (CFTR) от инфекции просветных дыхательных путей посредствомPseudomonas auerginosa ( Pewzner-Jung et al., 2014 ).
В контексте рассеянного склероза финголимод фосфорилируется в кровотоке и впоследствии связывается с рецептором сфингозин-1-фосфата лимфоцитов 1 (S1PR1), вызывая быструю интернализацию S1PR1. В отсутствие поверхностного S1PR1 лимфоциты не могут выходить из лимфоидных тканей и не могут перемещаться к тканям-мишеням, таким как мозг; Таким образом, обоснование того, что финголимод может снизить риск рецидива РС и тяжесть атак за счет иммунной модуляции ( Strader et al., 2011 ).
Терифлуномид является активным метаболитом иммунодепрессанта ленфлуномида, который в настоящее время одобрен для лечения ревматоидного артрита ( Munier-Lehmann et al., 2013 ). Терифлуномид подавляет синтез пиримидина de novo в быстро делящихся клетках, таких как клонально увеличивающиеся лимфоциты, потенциально смягчая аутоиммунную атаку на миелин. Более конкретно, терифлуномид неконкурентно ингибирует дигидрооротатдегидрогеназу, фермент, участвующий в первой стадии синтеза пиримидина de novo. Терифлуномид не влияет на В-клетки и Т-клетки памяти, поскольку они делятся медленнее и могут синтезировать ДНК, используя путь восстановления пиримидина ( Bar-Or et al., 2014). Интересно, что ингибиторы дигидрооротатдегидрогеназы, как было показано, останавливают рост одноклеточных организмов, таких как плазмодий falciparum, предположительно путем ингибирования синтеза пиримидина de novo ( Pavadai et al., 2016 ).
ДМФ представляет собой сложный эфир фумаровой кислоты, который первоначально исследовался на предмет использования в качестве противомикробного консерванта.1 . Впервые он был использован в терапевтических целях для лечения псориаза на основании гипотезы о том, что псориаз вызывается дефектом опосредованного фумаратом метаболизма углеводов в коже. В начале 2000-х годов немецкий невролог заметил, что у пациентов с РС, принимающих ДМФ по поводу сопутствующего псориаза, наблюдается стабилизация симптомов РС и снижение частоты рецидивов ( Phillips and Fox, 2013 ).
Было показано, что ДМФ реагирует с тиолсодержащими молекулами, такими как клеточный антиоксидант, глутатион и остатки цистеина в белках, посредством химической реакции, называемой присоединением Майкла ( Brennan et al., 2015). Хотя ДМФ изначально истощает глутатион в клетках млекопитающих, его предполагаемое защитное действие при РС связано с его способностью алкилировать ключевые остатки цистеина в окислительно-восстановительном белке Kelch-Like ECH-Associated Protein 1 (Keap1). Keap1 обычно ингибирует ядерный фактор (производный эритроида 2) -подобный 2 (Nrf2) от транслокации в ядро и активации экспрессии антиоксидантного гена. Когда остатки цистеина Keap1 окисляются реактивными формами кислорода (ROS) или органическими электрофилами, такими как DMF, Keap1 диссоциирует от Nrf-2, позволяя происходить ядерной транслокации. Это вызывает устойчивый антиоксидантный клеточный ответ. Первоначальное снижение клеточного глутатиона после лечения ДМФ сопровождается резким увеличением глутатиона через путь Nrf-2, который может защищать уязвимые клетки при РС ( Phillips and Fox, 2013).).
Хотя финголимод, терифлуномид и ДМФ предложили механизмы защиты центральной нервной системы от повреждений, опосредованных РС, одна неисследованная возможность заключается в том, что эти пероральные агенты могут подавлять рост кишечных бактерий, секретирующих нейротоксины. Поскольку во время лог-фазы роста C. perfringens секретирует ETX, токсин, который специфически воздействует на ГЭБ и миелиновую оболочку, мы решили изучить влияние этих пероральных методов лечения рассеянного склероза на рост C. perfringens in vitro .
Методы
Лекарства и соединения
Все лекарства и соединения, использованные в этом исследовании, были приобретены у Sigma Aldrich.
Бактериальные штаммы и условия роста
C. perfringens ATCC 13124 (тип A), ATCC 3626 (тип B), ATCC 51880 (тип C), ATCC 3631 (тип D), ATCC 27324 (тип E) и два клинических изолята типа A, предоставленные пресвитерианской больницей Нью-Йорка. были использованы для начального скрининга, в то время как «типовой штамм», ATCC 13124, использовался для всех последующих экспериментов. Бактерии культивировали анаэробно при 37 ° C в течение ночи с использованием системы GasPak 100 (BD). Анаэробиоза достигали путем предварительного восстановления питательной среды с использованием анаэробного сосуда, содержащего саше GasPak EZ Anaerobe System, в течение как минимум 6 часов перед посевом. После инокуляции пакетик GasPak заменяли на ночное культивирование.
Экспериментальные процедуры
Соединения, используемые для начального скрининга ингибирования роста, разводили до конечной концентрации 500 мкг / мл в бульоне Мюллера-Хинтона (BD) и в среду инокулировали 5 × 10 6 колониеобразующих единиц (КОЕ) различных штаммов C. perfringens . Значения минимальной ингибирующей концентрации (≥95% ингибирования роста, MIC 95 ) определяли для ингибирующих соединений с использованием бульона Мюллера-Хинтона II с поправкой на катионы (BD). Ингибирующие соединения серийно разбавляли от 512 мкг / мл до 0,5 мкг / мл, инокулировали 5 × 10 5 КОЕ C. perfringens.а затем культивировали в анаэробных условиях при 37 ° C в течение ночи, как описано ранее. Условия культивирования для каждого соединения были выполнены в трех экземплярах, и рост бактерий определялся путем измерения значений OD 600 для 1 мл повторно суспендированных бактерий.
Статистический анализ
Результаты являются репрезентативными для данных, полученных в результате повторных независимых экспериментов. Каждое значение представляет собой среднее значение ± стандартное отклонение для трех повторов. Статистический анализ выполняли с использованием двустороннего t- критерия Стьюдента (GraphPad Software, Сан-Диего, Калифорния, США).
Результаты
В связи с возобновлением интереса к кишечным бактериям и их потенциальному участию в патогенезе рассеянного склероза ( Bhargava and Mowry, 2014 ) мы хотели определить, обладают ли пероральные лекарственные препараты, модифицирующие болезнь (DMD), способностью модулировать рост C. perfringens, начиная с типа B и Штаммы D секретируют ЕТХ во время лог-фазы роста. Поэтому мы проверили, влияют ли пероральные МДД на рост токсинотипов C. perfringens A – E. Мы сравнили эффекты ингибирования роста финголимода, ДМФ и терифлуномида с действием пероральных препаратов для лечения симптомов (SMD), баклофена, бупропиона и габапентина; лекарства, которые, как считается, не изменяют течение болезни MS. Мы выявили C. perfringensкультуры до 500 мкг / мл каждого соединения, оставляли для анаэробного роста в течение ночи и определяли оптическую плотность (OD 600 ) на следующий день. Мы обнаружили, что каждый пероральный DMD значительно подавлял все протестированные токсинотипы и штаммы C. perfringens , в то время как пероральный SMD — нет (рис. 1A ). Затем мы построили график значений минимальной ингибирующей концентрации (МИК) для каждого ингибирующего соединения и обнаружили, что финголимод был наиболее сильным ингибитором при 4 мкг / мл (рис. 1В ).ФИГУРА 1
Рисунок 1. Препараты, влияющие на заболевание полости рта, подавляют рост C. perfringens , в то время как пероральные препараты, используемые для лечения симптомов рассеянного склероза, нет. (A) Токсинотипы C. perfringens A, B, C, D, E и два клинических изолята типа A (CI1 и CI2) культивировали в анаэробных условиях в присутствии 500 мкг / мл пероральных DMD, финголимода, DMF и терифлуномида, каждый из которых значительно ингибировал рост бактерий для всех протестированных штаммов, аналогично тому, что наблюдалось при культивировании бактерий в присутствии известной смеси антибиотиков пенициллин / стрептомицин (pen / strep, 100 Ед / мл). Напротив, оральные SMD не смогли подавить рост C. perfringens , давая OD 600.-значения аналогичны показателям управления автомобилем DMSO. Данные представлены как средние по трем независимым экспериментам. Столбики ошибок представляют собой стандартные отклонения, а звездочки указывают на то, что результаты статистически значимы по сравнению с контрольными растворами ДМСО ( t- критерий Стьюдента , * P <0,001). (B) Были выполнены серийные разведения ингибирующих пероральных DMD, и типовой штамм C. perfringens ATCC 13124 (тип A) культивировали в каждом состоянии. Значения OD 600 для каждой концентрации были разделены на значение соответствующего разведения для контроля носителя DMSO. Значения МИК были нанесены на график для каждого перорального МДД, показав, что финголимод был наиболее сильным соединением с МИК 95.4 мкг / мл по сравнению со 128 мкг / мл для ДМФ и терифлуномида.
Поскольку финголимод является гомологом D-сфингозина и мириоцина, оба из которых обладают антимикробными свойствами ( Fischer et al., 2012 ), мы сравнили ингибирующую активность финголимода с этими родственными молекулами сфингоидов. Мы подвергли типовой штамм C. perfringens ATCC 13124 (тип A) воздействию финголимода, D-сфингозина и мириоцина и определили, что, как и финголимод, D-сфингозин также проявляет ингибирующую активность. Мириоцин не смог подавить C. perfringens , но вместо этого усилил рост бактерий (рис. 2А ). Затем мы построили график и сравнили МПК для финголимода и D-сфингозина и определили, что D-сфингозин проявляет ингибирующую активность, аналогичную эффективности финголимода с МПК 95.4 мкг / мл (рис. 2В ).ФИГУРА 2
Рисунок 2. D-сфингозин, соединение, родственное финголимоду, подавляет рост C. perfringens . (A) Типовой штамм C. perfringens ATCC 13124 культивировали в анаэробных условиях в присутствии 500 мкг / мл финголимода и других сфингоидных соединений, D-сфингозина и мириоцина. Как и финголимод, D-сфингозин также подавлял рост C. perfringens . Однако мириоцин не смог подавить бактерию. Вместо этого мириоцин увеличивал рост C. perfringens по сравнению с контрольным носителем ДМСО. Данные представлены как средние по трем независимым экспериментам. Столбики ошибок представляют собой стандартные отклонения, а звездочки указывают на то, что результаты статистически значимы по сравнению с ДМСО-контролем (серый); Студенческий т-тест, * P <0,0001. (B) Были выполнены серийные разведения ингибирующих молекул сфингоидов, и C. perfringens ATCC 13124 культивировали при каждом разведении. Значения OD 600 для каждого разведения делили на значение соответствующего контрольного разведения носителя ДМСО. Значения MIC наносили на график для каждого из ингибирующих сфингоидных соединений, показывая, что D-сфингозин имитирует антибактериальную активность финголимода со значением MIC 95, равным 4 мкг / мл.
Хотя был предложен антиоксидантный механизм того, как ДМФ защищает клетки от повреждений, опосредованных РС, первоначально ДМФ исследовался на предмет использования в качестве противомикробного соединения 1 . Интересно, что ДМФ также подавляет рост Clostridium botulinum ( Dymicky et al., 1987 ), вида бактерий, тесно связанных с C. perfringens.. Известно, что ДМФ является акцептором Михаэля, и его способность влиять на окислительно-восстановительный статус клеток проистекает из его электрофильной природы. Акцепторы Майкла принимают электроны во время реакции Майкла, в то время как нуклеофильные тиолы (доноры Майкла) отдают электроны. Реакция Михаэля приводит к ковалентному алкилированию сульфгидрильной группы. Эта ковалентная связь навсегда инактивирует тиолсодержащие молекулы, если тиол необходим для функции молекулы, как в случае глутатиона и его антиоксидантных свойств ( Brennan et al., 2015 ).
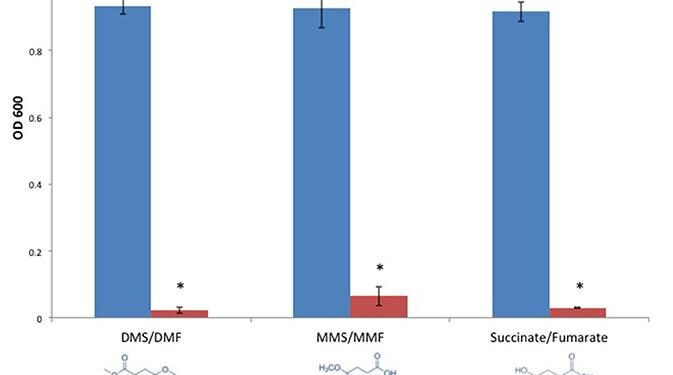
Мы стремились определить, распространяется ли антимикробная активность ДМФ на C. perfringens . Кроме того, мы исследовали акцепторную активность ДМФ по Михаэлю в отношении его антимикробных свойств. Мы проверили ДМФ и его метаболиты, монометилфумарат (MMF) и фумарат и обнаружили, что каждое соединение ингибирует рост типового штамма C. perfringens ATCC 13124. Однако их насыщенные сукцинатные аналоги диметилсукцинат (DMS), монометилсукцинат (MMS) , и сукцинат, молекулы, лишенные акцепторной активности Михаэля из-за восстановления двойной связи α, β-углерода, не смогли ингибировать C. perfringens (рис. 3A). Мы построили график значений MIC для DMF, MMF и фумарата и обнаружили, что DMF был в четыре раза более активным, чем MMF или фумарат (рис. 3B ).РИСУНОК 3
Рисунок 3. Фумараты подавляют рост C. perfringens, в то время как родственные им насыщенные сукцинаты — нет. (A) Анаэробный рост C. perfringens ATCC 13124 сравнивали для DMF и его соответствующего сукцината (DMS), MMF и его соответствующего сукцината, MMS, фумарата и сукцината. В каждом случае ненасыщенные фумаратные соединения (красный) проявляли ингибирующую активность, а насыщенные сукцинаты (синий) — нет. Данные представлены как средние по трем независимым экспериментам. Столбики ошибок представляют собой стандартные отклонения, а звездочки указывают на то, что ингибирование роста бактерий, наблюдаемое в присутствии ненасыщенных фумаратов, является статистически значимым по сравнению с ростом бактерий, наблюдаемым в присутствии соответствующих насыщенных сукцинатов; Студентыt- критерий, * P <0,0001). (B) Осуществляли серийные разведения ингибирующих фумаратных соединений, и C. perfringens ATCC 13124 культивировали при каждом разведении. Значения OD 600 для каждого разведения делили на значение соответствующего контрольного разведения носителя ДМСО. Значения MIC были нанесены на график для каждого из ингибирующих фумаратов, показав, что ДМФ примерно в четыре раза более эффективен, чем ММФ и фумарат.
Учитывая, что акцепторная активность Михаэля была необходима для ингибирования C. perfringens ДМФ и его фумаратными метаболитами, мы стремились определить, могут ли неродственные молекулы, которые разделяют α, β ненасыщенную карбонильную структуру, также ингибировать C. perfringens . Мы проверили акцепторы Майкла из разнообразной группы химических семейств и обнаружили, что природные акцепторы Майкла — гамбоджовая кислота (ксантоноид), партенолид (сесквитерпеноид) и куркумин (куркуминоид) — каждый ингибирует C. perfringens (рис. 4А ). Интересно, что мы обнаружили, что гамбожовая кислота была особенно ингибирующей с MIC 95 , равной 1 мкг / мл (рис. 4B ).РИСУНОК 4
Рисунок 4. Натуральный продукт. Акцепторы Майкла подавляют рост C. perfringens . (A) Акцепторы Михаэля, полученные из растений, тестировали на ингибирующую активность против C. perfringens ATCC 13124. Бактерии выращивали анаэробно в присутствии 500 мкг / мл гамбоджовой кислоты, партенолида и куркумина. Каждый природный продукт-акцептор Михаэля успешно подавлял рост C. perfringens , аналогично тому, что наблюдалось при культивировании бактерий в присутствии известного антибиотика пенициллина / стрептомицина (pen / strep, 100 Ед / мл). Данные представлены как средние по трем независимым экспериментам. Столбики ошибок представляют собой стандартные отклонения, а звездочки указывают на то, что результаты статистически значимы по сравнению с ДМСО-контролем (серый); Студенческий т-тест, * P <0,0001. (B) Осуществляли серийные разведения ингибирующих акцепторов Майкла природного продукта и культивировали C. perfringens ATCC 13124 при каждом разведении. Значения OD 600 для каждого разведения делили на значение соответствующего контрольного разведения носителя ДМСО. Значения MIC были нанесены на график для каждого соединения, показывающего, что гамбоджовая кислота является наиболее сильнодействующей с MIC 95, равной 1 мкг / мл, по сравнению с партенолидом и куркумином, каждый из которых ингибирует C. perfringens при 64 мкг / мл.
Чтобы предоставить дополнительные доказательства того, что акцепторная активность Михаэля действительно имеет решающее значение для антибактериальных свойств α, β ненасыщенных карбонилов, мы провели поиск в литературе, чтобы найти соединения, для которых были определены экспериментальные значения эффективности реакции Михаэля. Динкова-Костова и др. определили эффективность нескольких акцепторов Михаэля растительного происхождения по их способности индуцировать активность клеточной хинонредуктазы; клеточный маркер реакционной способности соединения с сульфгидрилсодержащими молекулами ( Динкова-Костова и др., 2001 ). В нашем исследовании, антибактериальные потенции коричной кислоты, транс-халкон и куркумин зеркальных акцепторных потенции Михаэля , описанные Dinkova-Костовые и его коллеги (рис 5). Ранее было показано, что коричная кислота неактивна в качестве акцептора Михаэля, и в наших руках это соединение не смогло ингибировать C. perfringens . Кроме того, было обнаружено, что куркумин примерно в четыре раза более эффективен, чем транс-халкон (соотношение = 4,13; Dinkova-Kostova et al., 2001 ). Аналогичным образом, мы обнаружили, что куркумин в четыре раза эффективнее транс-халкона в качестве ингибитора C. perfringens (соотношение = 4).РИСУНОК 5
Фигура 5. Ингибирование роста акцептора Михаэля C. perfringens отражает известную активность реактивности . Выполняли последовательные разведения α, β ненасыщенных карбонилов и культивировали C. perfringens ATCC 13124 при каждом разведении. Значения OD 600 для каждого разведения делили на значение соответствующего контрольного разведения носителя ДМСО. Значения MIC были нанесены на график для каждого соединения, показывая, что коричная кислота не проявляет ингибирующей активности, в то время как куркумин в четыре раза более эффективен, чем транс-халкон. Относительная ингибирующая активность каждого соединения почти точно соответствует относительной эффективности акцептора Михаэля, как показано Dinkova-Kostova et al. (2001) .
Поскольку акцепторы Майкла реагируют с тиолами и снижают уровни клеточного глутатиона ( Brennan et al., 2015 ), мы предположили, что ингибирование акцепторами Майкла C. perfringens может быть отменено добавлением экзогенного глутатиона. Чтобы проверить это, мы сравнили рост C. perfringens в присутствии акцепторов Михаэля с равным количеством экзогенного глутатиона и без него. Мы также проверили влияние глутатиона на ингибирующую активность каждого перорального РС МДД. Глутатион полностью снял ингибирование роста известными акцепторами Михаэля в нашем исследовании, но не смог устранить ингибирующие эффекты финголимода и терифлуномида (рис. 6А).). Поскольку глутатион является антиоксидантом, как и витамины C и E, мы стремились определить, основано ли устранение глутатионом антибактериальной активности акцептора Михаэля его нуклеофильным поведением или, в более общем смысле, его антиоксидантными свойствами. C. perfringens заражали DMF в присутствии витамина C, витамина E или донора Майкла, глутатиона. Из группы антиоксидантов только донор Майкла, глутатион, смог нейтрализовать ингибирующий эффект ДМФ (рис. 6В ).РИСУНОК 6
Фигура 6. Донор Майкла, глутатион (GSH), отменяет ингибирование акцептором Майкла роста C. perfringens . (А) C. perfringensATCC 13124 культивировали анаэробно при концентрации акцептора Михаэля (ДМФ, партенолид и транс-халкон) и акцептора Михаэля (финголимод и терифлуномид) в концентрации 500 мкг / мл с (красный) или без (синий) добавлением равное количество экзогенного донора Михаэля, GSH. Только опосредованное акцептором Майкла ингибирование роста могло быть отменено добавлением экзогенного GSH. На ингибирующую активность финголимод и терифлуномид не влияло присутствие GSH, аналогично тому, что наблюдалось при культивировании бактерий в присутствии pen / strep и GSH. Данные представлены как средние по трем независимым экспериментам. Столбики ошибок представляют собой стандартные отклонения, а звездочки указывают на то, что восстановление роста при помощи GSH является статистически значимым по сравнению с отсутствием восстановления роста в отсутствие GSH; Студентыt- критерий, * P <0,001. (B) C. perfringens ATCC 13124 культивировали в присутствии DMF, витамина C, витамина E и GSH в концентрации 250 мкг / мл каждого. Только акцептор Михаэля, ДМФ, ингибировал рост бактерий. Затем ДМФ был объединен с антиоксидантами, витамином С, витамином Е и GSH в концентрациях 250 мкг / мл для каждого соединения. Донорный антиоксидант Майкла, GSH, отменял ингибирование ДМФ. Однако антиоксиданты, не являющиеся донорами Майкла, витамин C и витамин E, не смогли устранить ингибирующее действие ДМФ на C. perfringens.рост. Данные представлены как средние по трем независимым экспериментам. Планки погрешностей представляют собой стандартные отклонения, а звездочки указывают на то, что результаты статистически значимы по сравнению с контролем DMF (серый цвет); T- критерий Стьюдента , * P <0,001.
Обсуждение
В этом исследовании мы показали, что каждый из пероральных DMD, одобренных для лечения MS, финголимод, терифлуномид и DMF, подавляет in vitro рост кишечной бактерии C. perfringens, секретирующей эпсилон-токсин . Напротив, пероральные методы лечения, используемые специально для симптоматического лечения, не могут предотвратить рост C. perfringens . Следует отметить, что финголимод оказался бактерицидным, в то время как терифлуномид и ДМФ оказались бактериостатическими (дополнительный рисунок 1 ). Антибактериальные свойства пероральных DMD повышают вероятность того, что модуляция кишечной микробиоты может играть роль в клинической эффективности этих соединений. Профилактика C. perfringensрост и выработка токсинов могут служить конкретным примером этого. Кроме того, мы идентифицировали два различных класса молекул, способных ингибировать C. perfringens ; а именно сфингоидные соединения, такие как финголимод и D-сфингозин, и акцепторы Михаэля, такие как ДМФ, его фумаратные метаболиты и различные природные продукты, которые представляют собой α, β ненасыщенные карбонилы.
При попытке экстраполировать эти данные in vitro на то, что может происходить в кишечнике человека, необходимо учитывать важные факторы . Во-первых, как соотносятся ингибирующие концентрации in vitro с концентрациями, обнаруженными в кишечнике человека? Объем покоя человеческого желудка составляет ~ 0,08 л ( Johnson, 1994 ), что дает расчетную концентрацию в кишечнике 6,3 мкг / мл для финголимода (МИК 95 = 4 мкг / мл), 87–175 мкг / мл для терифлуномида (МИК 95 = 128 мкг / мл) и 1500–3000 мкг / мл для ДМФ (МИК 95 = 128 мкг / мл). Таким образом, MIC 95 каждого соединениянаходится в пределах расчетного диапазона терапевтической концентрации, которая попадет в тонкий кишечник. Кроме того, ДМФ представляет собой капсулу с отсроченным высвобождением, которая растворяется в более щелочном pH тонкой кишки ( Gold et al., 2016 ). Местное высвобождение ДМФ может увеличить его концентрацию в тонком кишечнике, где находится C. perfringens .
Во-вторых, наши экспериментальные условия роста, вероятно, будут более благоприятными для роста C. perfringens, чем кишечная среда. Безвредный рост in vitro защищает C. perfringens от конкуренции с другими бактериями за питательные вещества. Кроме того, C. perfringens не будет подвергаться воздействию токсичных молекул, секретируемых конкурирующими бактериями, такими как бактериоцины, или антибактериальными молекулами хозяина, такими как дефенсины. Следовательно, MIC 95 для каждого перорального DMD может быть значительно меньше в такой среде, как кишечник человека, где C. perfringens приходится бороться с множеством внешних факторов.
И наоборот, каждый из пероральных DMD обладает значительной степенью гидрофобности, и липид-связывающие молекулы в просвете кишечника могут изолировать эти соединения, предотвращая токсическое взаимодействие с кишечными бактериями. В частности, учитывая ДМФ, акцептор Михаэля, внеклеточные нуклеофилы, присутствующие в кишечнике, могут реагировать с его электрофильным β-углеродом до того, как он попадет в бактериальную клетку, что, возможно, снижает его антибактериальную активность в кишечнике.
Подавление роста C. perfringens, зависящее от реакции Михаэля, может быть объяснено его способностью истощать эту бактерию из тиолсодержащих соединений. Поразительно, что нуклеофильные тиолы не только играют важную роль в гомеостазе клеток млекопитающих, но также являются необходимыми субстратами для роста C. perfringens . Эта бактерия зависит от органического источника серы (тиолов) и не будет расти со строго неорганическими источниками (ТАК2 -4ТАК42-, ТАК2 -3ТАК32-, S 2 O 3 2- и S i ; Фукс и Бонд, 1957 ). Следовательно, истощение тиолов в C. perfringens может вносить вклад в опосредованное акцептором Михаэля ингибирование роста.
Хотя терифлуномид представляет собой α, β ненасыщенный карбонил, мы показали, что глутатион не влияет на его способность подавлять рост C. perfringens . Возникает соблазн предположить, что терифлуномид ингибирует синтез пиримидина de novo в быстро делящихся бактериальных клетках, как это происходит в клетках млекопитающих, посредством ингибирования дигидрооротатдегидрогеназы; ген, аннотированный для C. perfringens в базе знаний Uniprot. Однако в настоящем исследовании мы не исследовали ингибирующий механизм терифлуномида.
То, что акцепторы Майкла, такие как ДМФ и его фумаратные метаболиты, ингибируют C. perfringens, может открыть дверь для разработки новых пероральных методов лечения рассеянного склероза, производных от функционального класса акцепторов Майкла. Гамбожья кислота веками использовалась в восточной медицине для лечения кишечных заболеваний и паразитов ( Wu et al., 2004 ), и в наших руках она демонстрирует впечатляющую антибактериальную активность (МПК 95 = 1 мкг / мл).
Мы искали акцепторы Майкла, одобренные в настоящее время для использования людьми, которые не обладают известными иммуносупрессивными свойствами. Нафтохинон, менадион (витамин К3), является синтетическим предшественником витамина К. Он обычно используется в качестве пищевой добавки для домашнего скота и в качестве экономически эффективной заместительной терапии витамином К в развивающихся странах. Следует отметить, что недавно было показано, что менадион подавляет рост S. aureus и B. anthracis , а также подавляет секрецию S. aureus токсина 1 синдрома токсического шока (TSST-1; Schlievert et al., 2013 ). Точно так же мы обнаружили, что Менадион подавляет C. perfringens.рост, но родственные соединения с длинными алифатическими боковыми цепями, витамин K1, витамин K2 и убихинон нет (дополнительный рисунок 2A ). В то время как значение MIC 95 Менадиона составило 64 мкг / мл (дополнительный рисунок 2B).), неактивность соединений, родственных менадиону, которые все являются переносчиками электронов в цепи переноса электронов, может быть связано с тем, что они изолированы в клеточной мембране своими алифатическими боковыми цепями. Секвестрация мембраны может защитить цитозольные нуклеофилы от добавления по Майклу и последующего истощения. Кроме того, в отличие от менадиона, но подобных терифлуномиду, эти молекулы обладают третьей σ-связью в β-углеродном положении. Это может предотвратить нуклеофильную атаку из-за стерических препятствий и отменить акцепторную активность Михаэля ( Schwöbel et al., 2010 ).
В свете серьезных побочных эффектов, связанных с текущими пероральными МДД, это исследование может иметь непосредственное клиническое значение. Некоторые из этих побочных эффектов связаны с иммуносупрессией ЦНС, о чем свидетельствует повышенный риск заражения вирусом JC и прогрессирующая мультифокальная лейкоэнцефалопатия (PML, FDA Drug Safety Communication, 2014 ; Brooks, 2015). Возможно, новые антибактериальные соединения, основанные на этих ранних пероральных МДД, но не обладающие их иммуносупрессивными свойствами, могут быть полезны при лечении рассеянного склероза. Например, соединения, родственные финголимоду / D-сфингозину, лишенные головных гидроксильных групп, не будут подвергаться фосфорилированию и не будут нацелены на S1PR1 лимфоцитов. Такие соединения не будут иммунодепрессивными и могут снизить риск заражения вирусом JC и развития ПМЛ. В соответствии с этим мы свели в таблицу значения MIC 95 для каждого ингибирующего соединения, использованного в этом исследовании (таблица 2 ).ТАБЛИЦА 2
Таблица 2. Минимальные концентрации ингибиторов для всех ингибирующих соединений, использованных в исследовании .
Вклад авторов
KR задумал исследование. KR, VF и TV разработали исследование. КР, В.Ф. и ТВ провели поиск литературы. KR собрал данные и написал статью. Все авторы проанализировали данные.