Рассеянный склероз (РС) представляет собой нейродегенеративное расстройство, которое может принимать две основные формы: рецидивирующе ремиттирующий РС (РРРС), который характеризуется периодами клинической ремиссии, и прогрессирующий РС, который характеризуется продолжающимся ухудшением без ремиссии. Есть несколько методов лечения, помогающих управлять РРРС, но лечение прогрессирующего РС гораздо сложнее. Изучая влияние спинномозговой жидкости (CSF) пациентов с РС на митохондрии в нейронах мышей, американские исследователи обнаружили биологический механизм, который в конечном итоге может помочь в разработке новых терапевтических стратегий против прогрессирующей формы заболевания.
«Поскольку мозг омывается CSF, мы задумались, может ли лечение культивируемых нейронов пациентами с РС рецидивирующим/ремиттирующим или прогрессирующим течением заболевания по-разному повлиять на функцию митохондрий нейронов», — сказала Патриция Казачча. Доктор философских наук, профессор биологии Эйнштейна в Центре выпускников и директор-основатель Инициативы нейробиологии в Центре перспективных научных исследований (ASRC) в Центре выпускников, Городской университет Нью-Йорка и Школа медицины Икан на горе Синай.
«Мы обнаружили существенные различия в форме нейрональных митохондрий и их способности вырабатывать энергию».
Casaccia и коллеги сообщили о своих находках в Brain в статье под названием « Метаболическая перспектива нейродегенерации при рассеянном склерозе с помощью CSF ».
РС поражает более 2,5 миллионов человек во всем мире и характеризуется разрушением миелиновой оболочки, которая окружает нервные клетки. РРРС является наиболее распространенной формой РС и затрагивает около 85% пациентов, у которых наблюдаются демиелинизирующие воспалительные эпизоды с клиническими симптомами, за которыми следуют периоды клинической ремиссии. У 15% пациентов с первичным прогрессирующим РС наблюдается прогрессирующее неврологическое ухудшение без периодов клинической ремиссии. Приблизительно у 50% пациентов с РРРС также в конечном итоге развивается прогрессирующее заболевание.
В то время как существуют одобренные иммуномодулирующие препараты, которые могут помочь уменьшить воспаление, характерное для РРРС, «прогрессирующим РС с инвалидностью, обусловленной нейродегенерацией и воспалением, присущим ЦНС, управлять сложнее», отметили авторы. «Одной из самых больших проблем в области РС остается терапевтическое лечение нейродегенеративного компонента заболевания. Это вероятно связано с неуловимым характером молекулярных механизмов, лежащих в основе прогрессирования заболевания, что исключает возможность определения эффективной терапевтической мишени ».
Предыдущие исследования на животных показали, что дисфункция митохондрий в нервных клетках может быть признаком прогрессирующего РС, но молекулярные механизмы лежащие в основе этого процесса неизвестны. Чтобы рассмотреть это более детально, Casaccia и его коллеги исследовали, были ли какие-либо отличительные эффекты лечения нейронов крыс с помощью CSF, взятых у пациентов с РРРС или с прогрессирующим РС.
Исследователи функционально и метаболически охарактеризовали образцы CSF у 15 пациентов с РРРС и еще у 29 с прогрессирующим РС, и подвергали действию культивируемые нейроны крысы. Любые воздействия на нейроны были записаны непосредственно с помощью замедленной съемки с использованием конфокальной визуализации в реальном времени. Митохондриальный индикатор был использован для визуализации любых изменений в митохондриях. Видео показали важные различия между эффектами двух разных типов образцов CSF. Митохондрии, подвергшиеся воздействию CSF от прогрессирующих пациентов с РС, стали намного более вытянутыми и слитыми вместе. «Примечательно, что мы обнаружили значительное удлинение этих органелл, объединившихся чтобы сформировать трубчатую сеть только в нейрональных культурах, подвергшихся воздействию CSF от прогрессирующих пациентов», — сообщили ученые.
Дальнейшие биохимические тесты показали, что удлиненные митохондрии не функционируют так же хорошо и поэтому менее способны вырабатывать энергию, что в конечном итоге приводит к гибели нейронных клеток. «Мы обнаружили существенные различия в форме нейрональных митохондрий и их способности вырабатывать энергию», — заявил Казачча. «Только воздействие CSF от прогрессирующих пациентов с РС вызывало слияние и удлинение нейрональных митохондрий, делая их неспособными вырабатывать энергию».
Предыдущие исследования показали, что митохондрии удлиняются в попытке генерировать больше энергии для клеток, когда существует повышенная потребность в энергии или уменьшение доступной глюкозы. Чтобы попытаться найти то, что может присутствовать в CSF прогрессирующего рассеянного склероза, которое вызывает реакцию удлинения, команда сначала уничтожила все белки в образцах, подвергая их нагреванию, а затем повторно проверила термообработанные образцы на нейронах крысы. Интересно что все еще наблюдался «замечательный эффект» CSF от прогрессирующих пациентов на удлинение митохондрий, что по словам исследователей, «исключило потенциальный вклад белковых компонентов». белки не причом!
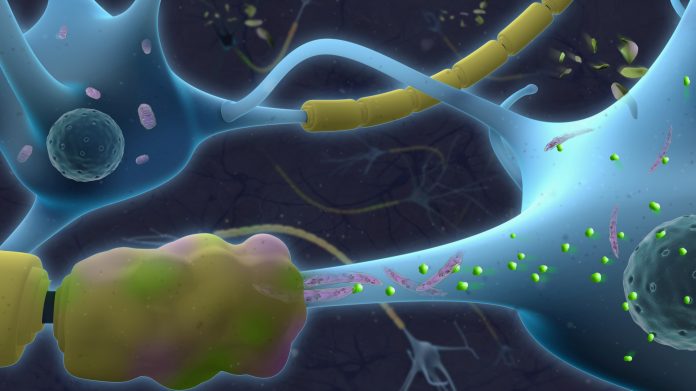
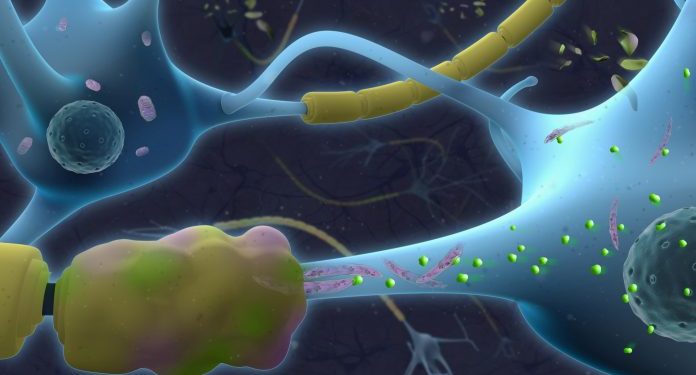
Нижняя часть этого рисунка иллюстрирует нейроны с патологическими аксонами, обернутыми поврежденным миелином (желтый и розовый).
Удлиненные митохондрии (фиолетового цвета) в нижней части дисфункциональны и характеризуются накоплением токсичных керамидов (зеленого цвета) [Джереми Вейксель, Biovisioning]
Затем они провели анализ липидных компонентов в CSF от пациентов с РРРС и от прогрессирующих пациентов с РС, и обнаружили повышенные уровни церамидов, и особенно церамида C24, в прогрессирующем РС в CSF. Авторы указали, что церамиды — это сфинголипиды, которые ранее были причастны к РС.
Примечательно, что воздействие на церамиды нейронов крысы приводило к тому же удлинению митохондрий, что и воздействие прогрессирующего РС в CSF. «Когда мы подвергали церамидам культивируемые нейроны, мы выявили те же изменения вызванные воздействием CSF у прогрессирующих пациентов с РС», — сказала Морин Уэнтлинг, доктор философии, научный сотрудник лаборатории Casaccia и первый автор исследования.
Дальнейшие исследования культивируемых нейронов, подвергшихся воздействию церамида в условиях низкого или высокого уровня глюкозы, показали что лечение ухудшает продукцию АТФ. «… Присутствие керамидов влияет на активность дыхательных цепочек, которые становятся нефункциональными», — заявили исследователи. «Нейрон пытается компенсировать этот энергетический дефицит путем активизации транспортеров глюкозы и перенаправления энергетического ответа на гликолиз в попытке удовлетворить метаболические потребности, которые в долгосрочной перспективе оказываются неэффективными и приводят к нейротоксичности».
«Мы также обнаружили, что церамиды вызывают повреждение нейронов, воздействуя на два клеточных механизма», — добавил Вентлинг. «С одной стороны, керамиды ослабляют способность нейронов производить энергию, непосредственно повреждая митохондрии. С другой стороны, они также заставляли нейроны быстрее усваивать глюкозу в попытке обеспечить энергию для клетки».
Нейротоксическое действие CSF на культивируемые нейроны может быть уменьшено путем добавления нейронов глюкозой или лактатом. Хотя этот подход не будет работать в качестве устойчивой терапевтической стратегии, результаты могут помочь исследователям разработать новые подходы для защиты митохондрий у пациентов с прогрессирующим РС, в то время как керамиды в CSF могут представлять собой потенциальные биомаркеры нейродегенерации. «Вместе эти данные предполагают состояние« виртуального гипогликоза», вызванного CSF прогрессирующих пациентов в культивируемых нейронах, и предполагают критическое временное окно вмешательства для спасения метаболического нарушения нейрональной биоэнергетики, лежащего в основе нейродегенерации у пациентов с РС», — заключили исследователи.