Цитомегаловирус человека (HCMV) является основной вирусной причиной врожденных дефектов во всем мире, и современные методы лечения обладают высокой токсичностью. Ранее мы сообщали, что mTOR-независимый индуцирующий аутофагию дисахарид трегалоза ингибирует репликацию HCMV в нескольких типах клеток. Здесь мы исследуем механизм ингибирования и вводим индуктор аутофагии SMER28 в качестве дополнительного ингибитора HCMV, действующего посредством другого механизма. Мы обнаружили, что трегалоза вызывает вакуолизацию и подкисление вакуолей и что в мультивезикулярных тельцах присутствует мусор, в том числе мусор, внешний вид которого соответствует внешнему виду аномальных вирионов. Обработка трегалозой увеличивала уровни Rab7, белка, необходимого для лизосомного биогенеза и слияния, и немного снижала уровни Rab11, что связано с рециклингом эндосом. Мы также представляем доказательства того, что трегалоза может способствовать аутофагии без изменения клеточного поглощения глюкозы. Мы показываем, что SMER28 ингибирует HCMV на уровне ранней продукции белка и препятствует репликации вирусного генома в зависимости от типа клеток. Наконец, мы показываем, что обработка SMER28 не вызывает вакуолизации, подкисления или перераспределения Rab7, связанного с обработкой трегалозой, и демонстрирует лишь умеренное и зависящее от типа клеток влияние на аутофагию. Мы предлагаем модель, в которой реципрокные эффекты на Rab7 и Rab11, индуцированные трегалозой, способствуют перенаправлению оболочечных вирионов от плазматической мембраны к подкисленным компартментам и последующей деградации, а обработка SMER28 приводит к снижению уровней экспрессии ранних и поздних белков.
ВАЖНОСТЬ Существует потребность в менее токсичных противовирусных препаратах против HCMV, и модуляция аутофагии для борьбы с вирусной инфекцией — это новая стратегия, которая использует зависимость вируса от ингибирования аутофагии. Настоящее исследование расширяет нашу предыдущую работу по трегалозе, показывая возможный механизм действия, и вводит еще одно соединение, вызывающее аутофагию, SMER28, которое эффективно против HCMV в нескольких типах клеток. Механизм, с помощью которого трегалоза вызывает аутофагию, в настоящее время неизвестен, хотя наши данные показывают, что трегалоза не ингибирует клеточное поглощение глюкозы клетками, имеющими отношение к репликации HCMV, а вместо этого изменяет деградацию вириона, способствуя кислой вакуолизации. Сравнение наших типов клеток и тех, которые используются другими, подчеркивает, что изучение аутофагии зависит от типа клеток.
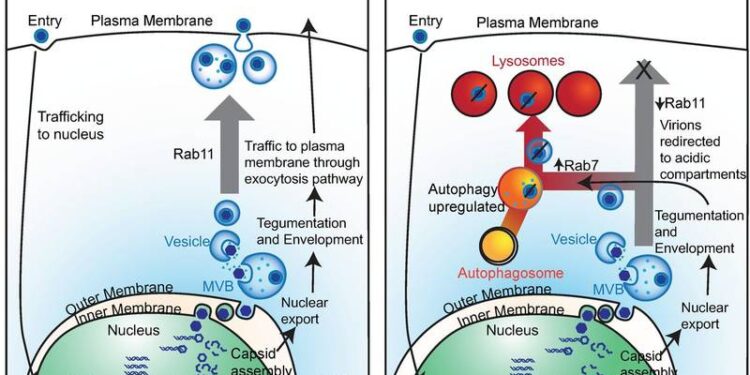
Нарушения аутофагии связаны с множеством патологических состояний. Очевидно, что аутофагия не является линейным процессом, а скорее пересекает множество путей, особенно везикулярный трафик. Использование белков Atg для целей, отличных от деградации и рециркуляции цитозольных компонентов, было показано во многих контекстах, включая секреторную аутофагию, вирусный экзоцитоз, внутриклеточную презентацию антигена и внеклеточную презентацию антигена после фагоцитоза (обзоры см. В ссылках 38 и 39 ). .MVB, в частности, играют ключевую роль в путях аутофагии и везикулярного обмена. Расширение эндосомальных мембран поздних эндосом внутрь к просвету приводит к возникновению внутрипросветных пузырьков (ILVs) внутри MVBs. MVB могут быть нацелены на лизосомы, посредством чего слияние с лизосомами приводит к деградации содержимого MVB. MVB также могут сливаться с аутофагосомами с образованием амфисом до их слияния с лизосомами. Альтернативно, MVB могут сливаться с плазматической мембраной, высвобождая содержимое во внеклеточную среду. Высвободившиеся ILV часто называют экзосомами, и некоторые из них, по-видимому, содержат липидированный LC3 ( 40 ).Множественные вирусы используют компоненты аутофагии и экзосомный аппарат для сборки вирионов и высвобождения белков-хозяев и РНК, которые могут влиять на патогенез (обзоры см. Ссылки 39 и 41 ). Примечательно, что РНК-вирусы используют элементы пути аутофагии не только для облегчения репликации РНК, но также для приобретения оболочки, окружающей капсид, и для выхода из клетки. Например, пикорнавирусы могут заключаться в пузырьки с мембранами аутофагии, чтобы нелитически выходить из клетки и распространяться на другие клетки ( 42 ). Некоторые флавивирусы также , кажется, используют аутофагию мембраны и MVBs для выхода клеток ( 43 — 45). Кроме того, вирус гриппа A специфически блокирует слияние аутофагосом с лизосомами ( 46 ) и перенаправляет LC3-содержащие компартменты на плазматическую мембрану, чтобы облегчить его почкование ( 47 ). Хотя считается, что герпесвирусы подвергаются вторичной оболочке в компартментах мембраны после Гольджи, идентичность везикул, которые транспортируют вирус к плазматической мембране, еще не выяснена. Тем не менее, существует доказательства того, что EBV, KSHV и ВВО использовать аутофагическую мембрану для их вторичного обертывания ( 6 — 9 ). LC3B был обнаружен в очищенных VZV ( 6 ) и EBV ( 9) частиц, а в случае EBV ингибирование образования аутофагической мембраны за счет сайленсинга Atg12 и Atg16 снижает выход вируса. В совокупности совокупность доказательств, связывающих аутофагию и экзоцитоз с жизненным циклом множества вирусов, делает модуляцию пути аутофагии привлекательным вариантом в поисках новых стратегий борьбы с вирусными инфекциями.Эндосомный перенос, контролируемый белками Rab, также пересекается с путем аутофагии. Rab11, белок , наиболее часто связан с плазматической мембраной , предназначенных утилизации эндосом, как был показан, способствует формированию и аутофагоса слиянию между аутофагосом и переработкой эндосомой с образованием amphisomes ( 30 , 48 — 50 ). Rab11 также является важным фактором при многих вирусных инфекциях, включая герпесвирусные инфекции ( 37 , 51 — 53 ). Например, в случае HCMV было показано, что ингибирование Rab11 путем экспрессии доминантно-отрицательного Rab11 в клетке значительно подавляло продукцию инфекционного вируса ( 37). Кроме того, идентификация Rab11 и LC3B в везикулярных компартментах, содержащих частицы VZV, предоставила дополнительные доказательства того, что существует конвергенция эндосомных путей и путей аутофагии во вторичной оболочке и выходе некоторых герпесвирусов. Элегантное исследование с использованием флуоресцентной микроскопии живых клеток также показало, что экзоцитоз вируса псевдобешенства, альфа-герпеса, использует конститутивные секреторные механизмы с везикулами, связанными с Rab6, -8 и -11 ( 52 , 54 ).Экспрессия и функция Rab7, ключевого белка, регулирующего слияние аутофагосом с лизосомами, нарушаются во время заражения множеством вирусов. Например, вирус гепатита C (HCV) вызывает расщепление адапторного белка Rab7 RILP, что приводит к увеличению внеклеточного высвобождения вирионов ( 55 ). Интересно, что сверхэкспрессии продукта расщепления RILP было достаточно, чтобы вызвать наблюдаемое изменение в трафике, которое способствует высвобождению вируса. Другой пример — EBV, где слияние аутофагосом с лизосомами блокируется во время литической инфекции, и это связано со снижением уровня Rab7 ( 7 ).Первоначально мы решили использовать трегалозу для индукции аутофагии, потому что она действует независимо от пути mTOR, который специфически модифицируется HCMV для продуктивной инфекции. Ранее мы сообщали, что трегалоза индуцировала образование аутофагосом и аутофагический поток в трех ее клетках-мишенях in vivo , включая HFF, HAEC и нервные клетки, полученные посредством направленной дифференцировки эмбриональных стволовых клеток ( 1 ). Во всех этих типах клеток трегалоза подавляла экспрессию вирусных генов и образование бесклеточного вируса. Неожиданным открытием было то, что на уровни вируса, связанного с клеткой, наблюдалось лишь небольшое влияние. Это предполагает, что могут быть затронуты везикулярные процессы, ведущие к выходу HCMV.Наиболее яркой особенностью клеток, обработанных трегалозой, была массивная вакуолизация и наличие мембранных завитков по всей цитоплазме, при этом многие везикулы находились в процессе слияния. Кроме того, имело место обширное закисление цитоплазматических компартментов, что согласуется с нашими ранее опубликованными данными, показывающими, что увеличенное количество LC3B-положительных компартментов в обработанных трегалозой клетках также подкислялось ( 1). Эти результаты показывают, что везикулы, индуцированные трегалозой, включают поздние эндосомы / MVB, амфисомы и лизосомы. Принимая во внимание наблюдение, что MVB содержат большое количество частиц мусора и аномальных вирионов, мы предполагаем, что основным эффектом трегалозы является направление вирусных частиц к везикулам, где они будут разлагаться. В соответствии с этими результатами мы показываем, что обработка трегалозой клеток, инфицированных HCMV, приводит к увеличению уровней Rab7 и незначительному снижению уровней Rab11, не влияя на Rab5. Этот опосредованный трегалозой реципрокный эффект на Rab11 и Rab7, вероятно, вносит вклад в перенаправление вирионов с пути, ведущего к высвобождению на плазматической мембране, на один связанный с деградацией лизосом.После многообещающих результатов с трегалозой мы искали другие mTOR-независимые усилители аутофагии для тестирования активности против HCMV, и на основании литературы SMER28 был идентифицирован как хороший кандидат. В целом, исследования SMER28 показали, что он оказывает различные эффекты на LC3B, которые, по-видимому, зависят от типа клеток. Более того, увеличение количества точек LC3B или уровней LC3B-II было умеренным и намного меньшим, чем то, что наблюдается после лечения трегалозой. Например, в одном исследовании было обнаружено увеличение количества LC3B-положительных точек и уровней EGFP – LC3B-II в обработанных SMER28 клетках HeLa ( 20), в то время как другое исследование показало немного сниженную интенсивность эндогенного LC3B в обработанных SMER28 эндотелиальных клетках пупочной вены человека (HUVEC) наряду со сниженными уровнями p62, что свидетельствует об увеличении аутофагического потока ( 27 ). Также было отмечено, что было лишь незначительное изменение уровней LC3B-II в клетках костного мозга K562, обработанных SMER28 ( 24 ). В исследованиях, представленных здесь, мы обнаружили, что в концентрации 50 мкМ SMER28 подавляет инфекцию HCMV, по крайней мере, так же, как 100 мМ трегалозы. Основываясь на липидировании LC3B с образованием LC3B-II, имеются ограниченные доказательства индукции аутофагии, и влияние на аутофагию, по-видимому, зависит от типа клеток. SMER28 не вызывал изменения уровней LC3B-II в HFF, но увеличивал уровни LC3B-II как в инфицированных, так и в неинфицированных HAEC через 72 hpi.Как соединение против HCMV, SMER28 подавлял жизненный цикл вируса на более ранней стадии, чем трегалоза, без очевидной реорганизации цитоплазматического ландшафта, наблюдаемой с помощью электронной микроскопии и иммунофлуоресцентного анализа. В отличие от эффекта трегалозы, цитоплазма клеток, обработанных SMER28, не показывала обширной вакуолизации или подкисления везикул для любого типа клеток. Кроме того, в отличие от трегалозы, SMER28 ингибирует ранние вирусные белки и показывает уменьшенное количество ассоциированного с клеткой вируса. Практически полное отсутствие оболочечных вирионов как в HFF, так и в HAEC в присутствии SMER28 также предполагает, что он подавляет инфекцию HCMV перед вторичной оболочкой вируса. Эффект SMER28 на репликацию вирусной ДНК был специфическим для клеточного типа, при этом инфицированные HAEC проявляли гораздо большую чувствительность.Взятые вместе, наши исследования подтверждают модель ( рис. 18 ), в которой трегалоза снижает накопление поздних вирусных белков и нарушает использование путей переноса окруженными вирионами HCMV как в HFF, так и в HAEC. Трегалоза вызывает изменения в цитоплазматическом ландшафте и в семействе регуляторных белков Rab, ограничивая высвобождение вируса из клетки и потенциально перенаправляя вирионы в подкисленные компартменты, в которых они разрушаются. Напротив, противовирусная активность SMER28, по-видимому, не зависит от путей клеточного переноса и вмешивается в жизненный цикл HCMV на более ранней стадии, уменьшая раннее накопление белка как в HFF, так и в HAEC и задерживая репликацию вирусного генома в HAEC.Рис 18.
Важно отметить, что очень большое количество белков, которые участвуют в генерации аутофагосом, распознавании субстратов, секвестрации субстратов внутри везикул и доставке груза к лизосомам, в сочетании с избыточностью многие из этих белков обеспечивают множество мишеней для активации и ингибирования аутофагии. Таким образом, сравнение эффектов различных «индукторов» и «ингибиторов» аутофагии на вирусную инфекцию может дать противоречивые результаты, особенно когда репликация вируса может улучшаться или ухудшаться из-за активации и ингибирования различных частей пути аутофагии. Точно так же неизвестные нецелевые эффекты многих используемых фармакологических агентов еще больше усложняют интерпретацию данных многих экспериментов.56 ).Наши исследования с трегалозой подчеркивают, как тип клеток может влиять на выводы о механизме индукции аутофагии. Недавний комментарий назывался « Тайна разгадана : трегалоза запускает аутофагию, блокируя транспорт глюкозы» ( 19 ). Исследования, лежащие в основе этого комментария, в частности, показали, что лечение трегалозой ингибирует клеточный импорт глюкозы через транспортеры SLC2A (GLUT) в гепатоцитах, вызывая, таким образом, состояние, подобное голоданию ( 18 , 57). Это приводит к активации киназы AMP (AMPK) и Unc-51, подобной киназе 1, активирующей аутофагию (ULK1), ингибированию mTORC1 и индукции аутофагии. Попадая в цитоплазму, трегалоза также индуцировала аутофагию, и эти авторы признали, что внутриклеточные действия трегалозы могут не ограничиваться ингибированием транспорта глюкозы, активацией AMPK и ULK1 и ингибированием mTORC1, особенно в типах клеток, отличных от гепатоцитов ( 57 ). Мы были очень заинтересованы в этих результатах, поскольку другие ранее показали, что клетки, инфицированные HCMV, показывают увеличение поглощения глюкозы ( 25 ) и что блокирование опосредованного GLUT4 транспорта глюкозы во время инфекции приводит к снижению продукции вируса ( 26).). Напротив, наши исследования показали, что как в неинфицированных, так и в инфицированных HCMV первичных HFF и HAEC трегалоза не оказывала отрицательного влияния на поглощение глюкозы. Возможно, что различия в репертуаре GLUT между HFF и HAEC и типами клеток или системами сверхэкспрессии, используемыми DeBosch et al. ( 18 ) могут объяснить расхождения в наших результатах по сравнению с их результатами. Мы также не наблюдали никаких доказательств ингибирования активности mTORC1 в любом типе клеток на основе фосфорилирования S6K (данные не показаны). Наши результаты не отрицают потенциальной важности лечения трегалозой для стеатоза печени с помощью GLUT-опосредованного механизма, но показывают, что интерпретация механизма должна рассматриваться в контексте конкретных исследуемых клеток.