Аннотация
Рассеянный склероз (РС) — это хроническое иммуноопосредованное заболевание центральной нервной системы (ЦНС), характеризующееся нейровоспалением, нейродегенерацией и нарушениями механизмов восстановления, которые приводят к неврологической инвалидности. Суть MS — собственные иммунные клетки пациента, атакующие аутоантигены в ЦНС, а именно миелиновая оболочка, защищающая нервные клетки головного и спинного мозга. Восстановление антиген-специфической толерантности с помощью терапевтической вакцинации является инновационным и захватывающим подходом в терапии РС. Действительно, использование попытки организма предотвратить аутоиммунитет, то есть толерантность, фокусируется на первопричине заболевания и может стать ключом к решению проблемы нейровоспаления. С этой точки зрения антиген-специфическая вакцинация нацелена только на вредный и аберрантный иммунный ответ против специфического ассоциированного с заболеванием антигена (ов), сохраняя при этом способность иммунной системы реагировать на неродственные антигены. Мы рассматриваем экспериментальные подходы к толерантной индуцирующей вакцинации при рецидивирующих и прогрессирующих формах МС, которые достигли фазы клинической разработки, включая вакцинацию аутологичными Т-клетками, аутологичными толерогенными дендритными клетками, вакцинацией пептидом Т-клеточного рецептора, измененным пептидным лигандом, ATX-MS -1467, кластер дифференцировки (CD) -206-мишеней, липосомные миелиновые основные белковые пептиды и ДНК-вакцинация. Неудачи, успехи и будущие направления обсуждаются. Мы рассматриваем экспериментальные подходы к толерантной индуцирующей вакцинации при рецидивирующих и прогрессирующих формах МС, которые достигли фазы клинической разработки, включая вакцинацию аутологичными Т-клетками, аутологичными толерогенными дендритными клетками, вакцинацией пептидом Т-клеточного рецептора, измененным пептидным лигандом, ATX-MS -1467, кластер дифференцировки (CD) -206-мишеней, липосомные миелиновые основные белковые пептиды и ДНК-вакцинация. Неудачи, успехи и будущие направления обсуждаются. Мы рассматриваем экспериментальные подходы к толерантной индуцирующей вакцинации при рецидивирующих и прогрессирующих формах МС, которые достигли фазы клинической разработки, включая вакцинацию аутологичными Т-клетками, аутологичными толерогенными дендритными клетками, вакцинацией пептидом Т-клеточного рецептора, измененным пептидным лигандом, ATX-MS -1467, кластер дифференцировки (CD) -206-мишеней, липосомные миелиновые основные белковые пептиды и ДНК-вакцинация. Неудачи, успехи и будущие направления обсуждаются.
Ключевые моменты
| Теоретически, антигенспецифическая терапевтическая вакцинация предназначена специально для восстановления толерантности к себе. При этом пути, связанные с заболеванием, точно нацелены, не вызывая общей иммуносупрессии. |
| Несколько экспериментальных подходов достигли стадии клинической разработки. Безопасность и осуществимость были продемонстрированы в нескольких испытаниях фазы I / II. |
| Можно предположить, что антиген-специфическая терапевтическая вакцинация окажется весьма актуальной, особенно на ранней стадии заболевания, когда распространение эпитопа еще не произошло. |
1 Введение
Рассеянный склероз (РС) — это хроническое воспалительное заболевание центральной нервной системы (ЦНС), вызванное иммуноопосредованным повреждением миелиновой оболочки. Это приводит к потере аксонов и нейродегенерации, которые приводят к неврологической инвалидности [ 1 , 2 , 3]. В последние годы непрерывное развитие более селективных методов лечения заболеваний (ДМТ) для лечения РС резко изменило ситуацию. В целом, ДМТ являются терапевтическими вмешательствами, целью которых является изменение основной патофизиологии заболевания для улучшения течения заболевания. При рассеянном склерозе это может быть достигнуто с помощью нейропротективных, нейрореставрационных и / или иммуномодулирующих стратегий. Здесь мы сосредоточимся на последнем. Некоторые иммуномодулирующие агенты продемонстрировали благоприятные клинические эффекты при различных формах РС. Тем не менее, остаются некоторые проблемы, связанные с этим лечением, в том числе проблемы с переносимостью, трудности соблюдения и приверженности, а также потенциально серьезные побочные эффекты, связанные с лечением, такие как оппортунистические инфекции, вторичный аутоиммунитет и повышенный риск развития злокачественных новообразований [ 4 ,5 ]. Несмотря на то, что в настоящее время доступно более десяти доступных на рынке лекарств, которые продемонстрировали разную эффективность в лечении РС с ремиттирующим течением (RRMS), остается значительная и неудовлетворенная потребность в более безопасных и высокоэффективных методах лечения, которые хорошо переносятся. Потребность в лечении, которое может остановить или замедлить прогрессирование или улучшить инвалидность при прогрессирующих формах РС, еще выше; на сегодняшний день только один препарат был одобрен для лечения первичной прогрессирующей РС (ППМС).
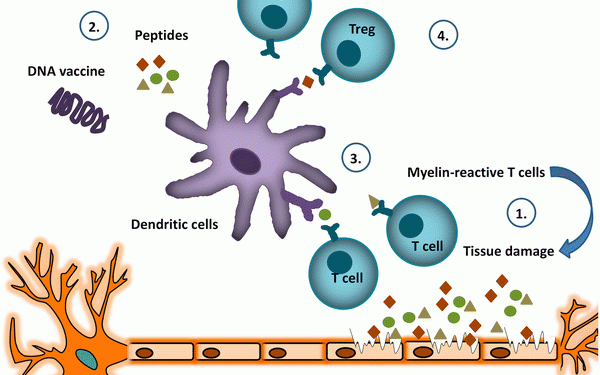
Учитывая это, более селективные иммунотерапии, предназначенные для восстановления собственной толерантности, таким образом восстанавливая иммунный баланс, не вызывая общего подавления иммунитета, могут быть перспективными для лечения аутоиммунитета, включая РС. Поскольку теоретически антигенспецифическая терапия сочетает в себе максимальную эффективность с минимальными побочными эффектами, эти стратегии особенно привлекательны [ 6 , 7 ]. Тем не менее, для многих аутоиммунных заболеваний первичный целевой антиген еще предстоит идентифицировать. Также при MS целевой антиген (ы) неизвестен, хотя белки в миелиновой оболочке, такие как миелиновый основной белок (MBP), миелиновый олигодендроцитный гликопротеин (MOG) и протеолипидный белок (PLP), являются важными мишенями для аутореактивный иммунный ответ [ 4 , 8, 9 , 10 , 11 ]. Следовательно, попытки вызвать антиген-специфическую толерантность при MS включают пероральное введение миелиновых белков, внутривенную инъекцию MBP [ 5 ] или измененного пептидного лиганда (APL) [ 8 ], трансдермальное [ 6 , 7 ] или внутрикожное [ 12 ] введение миелина -производные пептиды и внутримышечные инъекции плазмид, экспрессирующих MBP [ 13 ]. Стратегии вакцинации на основе клеток, такие как Т-клетки, апоптотические лимфоциты, ковалентно связанные с несколькими пептидами из разных белков, происходящих из миелина [ 14 , 15], или индуцирующие толерантность дендритные клетки (ДК), также были изучены и, по-видимому, отражают более селективные методы лечения РС.Мы рассматриваем экспериментальные подходы к толерантной вакцинации при рецидивирующих и прогрессирующих формах РС, которые достигли фазы клинического развития (Таблица 1 ), и обсуждаем неудачи, успехи и будущие направления.Таблица 1
Обзор толерантных терапевтических подходов, поступивших в клинику для лечения рассеянного склероза
| Стратегия вакцинации | Прогресс в развитии | Администрация маршрута | Клинические результаты | Режим действия | Ссылки |
|---|---|---|---|---|---|
| Пептидная толерантная вакцинация | |||||
| Пептиды MOG, MBP, PLP | Фаза I / II | Трансдермальные | Снижение ARR; снижение МРТ измерения заболевания | Активация клеток Лангерганса; поколение IL-10-секретирующих клеток | [ 6 , 7 ] |
| Измененный пептидный лиганд | Halted | подкожный | Увеличение количества активных поражений на 62%; два пациента продемонстрировали обострения заболевания, связанные со стратегией вакцинации | [ 8 ] | |
| Apitopes (ATX-MS-1467) | Фаза IIa | внутрикожный | Сейф; снижение новых Gd повышающих поражений 79% | Расширение Трег | [ 20 , 21 ] |
| Маннозилированные липосомы, содержащие пептиды MBP | Фаза I | подкожный | Сейф | Снижение CCL2, CCL4, IL-7 и IL-2 по завершении исследования | [ 22 , 23 ] |
| TCR-пептид вакцинации (Neurovax) | Фаза I | Как внутрикожный, так и внутримышечный | Сейф | Получение IL-1-секретирующих TCR-пептид-специфических T-клеток; уменьшение MBP-специфических Т-клеток | [ 25 , 26 , 27 , 28 , 29 , 30 , 31 ] |
| ДНК-вакцинация | |||||
| MBP-кодирующая ДНК-вакцина | Фаза II | внутримышечный | Безопасно и хорошо переносится; уменьшение количества активных поражений; снижение частоты клинических рецидивов | Снижение IFN-γ-продуцирующих миелин-реактивных Т-клеток; снижение миелин-специфических титров аутоантител в СМЖ | [ 13 , 34 ] |
| толерантность к индукции вакцинации на основе клеток | |||||
| Облученные аутологичные Т-клетки | Фаза I | подкожный | Безопасный и выполнимый; Снижение частоты рецидивов на 40%; стабилизация прогрессирования заболевания и активности поражения на МРТ | Генерация цитотоксического Т-клеточного ответа против миелин-реактивных клеток; истощение миелин-реактивных Т-клеток | [ 41 ] |
| Смесь аттенуированных миелин-реактивных Т-клеток (Tcelna) | Фаза IIb | подкожный | Клинические конечные точки не достигнуты (подробности не опубликованы) | [ 45 ], NCT01684761 | |
| Аутологичный РВМС, химически связанный со смесью производных миелина пептидов | Фаза I | внутривенное | Безопасный и выполнимый; стабилизация клинических и МРТ показателей активности заболевания при завершении исследования | Снижение миелин-специфической реактивности Т-клеток у пациентов, получавших наибольшую дозу клеток (> 1 × 10 9) | [ 49 ] |
| tolDC пульсировал миелиновыми пептидами | Фаза I | внутрикожный | постоянный | постоянный | NCT02618902 |
| tolDC пульсировал миелиновыми пептидами | Фаза I | Intranodal | постоянный | постоянный | NCT02903537 |
| tolDC пульсировал миелиновыми пептидами | Фаза I | внутривенное | постоянный | постоянный | NCT02283671 |
ARR годовом частота рецидивов, CSF , цереброспинальная жидкость, Б — г гадолиний, ИФН — интерферон, IL интерлейкин, МВР основного белок миелин, MOG миелин олигодендроциты гликопротеин, МРТ магнитно — резонансная томография, РВМСмононуклеарные клеток периферической крови, ПЛП протеолипидного белка, очкипациентов, TCR Т-клеток рецептор, tolDC толерогенные дендритные клетки, Tregрегуляторные T-клетки
2 Терапевтическое средство, стимулирующее толерантность
2.1 Вакцинация, индуцирующая толерантность на основе пептидов
До настоящего времени индукция антиген-специфической толерантности in vivo путем подкожного или перорального введения пептидов (т.е. пептидной вакцинации) оказалась хорошо переносимой и успешной терапией для аллергий [ 16 , 17 , 18 ]. Учитывая успех при аллергии, изучается возможность лечения РС с помощью пептидной вакцинации. Некоторые из наиболее многообещающих результатов были описаны Jurynczyk et al. [ 6 ] и Walczak et al. [ 7 ] В исследованиях / II , в которых исследователи трансдермально применяемые пептиды , полученные из MOG, МВР и PLP двух фаз I. Они продемонстрировали индукцию иммунологической толерантности путем активации клеток Лангерганса и последующей индукции Т-клеток, секретирующих интерлейкин (IL) -10 [ 7]. Кроме того, иммунологический эффект был клинически переведен в плацебо-контролируемом исследовании, которое продемонстрировало значительное снижение годовой частоты рецидивов и магнитно-резонансной томографии (МРТ), определяемых заболеванием [ 7 ]. Интересно, что более низкие концентрации пептидов после внутримышечного [ 13 ] и трансдермального [ 7] администрация достигла еще лучшего клинического результата, подчеркивая важность дозировки для достижения толерантности. Тем не менее, хотя известно, что пептидная вакцинация индуцирует толерантность в стационарных условиях, после введения в провоспалительной среде можно ожидать неожиданных побочных эффектов. Действительно, три пациента в фазе II клинического испытания, исследующего вакцинацию APL, полученной из MBP, в которой аминокислотные замены были включены в положениях контакта Т-клеточного рецептора (TCR), продемонстрировали обострения заболевания после лечения. Четкая связь со стратегией вакцинации была продемонстрирована у двух пациентов даже после того, как доза была снижена, и исследование было остановлено [ 8 , 19 ].
Альтернативно, растворимые синтетические пептиды были сконструированы так, чтобы имитировать природно обработанные эпитопы. Эти так называемые апитопы вызывают антигенспецифическую экспансию регуляторных Т-клеток, способных «выключать» патогенные Т-клетки, которые продуцируют провоспалительные цитокины и ответственны за повреждение миелина в ЦНС. В этом контексте два клинических испытания недавно завершили оценку параметров безопасности и биологических свойств ATX-MS-1467, смеси четырех коротких пептидов, полученных из MBP, то есть ATX-MS1 (MBP 30-44 ), ATX-MS4. (MBP 131-145 ), ATX-MS6 (MBP 140-154 ) и ATX-MS7 (MBP 83-99). ATX-MS-1467 вводится внутрикожно каждые 2 недели в течение 20 недель. Пациенты сначала получают дозу титрования 50 и 200 мкг в течение 4 недель, затем дозу 800 мкг каждые 2 недели в течение 16 недель. Открытое исследование фазы I с повышением дозы продемонстрировало, что ATX-MS-1467 был безопасным и хорошо переносимым в группе из шести пациентов с вторично-прогрессирующим MS (SPMS), вплоть до дозы 800 мкг [ 20].]. Недавнее многоцентровое открытое клиническое исследование фазы IIa на одной руке с контролируемым исходным уровнем (NCT01973491) оценило клинические и биологические эффекты ATX-MS-1467 у 19 пациентов с рецидивирующим РС (RMS). Серьезных нежелательных явлений, связанных с лечением, не наблюдалось, а профиль нежелательных явлений был умеренным, у <50% пациентов наблюдались местные реакции в месте инъекции. Хотя не было группы плацебо, с которой можно было бы сравнивать результаты, обзор данных МРТ показал, что лечение ATX-MS-1467 привело к 78% -ному уменьшению новых очагов, усиливающих гадолиний T1, по сравнению с исходным уровнем [ 21 ].
Чтобы задействовать Т-клетки, специфичные для естественно обработанного антигена, и служить толерогеном, пептиды должны достигать резидентных антиген-презентирующих клеток in vivo. Этот процесс может быть облегчен путем нацеливания на специфические маркеры, экспрессируемые на поверхности антигенпрезентирующих клеток. Например, кластер дифференцировки маннозных рецепторов (CD) -206 представляет собой лектин С-типа, в основном присутствующий на мембране макрофагов и незрелых ДК. В этом контексте инкапсуляция выбранных иммунодоминантных пептидов MBP в маннозилированные липосомы значительно увеличивала поглощение пептидов DC посредством рецептора CD206. Это привело к иммунной толерантности к антигенам, полученным из миелина. CD206-направленная доставка липосомальной совместного инкапсулированного иммунодоминантного MBP последовательностей МВР 46-62 , МВР 124-139 и МВР147–170 (Xemys ™, ОАО «Фармсинтез», Москва, Россия) было исследовано в фазе I, многоцентровом, открытом, повышающем дозу исследовании безопасности и доказательства концепции у пациентов с RRMS или SPMS с рецидивами, для которых первыми линия DMT провалилась. Пациенты получали шесть еженедельных подкожных инъекций с добавочными дозами от 50 до 900 мкг. После последней инъекции пациенты наблюдались в течение 12 недель. Никаких дозозависимых токсичности во время лечения не наблюдалось. Местные реакции в месте инъекции были наиболее частым нежелательным явлением [ 22 ]. Интересно, что статистически значимое снижение по сравнению с исходным уровнем наблюдалось в сыворотке CCL2, CCL4, IL-7 и IL-2 в конце исследования (18 неделя) [ 23 ].
Совершенно другой подход достигается с помощью пептидной вакцинации TCR. При этом короткие аминокислотные последовательности, полученные из TCR патогенных клонов Т-клеток, вводят в попытке индуцировать Т-клеточную иммунорегуляцию, направленную на Т-клетки, экспрессирующие эти TCR. Репертуар TCR-пептид-реактивных Т-клеток положительно отбирается в тимусе после истощения отрицательно отобранных клонотипов, и было выдвинуто предположение, что TCR-специфические Т-клетки могут представлять собой подмножество естественно индуцированных регуляторных Т-клеток. Сообщалось, что у пациентов с РС репертуар активированных Т-клеток Vβ преимущественно происходит из семейств Vβ5.2 и Vβ6.1 [ 24].]. Следовательно, в нескольких клинических испытаниях было исследовано введение дополнительных доз пептидов TCR Vβ5.2 и Vβ6.1. Внутрикожная инъекция синтетических пептидов TCR Vβ5.2 привела к клиническому улучшению, связанному с полезными иммунологическими эффектами, такими как образование TCR-специфических пептид-клеток и снижение MBP-специфических T-клеток, в двойном слепом плацебо-контролируемом исследовании в 22 пациенты с прогрессирующим МС [ 25 ]. Повторные внутримышечные инъекции пептида TCRVβ6 также приводили к иммунорегуляторным эффектам, что требует дальнейшего изучения этого подхода при лечении рассеянного склероза [ 26 ]. Введение обоих пептидов было безопасным и не ухудшало течение болезни после обоих способов введения [ 27]. Кроме того, пептид-специфический иммунный ответ был индуцирован у 50–60% пациентов с МС после внутрикожной инъекции пептидов TCR Vβ5,2, тогда как у 90% пациентов с МС был продемонстрирован измеримый иммунитет Т-клеток к пептидам Vβ6 при внутримышечной инъекции в инактивированный адъювант Фрейнда (ИФА). Для этого было выдвинуто предположение, что вакцина, состоящая из трех пептидов TCR (BV5S2, BV6S5 и BV13S1), эмульгированных в IFA, будет более иммуногенной, чем три пептида в одном физиологическом растворе. Трехвалентная пептидная вакцина TCR, теперь называемая Neurovax (Immune Response BioPharma, Атлантик-Сити, штат Нью-Джерси, США), была исследована в нескольких клинических испытаниях и была признана безопасной и вызывающей всплеск пролиферирующего секретирующего IL-1 TCR пептид-специфического T клетки [ 28 , 29 , 30, 31 ]. Фаза IIb на пациентах с SPMS (клинический идентификатор trials.gov NCT02057159) для изучения эффективности и безопасности вакцины еще не началась.
2.2 ДНК-вакцинация
BHT-3009 представляет собой ДНК-вакцину, которая изготовлена из генно-инженерной ДНК, кодирующей полноразмерный MBP человека [ 32 , 33]. Плазмидный остов был модифицирован таким образом, чтобы он мог привести к благоприятным иммунологическим изменениям у пациентов с МС (уменьшение количества иммуностимулирующих мотивов CpG и увеличение количества иммуноингибирующих мотивов GpG). Его цель — восстановить толерантность к себе, оставив защитный иммунитет против инфекционных и опухолевых антигенов без изменений. BHT-3009 впервые был исследован в рандомизированном плацебо-контролируемом исследовании фазы I / II у пациентов с RRMS или SPMS и было показано, что он безопасен и хорошо переносится. Более того, уменьшение контрастирующих поражений при МРТ сопровождалось уменьшением пролиферации интерферон-γ-продуцирующих миелин-реактивных Т-клеток и снижением титров миелин-специфических аутоантител в спинномозговой жидкости [ 34]. Затем было проведено рандомизированное плацебо-контролируемое исследование II фазы по сравнению двух доз BHT-3009 у 289 пациентов с RRMS. Примечательно, что высокая доза 1,5 мг была неэффективной, но низкая доза 0,5 мг показала тенденцию к уменьшению на 50–61% числа новых усиливающих поражений по сравнению с плацебо ( р = 0,07). Кроме того, наблюдалось глубокое снижение титров миелин-специфических аутоантител, свидетельствующих об индукции антиген-специфической иммунной толерантности. Тем не менее, никаких положительных эффектов на течение заболевания не наблюдалось [ 13 ], и вопрос о том, войдет ли вакцина в фазу III клинических испытаний, еще неизвестно.
2.3 Клеточная вакцинация, индуцирующая толерантность
2.3.1 Т-клеточная вакцинация
Предполагается, что аутологичная Т-клеточная вакцинация истощает или регулирует патогенные миелин-реактивные Т-клетки, которые поддерживают аутоиммунные процессы в ЦНС пациентов с МС [ 35 , 36 ]. Вакцина состоит из собственных миелин-специфических Т-клеток пациента, выделенных из периферической крови, которые инактивируются облучением. После введения аутологичной Т-клеточной вакцины выявляется иммунный ответ для устранения других патогенных Т-клеток в кровотоке пациента без воздействия на остальную иммунную систему [ 37 ]. Стиниссен и соавт. [ 38] и другие [ 39 , 40] продемонстрировали, что, кроме местных реакций, вызванных инъекцией продукта, вакцинация аутологичными Т-клетками была безопасной и выполнимой у пациентов с РС. Введение облученных, аутологичных MBP-специфических клонов Т-клеток приводило к индукции цитотоксического ответа CD8 + T-клеток, направленного против MBP-реактивных Т-клеток, используемых для вакцинации. Следовательно, циркулирующие MBP-реактивные Т-клетки также были обнаружены и разрушены у пациентов с РС, получающих аутологичную Т-клеточную вакцину [ 38].]. Кроме того, истощение MBP-реактивных Т-клеток после трех последовательных инъекций с интервалами 6-8 недель с аутологичной Т-клеточной вакцинацией коррелировало с 40% снижением частоты рецидивов в течение 12-24 месяцев после первой инъекции, как по сравнению с исходным уровнем. Кроме того, прогрессирование заболевания стабилизировалось, в том числе активность поражения при МРТ [ 41 , 42 ]. Тем не менее, ускорение в прогрессии через 12 месяцев после последней инъекции предполагает снижение эффективности со временем аутологичной Т-клеточной вакцинации, что требует повторных инъекций [ 41 ]. Действительно, вновь появляющиеся миелин-реактивные клоны Т-клеток могут быть эффективно истощены дополнительными прививками [ 43 ].
Было выдвинуто предположение, что иммунный потенциал вакцинации аутологичными Т-клетками может быть повышен путем использования более одного производного миелина пептида для отбора Т-клеток [ 44 ], поэтому вакцина Т-клеток, состоящая из аттенуированных миелин-реактивных Т-клеток (MRTCs). ), отобранных из множества пептидов, полученных из MBP, PLP и MOG. Эта вакцина, Tcelna ® (имилуклеуцел-T, ранее известная как Tovaxin ® ), была оценена в рандомизированном двойном слепом плацебо-контролируемом исследовании фазы IIb (идентификатор clintrials.gov: NCT01684761) после предыдущего выбора соответствующей схемы приема дозы [ 45 ]. Пациенты с СПМС ( н = 183), которые продемонстрировали реактивность Т-клеток по крайней мере к одному из использованных производных миелина пептидов, получили два цикла вакцинации из пяти подкожных инъекций Tcelna ® в год [ 46 ]. Тем не менее, Tcelna ® не достигла своих первичных или вторичных конечных точек, то есть снижения изменения объема мозга и снижения скорости устойчивого прогрессирования заболевания, соответственно. Тем не менее, многообещающие результаты, полученные в другом, хотя и небольшом, плацебо-контролируемом клиническом исследовании у 26 пациентов с прогрессирующим рецидивирующим рассеянным склерозом [ 47 ], могут подчеркнуть важность тщательного отбора пациентов и разработки клинического исследования.
2.3.2. Аутологичные лейкоциты, химически связанные с множественными миелиновыми пептидами
Чтобы одновременно воздействовать на аутореактивные Т-клетки, специфичные для множественных миелиновых эпитопов, можно использовать смесь пептидов, полученных из миелина. Белекова и соавт. [ 9 ] ранее идентифицировали шесть миелиновых пептидов (MBP 13–32 , MBP 111–129 , MBP 154–170 , PLP 139–154 , MOG 1–20 и MOG 35–55 ), которые были иммунодоминантными для T с высокой авидностью клетки и могут различать пациентов с РС и здоровых людей. Седьмой иммунодоминантный пептид, MBP 83–99 , был идентифицирован в нескольких других исследованиях [ 10 , 48 ], в том числе в фазе IIa клинических испытаний с тестированием APL MBP 83–99при котором отмечалось ухудшение активности МРТ головного мозга и заболевание МС [ 8 ]. Грау-Лопес и соавт. [ 11 ] подтвердили актуальность этого сочетания миелиновых пептидов в патогенезе МС, продемонстрировав положительный Т-клеточный пролиферативный ответ на эту пептидную смесь у 74% пациентов с RRMS по сравнению с 30% здоровых контролей. Люттеротти и соавт. [ 49] продемонстрировали выполнимость и безопасность этого выбранного пула пептидов в антигенспецифическом и клеточном подходе толризации in vivo. Они выполнили исследование по увеличению дозы у девяти пациентов с РС, получавших однократную инфузию аутологичных мононуклеарных клеток периферической крови, получивших импульс с этими семью производными миелина и химически фиксированные с помощью сшивающего агента 1-этил-3- (3-диметиламинопропил) -карбодиимида (ДХЭ). Авторы пришли к выводу, что антигенсвязанные клетки хорошо переносились и имели благоприятный профиль безопасности [ 49 ]. Многоцентровое исследование IIa фазы оценки эффективности и безопасности у пациентов с ранним RRMS находится в стадии подготовки.
2.3.3. Вакцинация толерогенными дендритными клетками
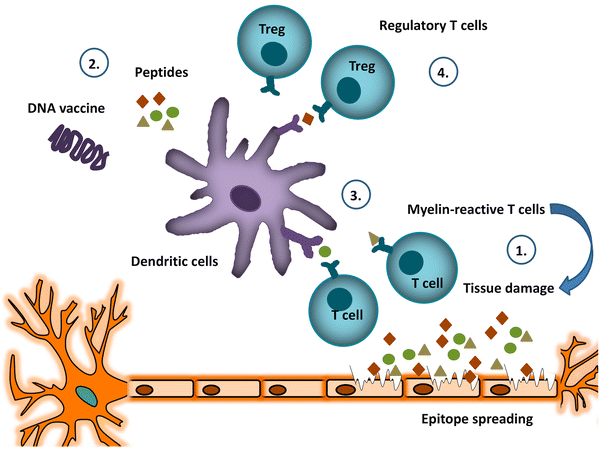
ДК, профессиональные антиген-презентирующие клетки врожденной иммунной системы, играют центральную роль в поляризации наивных Т-клеток в различные эффекторные Т-клетки. При этом ДК играют ключевую роль в поддержании баланса между иммунитетом и толерантностью, как подробно рассмотрено Van Brussel et al. [ 50]. Несколько механизмов, с помощью которых DC поддерживают периферическую толерантность, были определены. Действительно, устойчивые и индуцирующие толерантность или толерогенные ДК (tolDC) демонстрируют сниженные уровни экспрессии костимуляторных маркеров, что приводит к анергии или делеции Т-клеток. Кроме того, tolDCs экспрессируют так называемые связанные с мембраной костимулирующие молекулы, такие как иммуноглобулин-подобный транскрипт (ILT) -3 и запрограммированный лиганд смерти (PD-L) -1, и иммуносупрессивные растворимые факторы, такие как IL-10, которые могут индуцируют и / или расширяют регуляторные Т-клетки, тем самым инициируя процесс, называемый «инфекционная толерантность» [ 50 , 51 , 52]. Эти специализированные особенности ДК привели к разработке методов лечения на основе ДК для генерирования антиген-специфической толерантности, восстановления иммунологического дисбаланса при аутоиммунных расстройствах, включая МС.
На сегодняшний день несколько биологических и фармакологических агентов были оценены для создания tolDCs in vitro. Мы [ 53 ] и другие [ 54 , 55 , 56 ] показали, что обработка in vitro DC, полученных из моноцитов, противовоспалительными биологическими средствами, включая витамин D 3 , приводила к устойчивому к созреванию фенотипу DC как у здоровых контролей, так и у пациентов. с MS. TolDC, обработанные витамином D 3, индуцировали миелин-специфическую гипореактивность Т-клеток, тогда как стимулированные tolDC Т-клетки сохраняли способность реагировать на неродственный антиген. Эта гипореактивность была сильной, поскольку Т-клетки не реактивировались после повторного заражения иммуностимулирующими DC [ 53].]. Кроме того, лечение экспериментального аутоиммунного энцефаломиелита (EAE), животной модели MS, с использованием tolDCs, обработанного витамином D 3 изкостного мозга, обработанного MOG 40–55, значительно снижало частоту EAE при профилактическом применении и приводило к клиническому улучшению при применении после EAE индукция [ 57 , 58 ]. Следует отметить, что повторные инъекции MOL 40-55- импульсных tolDCs были необходимы для поддержания благоприятного влияния на течение заболевания.
Недавно были завершены четыре исследования фазы I, посвященные изучению безопасности и целесообразности применения tolDC-терапии при аутоиммунных заболеваниях [ 59 , 60 , 61 , 62 , 63 , 64].]. В целом, эти клинические исследования показали, что терапия tolDC была хорошо переносимой и безопасной в исследуемых популяциях пациентов. В этих исследованиях не было выявлено заметных побочных эффектов или токсичности. Следовательно, эти обнадеживающие результаты открывают путь для более масштабных исследований, посвященных изучению эффективности, а также для внедрения применения tolDCs при других аутоиммунных заболеваниях, включая рассеянный склероз. На сегодняшний день продолжаются три открытых клинических испытания, одноцентровых, фазы I, оценивающих безопасность и переносимость пептидов tolDC, полученных из миелиновых пептидов, вводимых внутрикожно, интранодально или внутривенно (clintrials.gov идентификаторы NCT02618902, NCT02903537 и NCT02283671) ,
3 Обсуждение
Чтобы вступить в новую эру для разработки новых стратегий лечения РС, необходимо ориентироваться только на те пути, которые способствуют патогенезу заболевания. Как указывалось выше, было приложено много усилий для того, чтобы точно заглушить только те иммунные реакции, которые являются вредными для заболевания. До настоящего времени результаты начальных исследований, включающих индукцию антиген-специфической толерантности, были многообещающими, хотя в основном у пациентов с RRMS. Кроме того, при рассеянном склерозе широкий спектр антигенов, полученных из миелина, является мишенью для большого разнообразия Т- и В-клеток. Кроме того, предполагается, что прогрессирование MS и возникновение рецидивов связано с распространением эпитопа, процессом, характеризующимся потерей толерантности к эндогенным антигенам, высвобождаемым во время воспалительного или аутоиммунного обострения. Следовательно, 1 ) Действительно, после обработки BHT-3009, ДНК-вакциной, кодирующей полноразмерный MBP, наблюдалась индукция иммунной толерантности, которая распространялась за пределы MBP на другие антигены, полученные из миелина, такие как PLP, MOG и αβ-кристаллин [34 ]. Несколько других стратегий вакцинации, индуцирующих толерантность, направлены на противодействие распространению эпитопа путем включения множества эпитопов, полученных из миелина, таким образом нацеливаясь на миелин-реактивные Т-клетки с множественной специфичностью. Тем не менее, остаются многочисленные вопросы, в том числе о дозе, пути и частоте введения, прежде чем стратегии вакцинации, индуцирующей толерантность, станут широко доступными для широкого круга пациентов.
Хотя оптимальная доза для индуцирующей толерантность терапевтической вакцинации еще не определена, было показано, что более низкие концентрации пептидов после внутримышечного [ 13 ], а также трансдермального [ 7 ] введения достигли лучших клинических результатов, чем более высокие дозы для индукции толерантности. , Аналогично, на модели ревматоидного артрита на животных было показано, что показатель заболевания улучшается у мышей, получающих более низкие дозы tolDCs, но ухудшается у мышей, получающих более высокие дозы [ 65 ]. Напротив, Lutterotti et al. [ 49] продемонстрировали снижение специфической миелиновой реактивности Т-клеток только при использовании самой высокой дозы клеток, химически связанных со смесью производных миелина пептидов. Однако о минимальной дозе, необходимой для терапевтического эффекта, известно меньше. Кроме того, чтобы гарантировать, что способность регулировать аутоиммунный ответ является постоянной или, по меньшей мере, длится в течение нескольких лет после вмешательства, может потребоваться ряд повторных инъекций с индуцирующим толерантность средством. В частности, для стратегий, индуцирующих толерантность на основе клеток, необходимы готовые к употреблению аликвоты для клинических применений, использующих криоконсервацию. Недавно мы продемонстрировали, что после цикла замораживания-оттаивания tolDCs сохраняют свои фенотипические и функциональные свойства по сравнению со свежеприготовленными DC [ 53].]. Эти данные подтверждают и облегчают широкое применение в клинической практике вакцинации на основе толерантности на основе клеток.
При рассмотрении пути доставки индуцирующей толерантность терапевтической вакцинации следует учитывать, что разные пути приводят к разным участкам накопления вводимого продукта, тогда как для эффективной индукции толерантности необходимо взаимодействовать с аутореактивными Т-клетками, что в основном требует место в лимфатических узлах. Тем не менее, прямая инъекция в лимфатический узел технически очень сложна и может повредить структуру лимфатического узла. Кроме того, это повреждение ткани может вызвать нежелательную провоспалительную микросреду. Именно по этой причине, большинство продуктов, индуцирующих толерантность, вводят в кожу, включающую арсенал иммунокомпетентных клеток, способных перемещать терапевтический агент в дренирующий лимфатический узел, или из которых, где лечение, индуцирующее толерантность, может непосредственно найти путь к дренирующему лимфатическому узлу. Было показано, что миграция в направлении лимфатических узлов намного ниже после подкожной инъекции, чем после внутрикожной инъекции, тогда как миграция внутривенно инъецированных клеток до сих пор не контролировалась у людей [66 ,67 ,68 ]. Тем не менее, исследования in vivo у больных раком показали, что после внутрикожной инъекции только 2–4% ДК мигрируют в дренирующие лимфатические узлы [69 ]. Наши недавние результаты показывают, что миграционная способность этих клеток может быть оптимизирована путем введения мессенджер-РНК (мРНК), кодирующей рецепторы хемокинов. При этом мы смогли наделить tDDC способностью мигрировать через гематоэнцефалический барьер путем введения экспрессии белка de novo C-C-хемокинового рецептора (CCR) -5. Активное перемещение клеток через гематоэнцефалический барьер позволит целенаправленно подавлять аутоиммунные ответы при МС при in situ [70 ].
4 Заключение
Хотя современные ДМТ продемонстрировали явную эффективность, они сопровождаются значительными, иногда опасными для жизни, побочными эффектами. Кроме того, современные методы лечения, как правило, задерживают, но не предотвращают прогрессирование заболевания, а это означает, что у многих пациентов в какой-то момент все равно разовьется прогрессирующий РС. Можно предположить, что разработка новых антиген-специфических иммуномодулирующих стратегий, как изложено здесь, окажется весьма актуальной, особенно на ранних стадиях заболевания, когда распространение эпитопа еще не произошло. Несколько испытаний фазы I / II продемонстрировали безопасность и выполнимость стратегий терапевтической вакцинации от РС. Однако, хотя немецкий нобелевский лауреат Пауль Эрлих представлял идеальную терапию от болезней еще в начале 1900-х годов,71 ]. На сегодняшний день этого можно обойти, набрав только пациентов, которые демонстрируют реактивность по отношению к производным миелина антигенам, представляющим интерес в соответствующих стратегиях терапевтической вакцинации, хотя конечной мечтой было бы создание схемы аутоантигена для каждого пациента, для которой персонализированный вакцина может быть сделана на заказ. До тех пор будущие стратегии должны быть направлены на то, чтобы индуцировать толерантность к нескольким антигенам, производным от миелина, на ранних стадиях заболевания, когда распространение эпитопа практически отсутствует.