Тетрагидроканнабинол (ТГК), основное биологически активное соединение, содержащееся в растении Cannabis sativa., проявляет свое действие, активируя каннабиноидные рецепторы, присутствующие во многих нервных клетках. Рецепторы каннабиноидов также физиологически задействованы эндогенными каннабиноидными соединениями, так называемыми эндоканнабиноидами. В частности, эндоканнабиноид 2-арахидоноилглицерин был выделен как важный модулятор развития олигодендроцитов (OL) на эмбриональных стадиях и в моделях демиелинизации на животных. Однако потенциальное влияние воздействия ТГК на развитие линии OL в критические периоды постнатальной миелинизации никогда не исследовалось. Здесь мы показываем, что острое введение ТГК в раннем постнатальном возрасте у мышей усиливает развитие (OL) и миелинизацию ЦНС в подкорковом белом веществе, способствуя выходу из клеточного цикла-предшественника олигодендроцитов и дифференцировке. Механически миелинизация, индуцированная ТГК, опосредуется CB1 и CB 2 каннабиноидных рецепторов, что продемонстрировано блокадой действия ТГК селективными антагонистами рецепторов. Более того, ТГК-опосредованная модуляция олигодендроглиальной дифференцировки основана на активации у млекопитающих пути передачи сигналов комплекса 1 рапамицина (mTORC1), так как фармакологическое ингибирование mTORC1 предотвращает эффекты ТГК. Наше исследование определяет ТГК как эффективную фармакологическую стратегию для усиления олигодендрогенеза и миелинизации ЦНС in vivo.
ТГК ускоряет созревание олигодендроцитов (OL)
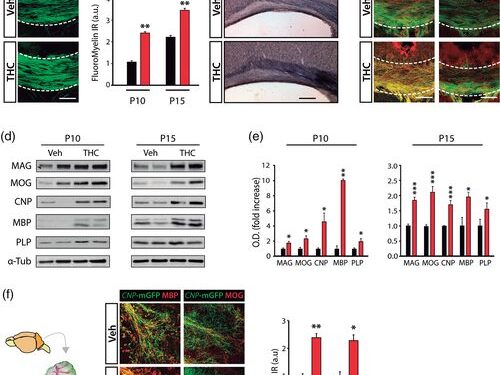
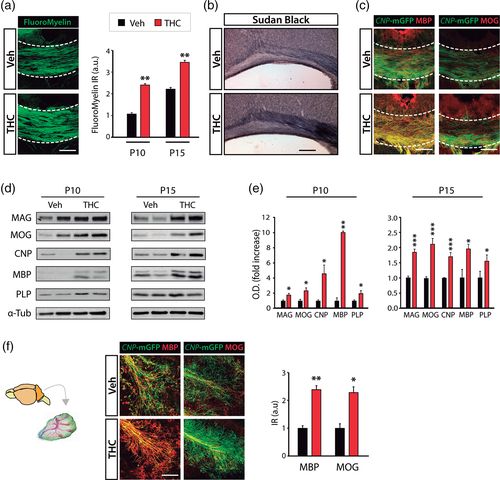
Полный процесс олигодендрогенеза ставит под угрозу переход через несколько стадий развития до образования зрелых полностью дифференцированных миелинизирующих клеток. Таким образом, мы оценили, вызывает ли введение ТГК не только дифференцировку OL, но и усиление образования зрелых миелинизирующих OL. Чтобы ответить на этот вопрос, мы использовали репортерную линию мыши CNP- mGFP (Deng et al., 2014 ), в которой экспрессия mGFP управляется промотором 2′-3′-циклических нуклеотид-3′-фосфодиэстеразы ( CNP ), который экспрессируется в клонах миелинизирующих клеток, что позволяет идентифицировать зрелые миелинизирующие OLs процессы, а также внутренние слои миелиновых оболочек для количественной оценки миелинизации ЦНС. Таким образом, 6-дневный CNPДетенышам мышей -mGFP вводили ТГК или носитель в течение четырех дней подряд, и мозг собирали в разные моменты времени (P10 и P15). Мы выполнили иммунофлуоресцентный анализ и количественно оценили состояние созревания OL в SCWM, включая CC (рисунок 2a – c ) и цингулюм (рисунок 2d ). Мы обнаружили повышенную плотность зрелых миелинизирующие ВЛ, как это отражено в большем числе CNP -mGFP + СС1 + двойных позитивных клеток (рис 2с ), совместно с более высоким процентом СС1 + ВЛ , что выражается зрелый маркер GSTπ (глутатион -S-трансфераза π) и более высокая плотность миелин-ассоциированного гликопротеина (MAG +) клеток в SCWM мышей, получавших ТГК (рис. 2d – g ). В целом, эти данные показывают, что дифференцировка OL, индуцированная ТГК, сопровождается усиленным созреванием OL во время постнатального развития.
Чтобы дополнить эти наблюдения, мы проанализировали влияние ТГК на органотипические срезы мозжечка, полученные от детенышей P8 CNP -mGFP (рис. 2h ). Анализ показал , Иммунофлуоресценции повышенного созревание населения ола в белом веществе ТГК обработанного мозжечка ломтиков , по сравнению с контрольной группой , измеряются как процент от CNP -mGFP + или GSTπ + клеток в пределах СС1 + клеток, и , как МАГ + плотность клеток ( Рисунок 2i – l ). В целом, эти данные показывают, что ТГК индуцирует дифференциацию OPC и увеличивает созревание OL.
3.3 ТГК способствует миелинизации ЦНС
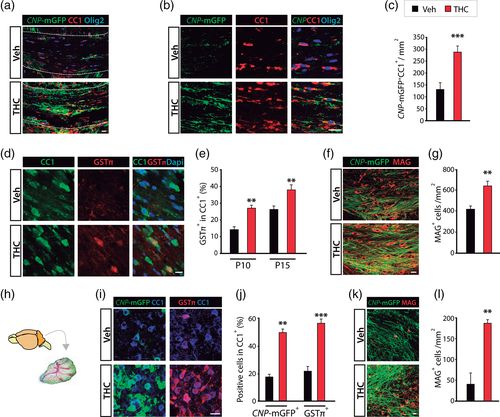
Затем мы оценили, полностью ли завершена дифференцировка OL, вызванная ТГК, и трансформируется ли в усиление миелинизации. Таким образом, ТГК или носитель вводили детенышам P6 CNP- mGFP в течение четырех дней подряд, а миелинизацию SCWM анализировали в критические периоды постнатальной миелинизации. Количественная оценка фтормиелина (рис. 3a ), суданского черного окрашивания (рис. 3b ), сигналов GFP от трансгенной линии CNP- mGFP, а также экспрессии белков миелина MBP (основной белок миелина) и MOG (рис. 3c) показали повышенные уровни миелина и миелин-ассоциированных белков в группах мышей, получавших ТГК, по сравнению с контролем. Кроме того, мы количественно определили уровни миелин-ассоциированного белка в экстрактах SCWM от мышей, получавших ТГК, и контрольных мышей на P10 и P15 с помощью вестерн-блоттинга. Мы обнаружили повышенные уровни белка MBP, PLP, CNP, MOG и MAG в экстрактах SCWM от мышей, получавших ТГК, по сравнению с их контролем (рис. 3d, e ).
Мы расширили эти данные, выполнив эксперименты по культуре органотипических срезов мозжечка (рис. 3f ). Срезы мозжечка от 8-дневных детенышей CNP- mGFP подвергались воздействию ТГК (1 мкМ) или носителя в течение четырех дней подряд. Иммунофлуоресцентный анализ выявил повышенную иммунореактивность к MBP, MOG и CNP- mGFP в белом веществе мозжечка обработанных ТГК срезов по сравнению с контролем (рис. 3f ). В целом эти наблюдения указывают на то, что острое введение ТГК на ранних постнатальных стадиях усиливает созревание OL и миелинизацию ЦНС.
3.4 ТГК модулирует миелинизацию ЦНС посредством активации каннабиноидных рецепторов CB 1 и CB 2
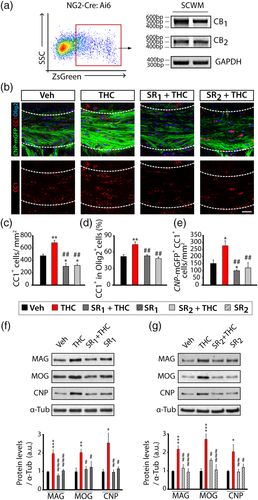
Чтобы изучить механизм, с помощью которого ТГК модулирует развитие OL во время постнатальной миелинизации, мы сначала попытались проанализировать экспрессию рецепторов CB 1 и CB 2 в OL in vivo. С этой целью мышей NG2- Cre скрещивали с мышами Rosa-Ai6, индуцибельным репортерным штаммом, что позволяло Cre-зависимую экспрессию ZsGreen в клетках, производных от OPC. Анализ RT-PCR SCWM FAC-отсортированных клеток на P8 показал экспрессию транскриптов рецепторов CB 1 и CB 2 в клетках линии OLs (рис. 4a ). Чтобы выяснить возможный вклад обоих рецепторов в миелинизацию ЦНС, индуцированную ТГК, мы ввели каннабиноидный рецептор CB 1 (SR141716A, SR 1 ) и CB2 (SR144528, SR 2 ) селективных антагонистов рецептора 2 мг / кг, отдельно или в комбинации с ТГК, за 30 мин до ТГК, один раз в день от P6 до P9 и CNP- mGFP детенышей, и проанализировали дифференцировку OL и миелинизацию SCWM на P15. Иммунофлуоресцентный анализ маркеров OL в срезах SCWM показал, что либо антагонист рецептора CB 1, либо CB 2 предотвращает ускорение дифференцировки OL, индуцированной ТГК (рис. 4b-e ). Вестерн-блот-анализ экстрактов SCWM на P15 показал, что оба антагониста рецепторов предотвращали вызванное ТГК повышение уровней белка миелина в SCWM, таком как MAG, MOG или CNP (рис. 4f, g). Эти данные показывают, что ТГК индуцирует дифференцировку OPC и миелинизацию SCWM, активируя каннабиноидные рецепторы CB 1 и CB 2 .
3.5 ТГК модулирует миелинизацию ЦНС, активируя ось Akt / mTORC1
В последние годы в нескольких исследованиях сообщается о роли сигнального пути Akt / mTORC1 (протеинкиназа B, PKB / млекопитающее, мишень комплекса 1 рапамицина) как важного модулятора дифференцировки OL и миелинизации ЦНС (Gaesser & Fyffe-Maricich, 2016 ; Wood et al., 2013 ). Действительно, каннабиноидные рецепторы, связанные с белком CB 1 и CB 2 G, регулируют этот сигнальный путь в нескольких типах нервных клеток, включая нейроны, нейробласты, клетки глиомы, клетки-предшественники нейронов и OPC (Blazquez et al., 2015 ; Diaz-Alonso et al. al., 2015 ; Gomez et al., 2015 ; Palazuelos, Ortega, Diaz ‐ Alonso, Guzman, & Galve ‐ Roperh, 2012 ; Puighermanal et al.,2009 ; Салазар и др., 2009 ). Таким образом, мы исследовали участие сигнального пути Akt / mTORC1 в THC-индуцированном развитии OL и миелинизации ЦНС. ТГК или носитель вводили детенышам P6 в течение четырех дней подряд, и SCWM анализировали на P15. Вестерн-блот-анализ экстрактов SCWM выявил повышенные уровни фосфорилирования нескольких репрезентативных белков считывания оси Akt / mTORC1, таких как Akt, p70 киназа рибосомного белка S6 (p70S6K), рибосомный белок S6 и фактор инициации трансляции эукариот 4E-BP1 у мышей, получавших THC, как по сравнению с животными, получавшими носитель (рис. 5а, б ). В соответствии с этими данными иммунофлуоресцентная характеристика показала, что введение THC увеличивает pAkt + (рис. 5c ) и pS6.+ (Рис. 5d, f ) CC1 + OLs в SCWM по сравнению с контрольной группой. Следовательно, введение THC активирует сигнальный путь Akt / mTORC1 в клетках линии OL in vivo.
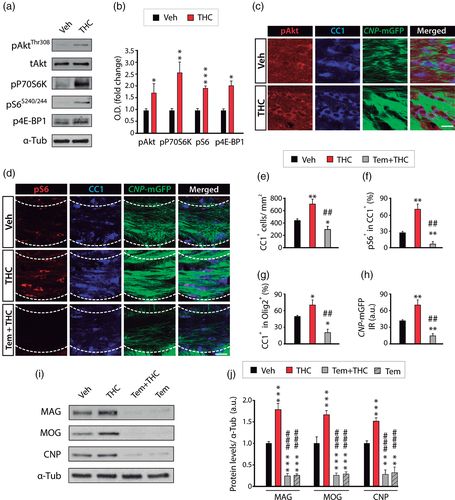
Чтобы оценить участие передачи сигнала mTORC1 в дифференцировке OL, индуцированной THC, мы вводили ингибитор mTORC1 темсиролимус (Tem, 2,5 мг / кг), отдельно или в комбинации с ТГК (за 30 минут до ТГК), один раз в день в течение четырех дней. последовательных дней, и проанализировали постнатальный олигодендрогенез и миелинизацию SCWM. Иммунофлуоресцентный анализ в SCWM показал, что фармакологическая блокада mTORC1 предотвращает влияние THC на развитие OL. Таким образом, введение темсиролимус аннулировал ТНС-индуцированное увеличение СС1 + плотность клеток и PS6 + число клеток в СС1 + клеточной популяции (рис 5d-г ). Наконец, темсиролимус также эффективно предотвращал вызванное ТГК увеличение CNP.-MGFP реактивность в срезах ткани (рис. 5d, h ) и уровни белка миелина в SCWM (рис. 5i, j ). Таким образом, эти находки показывают, что ТГК модулирует развитие OL и миелинизацию SCWM, по крайней мере частично, путем активации пути передачи сигналов Akt / mTORC1 в клетках линии OL.