Рассеянный склероз (РС) — наиболее частое хроническое аутоиммунное заболевание центральной нервной системы. Эффективность лечения рассеянного склероза связана с риском побочных эффектов, а эффективные и хорошо переносимые препараты остаются основной неудовлетворенной потребностью. Каннабис ( Cannabis sativa., сем. Cannabaceae) и каннабиноиды популярны среди пациентов с рассеянным склерозом для лечения спастичности и боли. Каннабиноиды наделены замечательными иммуномодулирующими свойствами, и, в частности, непсихотропный каннабиноид каннабидиол (CBD) все чаще признается как противовоспалительное и иммунодепрессивное, тем не менее, с отличной переносимостью даже в высоких дозах. В этом систематическом обзоре мы извлекли и критически оценили имеющиеся данные об иммунных и модифицирующих болезнь эффектах CBD при экспериментальном аутоиммунном энцефаломиелите (EAE) и рассеянном склерозе. Доказательства в моделях EAE на грызунах убедительно подтверждают эффективность CBD, в то время как клинические данные все еще ограничены и обычно отрицательны из-за малого количества исследований и, возможно, из-за использования субоптимальных режимов дозирования./ исследования in vitro на иммунных клетках человека, и более высокие дозы следует тестировать в хорошо спланированных клинических испытаниях с клинически значимыми конечными точками эффективности.
Вступление
Рассеянный склероз (РС) — наиболее распространенное хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), от которого страдают более двух миллионов человек во всем мире. Этиология рассеянного склероза неизвестна, он в два раза чаще встречается у женщин, чем у мужчин, и обычно начинается у взрослых в возрасте 20–45 лет, развиваясь очень гетерогенным и непредсказуемым течением: неврологический дефицит обычно обратим на ранних этапах, но более длительный. время эволюционирует в прогрессирующее неврологическое ухудшение. В зависимости от клинического течения рассеянный склероз обычно подразделяется на четыре основные формы: (i) ремиттирующий рецидивирующий рассеянный склероз (RRMS), который поражает 85% пациентов с MS, (ii) вторично-прогрессирующий MS (SPMS), который может развиваться при некоторых RRMS. пациенты, (iii) первично-прогрессирующий РС (ППРС), который поражает примерно 10% пациентов с РС, и (IV) прогрессирующий рецидивирующий РС (PRMS),2019 ; Райх и др. 2018 ; Ох и др. 2018 ; Томпсон и др. 2018 ).
РС характеризуется воспалением, демиелинизацией и нейродегенерацией, которые считаются результатом попадания аутореактивных миелин-специфичных Т-лимфоцитов в ЦНС. Т-клетки подвергаются реактивации в ЦНС местными антигенпрезентирующими клетками, что в конечном итоге запускает воспалительный каскад, включающий высвобождение провоспалительных цитокинов, таких как фактор некроза опухоли (TNF) -α и интерферон (IFN) -γ, привлечение дополнительных воспалительных клеток (Т-лимфоцитов). , моноциты, в — клетки), постоянные активации макрофагов приводит к смерти олигодендроцитов и далее демиелинизации (Yamout и Alroughani 2018 года ; Хеммер и др. 2002 ).
РС пока не имеет известного лечения, тем не менее, несколько иммуномодулирующих и иммуносупрессивных методов лечения оказались полезными для замедления прогрессирования заболевания и снижения частоты рецидивов, включая IFN-β, глатирамера ацетат, диметилфумарат, митоксантрон, ингибитор топоизомеразы типа II, ингибитор синтеза пиримидина терифлуномид. , аналог пурина кладрибин, агонисты рецепторов сфингозин-1-фосфата (S1P) финголимод, сипонимод и озанимод, а также несколько моноклональных антител, таких как натализумаб, алемтузумаб, окрелизумаб. Клинический коэффициент эффективности и риск-польза от всех этих процедур, однако , все еще далек от оптимального, и более эффективных препаратов имеют более высокий риск серьезных побочных реакций (Gholamzad и др. 2019 ; Thompson и др. , 2018 ).
Кроме болезни изменения процедуры ориентации патогенетические механизмы, управление MS включает в себя широкий спектр фармакологических и нефармакологических подходов , направленных на сведение к минимуму воздействие болезни при максимизации качества жизни (Gholamzad и др. 2019 ; Thompson и др. , 2018 ). Среди фармакологических препаратов для симптоматического лечения РС все чаще используются каннабис ( Cannabis sativa L., сем. Cannabaceae) и его производные, такие как Δ 9 -тетрагидроканнабинол (Δ 9- THC) и непсихотропный каннабиноидный каннабидиол (CBD). признано эффективным для лечения спастичности и боли (Yadav et al., 2014 ). В 2010 году набиксимолы — экстракт каннабиса, содержащий Δ 9-THC и CBD в соотношении 1: 1 — был лицензирован в Великобритании для лечения спастичности, вызванной рассеянным склерозом, и в настоящее время продается под торговой маркой Sativex® более чем в 25 странах за пределами США ( https: // www. .gwpharm.co.uk / профессионалы здравоохранения / sativex ). Каннабис и каннабиноиды широко распространены и хорошо приняты пациентами с рассеянным склерозом. Эпидемиологические исследования показывают, что пациенты с РС все чаще используют препараты каннабиса для лечения ряда симптомов, включая нарушения сна, боль, беспокойство, спастичность и даже депрессию. Согласно опросам, о текущем употреблении каннабиса сообщают 20–60% людей с РС, а 50–90% выступают за легализацию, рассмотрели бы вопрос об использовании, если бы это было законно, и попросили бы больше научных доказательств (Schabas et al. 2019 ; Брентон и др. 2018; Loraschi et al. 2016 ; Banwell et al. 2016 ).
Несколько линий доказательств указывают на то, что каннабиноиды обладают иммуномодулирующими и иммунодепрессивными свойствами, что позволяет предположить, что эти препараты могут быть потенциальными терапевтическими средствами при хронических воспалительных заболеваниях (Klein 2005 ), а каннабиноидные рецепторы недавно были предложены в качестве терапевтических мишеней для аутоиммунных заболеваний, включая РС (Gonçalves and Dutra 2019 ). Использование каннабиса в клинической практике исторически затруднялось из-за вызывающего привыкание потенциала Δ 9- THC, а также из-за его психоактивных эффектов, таких как когнитивные нарушения, психоз, дисфория и тревога. CBD, однако, лишен какой-либо ответственности за злоупотребление наркотиками (Babalonis et al., 2017 ) и хорошо переносится людьми до 6000 мг / день перорально (Taylor et al. 2018; Iffland and Grotenhermen 2017 ; Bergamaschi et al. 2011 ). CBD недавно получил пищевых продуктов и медикаментов (FDA) и утверждение Европейское агентство по лекарственным (EMA) для припадков , связанных с синдромом Леннокса-Гасто или синдром Dravet ( https://www.epidiolex.com/ , Чен и др. 2019 ). CBD обладает выраженным противовоспалительным и даже иммунодепрессивным действием (Nichols and Kaplan 2020 ; Zurier and Burstein 2016 ; Burstein 2015 ), и существуют доказательства того, что он может быть полезен при хронических воспалительных состояниях, таких как воспалительное заболевание кишечника (Esposito et al. 2013 ) , ревматоидный артрит (Lowin et al., 2019), нейродегенеративных расстройствах (Cassano et al.2020 ) и даже при остром воспалении из-за инфекции SARS-CoV-2 (Costiniuk and Jenabian 2020 ). Несмотря на широкое использование CBD для симптоматического лечения РС, возможная значимость его иммуномодулирующих свойств и его потенциал в качестве лекарственного средства, изменяющего течение болезни, у пациентов с РС до сих пор мало рассматривались.
В настоящем обзоре после подробного описания сложной фармакологии CBD, которая включает в себя несколько молекулярных мишеней, помимо каннабиноидных рецепторов, представлены и обсуждены доступные доклинические и клинические данные об иммунных эффектах CBD при РС, чтобы обеспечить краткое изложение имеющихся знаний. и определить план для всесторонней оценки иммуномодулирующего потенциала CBD у пациентов с рассеянным склерозом.
Фармакология CBD
Фармакодинамика
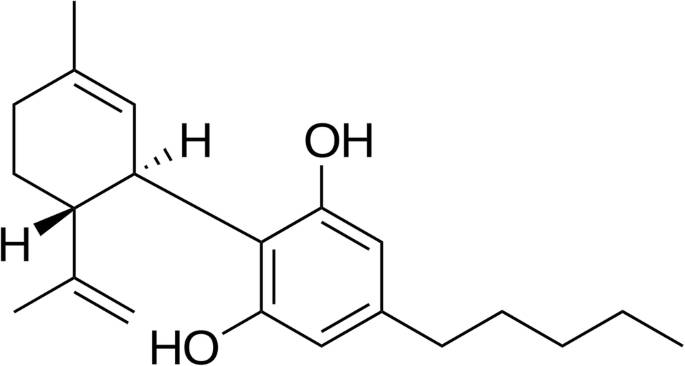
CBD — это природный каннабиноид, выделенный в 1940 году из растений каннабиса (Mechoulam et al. 1970 ) (рис. 1 ). Это главное , не психоактивным каннабиноидов и происходит естественным образом в значительных количествах в листьях растений и цветов, что составляет до 40% экстрактов завода , полученных из недавно разработанных сортов бедных в Д 9 ТНС (Andre и др. 2016 ).
CBD имеет довольно сложную фармакологию рецепторов (Таблица 1 ). CBD действительно является слабым активатором каннабиноидных рецепторов типа 1 (CB1) и типа 2 (CB2). Фактически, CBD может также действовать как отрицательный аллостерический модулятор рецептора CB1 и как обратный агонист рецептора CB2 (Pertwee 2008 ). CBD, однако, также действует на несколько каналов транзиентного рецепторного потенциала (TRP) млекопитающих, включая TRPV («V» для ваниллоида), TRPA («A» для анкирина) и TRPM («M» для меластатина) (Muller et al., 2019 ) . CBD действует как агонист TRPV1, что приводит к обезболиванию, подобному капсаицину (Iannotti et al. 2014 ). CBD также может связывать и активировать TRPV2, TRPV3 и TRPA1, будучи антагонистом TRPM8 (Muller et al., 2019). CBD является агонистом рецептора, активируемого пролифератором пероксисом (PPAR) γ, который является индуцируемым лигандом фактором транскрипции, принадлежащим к суперсемейству ядерных рецепторов (O’Sullivan et al. 2009 ). CBD также связывает некоторые орфанные рецепторы, связанные с G-белком (GPR). В частности, было сообщено , чтобы действовать в качестве антагониста в GPR55, и в качестве обратного агониста на GPR3, GPR6 и GPR12 (Аталай и др. 2019 ). Наконец, CBD может быть агонистом серотониновых (5-гидрокситриптамин, 5-HT) рецепторов 1a (Russo et al. 2005 ) и аденозиновых рецепторов A 2A (Ribeiro et al. 2012 ) и, возможно, аллостерическим модулятором на μ и δ-опиоидные рецепторы (Kathmann et al. 2006 ).Таблица 1 Фармакология CBD
Примечательно, что помимо прямого воздействия на несколько рецепторов-мишеней CBD обладает выраженными прямыми и косвенными антиоксидантными эффектами (Atalay et al.2019 ), а также способностью блокировать фермент амидгидролазу жирных кислот, что приводит к ингибированию деградации и, следовательно, к повышению уровня анандамид. нейромедиатор жирных кислот, действующий как агонист на CB1 и CB2, а также на несколько других рецепторов-мишеней, включая, среди прочего, TRPV1, TRPM8 и GPR55 (Lim et al., 2017 ).
Фармакокинетика.
Фармакокинетика CBD (PK) недавно была систематически рассмотрена Millar et al. ( 2018 ), которые извлекли, обобщили и обсудили все статьи, содержащие данные PK о CBD у людей. Авторы приходят к выводу, что, несмотря на широкое клиническое использование CBD, информация о его PK ограничена и непоследовательна, и подчеркивают необходимость тщательных исследований, направленных на лучшее понимание ключевых параметров PK, таких как биодоступность и период полувыведения.
Фармакогенетика
CBD действует на многие молекулярные мишени (таблица 1 ), большинство из которых имеют доказательства генетической изменчивости, связанной с некоторыми функциональными последствиями. Например, CB1 и CB2 были тщательно изучены на предмет зависимости от каннабиса (Hryhorowicz et al. 2018 ), мутации в каналах TRPV известны из генетических исследований боли и могут модулировать эффекты экспериментальных анальгетиков, нацеленных на TRPV1 или TRPV3 (Lötsch and Geisslinger 2011 ), Генетические варианты PPARγ являются многообещающей мишенью для точной медицины при сахарном диабете 2 типа (Khatami et al., 2019). На данный момент не существует исследований, посвященных роли таких генетических вариантов в эффектах CBD, тем не менее, в настоящее время продолжаются фармакогеномные клинические испытания каннабиноидов, такие как исследования влияния гена катехол-O-метилтрансферазы (COMT) на эффекты CBD (NCT02116010 nd ; NCT02492074 nd ).
По сравнению с отсутствием фармакогенетических исследований мишеней CBD, существует больше доказательств в отношении PK CBD. На абсорбцию и распределение CBD влияет P-гликопротеин (P-gp), белок оттока, кодируемый геном ABCB1 , также известный как ген множественной лекарственной устойчивости (MDR1), расположенный в хромосоме7q21 и состоящий из 28 экзонов (Hoffmeyer et al. 2000 ). Известно, что SNP в гене ABCB1 , такие как rs2032582 (c.2677G T> A), rs1045642 (c.3435C> T) и rs1128503 (c.1236 C> T), изменяют экспрессию и активность P-gp и, в свою очередь, PK многих лекарств. Однако информация об их потенциальном значении для ПК CBD отсутствует (Rui-Jian et al.2017). CBD метаболизируется ферментами суперсемейства цитохрома P450 (CYP450) и, в частности, CYP3A4 и CYP2C9 (Stout et al., 2014), которые кодируются генами CYP2C9 и CYP3A4 . На сегодняшний день описано 60 полиморфных аллелей гена CYP2C9, наиболее частыми из которых являются CYP2C9 * 2 (c 430 C> T) и CYP2C9 * 3 (c 1075 A> C), которые приводят к снижению активности фермента и плохому фенотип метаболизатора (Jarrar, Lee, 2014 ). В случае гена CYP3A4 известно 26 полиморфных аллелей, из которых наиболее распространены CYP3A4 * 2, CYP3A4 * 11, CYP3A4 * 12, CYP3A4 * 17, что приводит к снижению активности фермента (Werk and Cascorbi 2014). К сожалению, до сих пор нет информации о влиянии этих SNP на ПК CBD у людей. Семейство ферментов UDP-глюкуронозилтрансфераз (UGT) также участвует в биотрансформации CBD (Stout and Cimino, 2014 ), в частности UGT1A9, UGT2B7 и UGT2B17. Важные SNP в гене UGT1A9 , такие как UGT1A9 * 3, * 4 и UGT1A9 * 5, приводят к снижению или подавлению ферментативной активности (Olson et al. 2009 ). Однако глюкуронизация CBD играет второстепенную роль в общей элиминации препарата (Mazur et al. 2009 ), поэтому генетические варианты ферментов UGT вряд ли в значительной степени повлияют на PK CBD.
Цель
В настоящем обзоре мы систематически извлекали и критически оценивали имеющиеся данные об иммунных эффектах и модифицирующей заболевание активности CBD при РС и экспериментальном аутоиммунном энцефаломиелите (EAE), его доклинической модели на животных, чтобы обеспечить текущее состояние. Краткое изложение иммуномодулирующего потенциала CBD при рассеянном склерозе.
Стратегия поиска
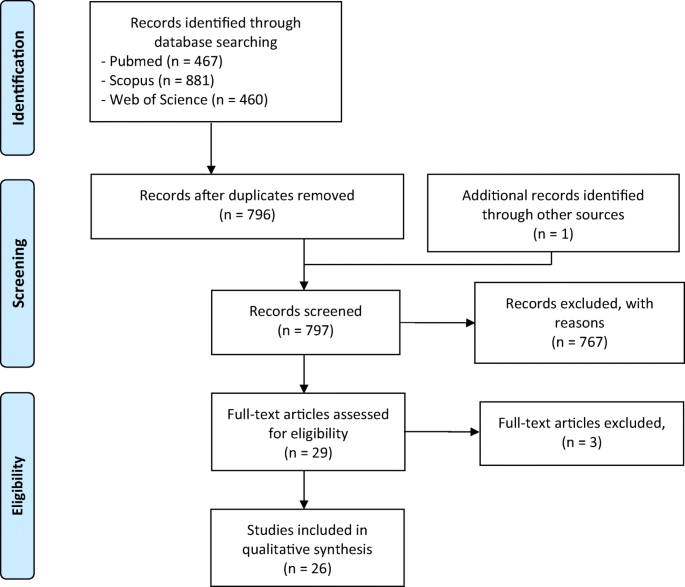
Этот систематический обзор был проведен в соответствии с заявлением PRISMA (Moher et al. 2009 ). Алгоритм поиска был получен путем объединения терминов, относящихся к «каннабидиолу», с терминами, относящимися к «рассеянному склерозу» или «экспериментальному аллергическому энцефаломиелиту», как показано в таблице 2 , после чего поиск выполнялся в базах данных PubMed, Scopus и Web of Science (рис. 2).). Ссылки, выявленные в ходе этого процесса, впоследствии были просканированы на предмет критериев отбора. Критерии включения включали исследования периферических и центральных иммунных эффектов CBD в чистом виде или в виде экстрактов растений, отдельно или вместе с другими лекарствами. Исключенные темы включали обзорные статьи, дубликаты и исследования синтетических аналогов или метаболитов CBD. После этого списки литературы включенных статей были проверены на предмет дополнительных отчетов. Не применялись ограничения ни по языку, ни по году, и были включены все отчеты, выпущенные за период до 29 июля 2020 года.Таблица 2 Алгоритм поиска для проверки базы данных
Полученные результаты
Наш литературный поиск привел в общей сложности к 1808 отчетам. После проверки соответствующих названий и аннотаций 29 статей были оценены на предмет соответствия полному тексту, и 26 исследований были окончательно включены в обзор (рис. 2 ). Все проверенные записи перечислены в качестве дополнительных материалов (Дополнительная таблица 1).
Доклинические исследования
Мы обнаружили в общей сложности 20 исследований CBD in vivo и ex vivo / in vitro на доклинических моделях MS (таблица 3 ). Большинство исследований на животных было выполнено на (MOG 35–55 ) -индуцированном EAE на мышах C57BL / 6J. Отдельные исследования , однако были также выполнены в EAE у мышей , индуцированные с помощью MSCH (Buccellato и др. 2011 ;. Duchi и др 2013 ), PLP 139-151 (Gallily и Yekhtin 2019 ), TMEV (. Мех и др 2013 ), и купризон (Саджадян и др., 2017 ). В одном исследовании использовались мыши C57BL / 6 J с адоптивно перенесенным EAE (González-García et al., 2017), а еще один был проведен на крысах Lewis с EAE, индуцированным белком gp (69–88) (Zhou et al. 2019 ).Таблица 3 Эффект CBD в доклинических моделях MS
КБД вводили внутрибрюшинно в 12 из 15 исследований, чаще всего в дозе 5 мг / кг / день (6 исследований), но также и до 20 мг / кг / день (Elliott et al.2018 ) с сильно варьирующимся режимом. введение начинается сразу же и даже через 32–68 дней после индукции EAE (Buccellato et al. 2011 ) и продолжается от 3 до 60 дней (Gallily and Yekhtin 2019 ). В некоторых исследованиях, КБР был дан перорально через зонд (Nichols и др. 2020 ;. Zhou и др 2019 ), подкожно или интраназально (Дучи и др. 2013 ), или даже в качестве крема 1% наносят на нижние конечности (Giacoppo и соавт. 2015 г.). В большинстве случаев CBD вводили в виде чистого вещества (12 исследований), однако в некоторых случаях его вводили в виде экстракта каннабиса вместе с Δ9-THC в различных пропорциях (Al-Ghezi et al.2019a , b ; Moreno-Martet et al. . 2015 ; Buccellato и др. 2011 ; Gallily и Yekhtin 2019 ; Zhou и др. , 2019 ).
Несмотря на такую неоднородность, лечение CBD было неизменно эффективным, обычно приводя к снижению тяжести EAE, включая отсроченное появление симптомов, ослабление клинических признаков и снижение прогрессирования заболевания. Во многих исследованиях сообщалось также об улучшении гистологии ЦНС, снижении нейровоспаления, активации микроглии и инфильтрации периферических моноцитов и лимфоцитов, а также снижении демиелинизации.
Экспериментальные данные о биологических механизмах, способствующих положительному влиянию CBD на EAE, неизменно указывают на снижение провоспалительных цитокинов, таких как IL-17A, IFN-γ, TNF-α, IL-6 и IL-1b, а также на увеличение противовоспалительных свойств. цитокины , такие как IL-4, IL-10 и TGF-бета (Nichols и др. 2020 ;. Аль-Ghezi и др 2019a , б ; Elliott и др. 2018 ; Giacoppo и др. , 2017 ; Giacoppo и др. 2015 ; Рахими и др. , 2015 ; Дучи и др. 2013 ; Zhou и др. , 2019 ), а также к индукции иммуносупрессивной MDSC (Al-Ghezi и др. 2019a ; Эллиот и др . 2018). Очень немногие исследования касались вопроса о рецепторах-мишенях, участвующих в эффектах CBD (Морено-Мартет и др., 2015 ; Аль-Гези и др., 2019b ).
Одно исследование (Gallily and Yekhtin, 2019 ) сравнивало CBD с глатирамером против РС, показав, что они в той же степени эффективны в снижении EAE.
Доклиническое исследование CBD при EAE также включало семь исследований, выполненных на моделях ex vivo / in vitro энцефалитогенных лимфоцитов (таблица 3 ), все они были основаны на Т-клетках из лимфатических узлов или селезенки мышей с (MOG 35–55 ) -индуцированным EAE, за исключением для одного, который использовал астроциты от мышей TMEV-IDD SJL / J (Mecha et al. 2013). CBD всегда использовался в концентрациях от 0,1 до 10 мкМ, что обычно приводило к снижению пролиферации и усилению апоптоза клеток, а также к ингибированию провоспалительных и активации противовоспалительных путей. Лишь в нескольких исследованиях изучались молекулярные мишени, опосредующие эффекты CBD. Kozela et al. исключен вклад либо CB1, CB2, 5-HT1A, TRPV1 или PPAR & gamma в CBD-зависимого уменьшения секреции ИЛ-17 от Т — клеток (Kozela и др. 2013 ), или CB1 или CB2 в CBD-зависимое ингибирование Т — клеток пролиферации (Kozela и др. 2011 ). Об участии рецепторов GPR55, CB1 или CB2 не сообщалось также González-García et al. ( 2017 ), которые изучали индуцированное CBD ингибирование MOG 35–55/ IL-12-индуцированная секреция IL-6 и усиление апоптоза в энцефалитогенных клетках селезенки мыши, в то время как Mecha et al. ( 2013 ) предположили, что рецепторы A2A способствуют снижению секреции CCL2 из астроцитов мышей, вызванного CBD.
Клинические исследования
Наш поиск предоставил в общей сложности шесть исследований, проведенных на пациентах с РС и / или на иммунных клетках, полученных от пациентов (таблица 4 ). Из них четыре исследования изучали периферический иммунный профиль пациентов, получавших различные препараты каннабиноидов, в одном использовался CBD in ex vivo. культуры PBMC от пациентов, и один сделал и то, и другое.Таблица 4 Исследования у пациентов с РС
Из пяти исследований с участием пациентов три были выполнены в небольших группах субъектов, получавших набиксимол (конкретный экстракт каннабиса, одобренный в 2010 году в качестве ботанического препарата под торговым названием Sativex для лечения спастичности и боли при РС, который вводится спрей для рта, содержащий 2,7 мг Δ9-THC и 2,5 мг CBD на затяжку). Все три исследования были наблюдательными, набиксимолы назначались в соответствии с утвержденными показаниями в течение 4–6 недель (Соросина и др., 2018 ; Санторо и др., 2017 ; Чентонзе и др., 2009 ). Таким образом, они включали пациентов с различными типами РС (например, RRMS, PPMS, SPMS в исследовании Соросиной и др. ( 2018).)), либо без лечения, и с обработкой IFN-β (например, в исследовании Santoro et al. ( 2017 )). Ни в одном из этих исследований не сообщалось о каком-либо значительном влиянии на периферический иммунитет, в частности Centonze et al. ( 2009 ) включили подробные результаты по иммунному профилю 20 отобранных пациентов, не показывающие изменения частоты клеток CD3 +, CD14 +, CD19 +, CD56 +, CD4 + или CD8 + в периферической крови, а также отсутствие изменений экспрессии CB1 или CB2 на те самые клетки. Интересно, что Centonze et al. ( 2009 ) также сообщили об отсутствии эффективности набиксимолов в отношении боли или спастичности в их когорте пациентов. В связи с этим Соросина с соавт. ( 2018 г.) в своем исследовании провели анализ пациентов с рассеянным склерозом со спастичностью, реагирующих на набиксимолы, сообщая о повышении регуляции в цельной крови генов, принадлежащих к пути рибосом, и о понижении регуляции генов, связанных с иммунной системой, подвижностью / миграцией клеток и нервной системой.
Остальные два исследования, напротив, представляют собой клинические испытания, направленные на оценку влияния каннабиноидов на симптомы рассеянного склероза. Ни в одном из исследований не использовался чистый CBD в качестве тестируемого препарата, тем не менее, они были включены в анализ, поскольку оба использовали препараты, содержащие значительные количества CBD, и предоставили данные о периферических иммунных функциях пациентов. Первое (Killestein et al. 2003 ) представляет собой перекрестное исследование с участием 16 пациентов с рассеянным склерозом (10 с SPMS и 6 с PPMS), получающих следующие лечения каждое в течение 4 недель подряд, разделенных 4-недельным вымыванием: дронабинол, C. sativaстандартизированный экстракт цельного растения (содержащий 2,5 мг THC и 20–30% CBD) и плацебо. Все виды лечения не влияли ни на частоту циркуляции Т- и В-клеток, моноцитов и NK-клеток, ни на уровни TNF-α, IL-12p40, IL-12p70 и IL-10 в плазме, ни на пролиферацию Т-клеток ex vivo. . Примечательно, что лечение экстрактом цельного растения C. sativa привело к увеличению продукции TNF-α в цельной крови, стимулированной LPS ex vivo, и у 7 пациентов с рассеянным склерозом с дронабинолом и / или экстрактом цельного растения C. sativa оценка побочных эффектов выше медианы. также наблюдалось повышение уровня IL-12p40 в плазме (Killestein et al. 2003 ).
Во втором (Katona et al. 2005 ) приводятся данные, полученные из исследования Cannabinoids in MS (CAMS), большого рандомизированного контролируемого исследования для оценки терапевтической эффективности каннабиноидов (Zajicek et al. 2005 ). В первоначальном исследовании 630 пациентов со стабильным РС с мышечной спастичностью из 33 центров Великобритании были рандомизированы для приема перорально Δ9-THC, экстракта цельного растения, стандартизированного для Δ9-THC: CBD 2: 1 (0,25: 0,125 мг, Cannador). , или плацебо. Результаты всего исследования показали небольшое влияние лечения на мышечную спастичность (Zajicek et al. 2005 ). Katona et al. ( 2005 г.) сообщают данные 100 из этих пациентов (74 SPMS и 26 PPMS), которые не показывают влияния на сывороточные уровни IFN-γ, IL-10, IL-12 или CRP, или на частоту циркулирующих IFN-γ-экспрессирующих CD3 + Т-клеток. .
Исследования ex vivo / in vitro включают отчет, показывающий, что набиксимолы дозозависимо снижают высвобождение TNF-α, IL-6 и IL-10 в культивируемых PBMC как у здоровых субъектов, так и у пациентов с РС, без лечения эфиром и леченных набиксимолами от боли и спастичности. (Соросина и др., 2018 ), а также исследование, показывающее, что CBD в диапазоне концентраций мкМ подавляет пролиферацию, снижает TNF-α-, IFN-γ- и IL-17A-экспрессирующие CD3 + Т-клетки, а также IL-2. — и CD3 + Т-клетки, экспрессирующие GM-CSF, более эффективно в клетках пациентов с РС, чем здоровых субъектов (Zgair et al. 2017 ). В обоих исследованиях только CBD (Zgair et al., 2017 ) или вместе с Δ9-THC (Sorosina et al. 2018)), был активен в диапазоне концентраций мкМ.
Обсуждение
Несколько линий доказательств убедительно подтверждают общие иммуномодулирующие свойства CBD, который является признанным противовоспалительным агентом, наделенным даже некоторыми иммуносупрессивными свойствами (обзор в Nichols and Kaplan ( 2020 ) и в Peyravian et al. ( 2020 )). В соответствии с такими благоприятными предпосылками наш систематический обзор извлек в общей сложности 20 in vivo и ex vivo /Исследования in vitro CBD на доклинических моделях MS, все на грызунах, включая несколько различных моделей EAE на животных, неизменно указывают на то, что CBD эффективен для снижения клинической и гистологической тяжести EAE у животных, а также для ингибирования соответствующей энцефалитогенной клеточной активности в моделях in vitro. Напротив, в клинических условиях можно было провести всего несколько исследований, в подавляющем большинстве из которых не сообщалось об эффектах на иммунные профили или функции. Такое серьезное расхождение между доклиническими и клиническими исследованиями требует тщательного рассмотрения, чтобы определить возможные объяснения.
Большинство исследований на животных проводилось на мышах C57BL / 6 J, иммунизированных MOG 35–55 , хронической животной моделью рассеянного склероза, которая напоминает первичный и вторично прогрессирующий рассеянный склероз и в которой в основном задействованы CD8 +, CD4 +, Th17 и регуляторные Т-клетки, B. клетки, а также моноциты и макрофаги (Прокаччини и др. 2015 ;. Kipp и др 2017 ). Однако CBD был также эффективен у мышей SJL / J, иммунизированных PLP 139–151., который лучше воспроизводит рецидивирующий ремиттирующий РС, а также у мышей SJL / J с TMEV-индуцированным демиелинизирующим заболеванием и у мышей C57Bl / 6 с индуцированной купризоном демиелинизацией, которая включает олигодендроциты, астроциты и микроглию, и позволяет изучать аксональные повреждение и воспалительных индуцированных демиелинизации и ремиелинизацию процессов (Прокаччини и др. 2015 ; Kipp и др. , 2017 ). Таким образом, эффективность CBD была документально подтверждена на наиболее актуальных моделях РС на животных, которые являются репрезентативными для различных клинических типов заболевания, включают как периферические, так и центральные иммунные механизмы и хорошо зарекомендовали себя для доклинических испытаний терапевтических агентов.
По сравнению с исследованиями in vivo на животных, исследований ex vivo / in vitro с CBD немного, и большинство из них проводится на энцефалитогенных Т-лимфоцитах из лимфатических узлов или селезенки мышей с (MOG 35–55 ) -индуцированным EAE. и только одно исследование тестировало CBD на астроцитах мышей SJL / J, вызванных TMEV, с демиелинизирующим заболеванием (Mecha et al. 2013). Поэтому до сих пор нет информации о возможных прямых эффектах CBD на другие периферические иммунные клетки, участвующие в MS, такие как CD8 + T-клетки, B-клетки, моноциты и макрофаги, а также на другие резидентные иммунные клетки ЦНС, такие как олигодендроциты или микроглию. Более того, до сих пор не было исследований, в которых КБД тестировался на дифференциацию и функцию клонов CD4 + Т-клеток, таких как приводящие к аутоиммунным заболеваниям при РС, такие как Th1 и Th17, или играющие защитные роли, такие как Th2 и Treg, несмотря на предварительные доказательства того, что CBD может подавлять регуляцию. молекулярные пути, ведущие к Th17 (Kozela et al. 2016a ).
Несмотря на последовательные доклинические данные, исследования у пациентов с РС немногочисленны и имеют серьезные ограничения, которые включают, помимо ограниченных размеров выборки и схем наблюдения в большинстве из них, отсутствие клинически значимых конечных точек, короткую продолжительность лечения и дозы, которые, вероятно, недостаточны для воздействия на цели. и механизмы, вовлеченные в патогенез и прогрессирование рассеянного склероза. На этом фоне совсем не удивительно, что результаты, полученные у больных РС, обычно были отрицательными. Действительно, все пять исследований с участием пациентов с РС оценивали лишь несколько параметров, связанных с периферическим иммунным профилем и функцией, и ни одно из них не включало конечных точек, связанных с активностью заболевания и / или прогрессированием инвалидности. Хотя можно утверждать, что никаких клинически значимых эффектов не последовало бы без основных модификаций иммунных функций,2017 ; Соросина и др. 2018 ). В этом отношении подробный анализ доклинических исследований предполагает, что ключевой проблемой могут быть уровни доз CBD. В моделях на животных дозы CBD, снижающие тяжесть EAE, постоянно составляли не менее 5 мг / кг / день или выше. Хотя в исследованиях не оценивались уровни CBD в плазме и / или тканях, учитывая, что лечение обычно назначали внутрибрюшинно, очень приблизительная оценка тканевых (пиковых) концентраций может находиться в диапазоне 10–15 мкМ. Такая оценка согласуется с результатами экспериментов in vitro, где обычно использовалось 0,1–10 мкМ CBD. Примечательно, что при этих концентрациях CBD эффективен в отношении энцефалитогенных клеток грызунов (Kozela et al. 2011 , 2013 , 2015 , 2016a; Mecha et al. 2013 ; Гонсалес-Гарсия и др. 2017 ; Ян и др. 2019 ), а также на Т-лимфоцитах здоровых субъектов и пациентов с РС (Згаир и др., 2017 ; Соросина и др., 2018 ).
В клинических исследованиях, напротив, дозы CBD были постоянно ниже. В исследованиях, в которых использовались набиксимолы, Centonze et al. Применяли максимум 40 затяжек в день. ( 2009 ), а Соросина и др. ( 2018 ) и Санторо и др. ( 2017 ) использовали более низкие суточные дозы. Набиксимол содержит 2,5 мг CBD на затяжку, что составляет 100 мг / день (или около 1,4 мг / кг / день для человека с весом 70 кг). Katona et al. ( 2005 ) вводили экстракт натурального масла каннабиса с максимальной пероральной дозой Δ9-THC 0,25 мг / кг / день. Масляный экстракт содержит Δ9-THC: CBD 2: 1, таким образом, предполагается, что максимальная пероральная доза CBD составляла 0,125 мг / кг / день (или около 8,75 мг / день для субъекта весом 70 кг). Наконец, Killestein et al. ( 2003 ) использовали C. sativaэкстракт цельного растения стандартизирован до Δ9-THC 2,5 мг / капсула, с 20-30% CBD, и вводится по две капсулы два раза в день, что составляет в общей сложности 10 мг / день Δ9-THC и предполагаемую 2–3 мг / сут. день CBD. Доступные фармакокинетические исследования на людях (обзор Millar et al. 2018 ) показывают, что введение CBD либо в виде спрея для слизистой оболочки рта в дозах от 5 до 20 мг (но, по крайней мере, в одном исследовании, также до 60-90 мг), либо перорально. капсулы, содержащие 10 мг CBD, постоянно обеспечивают пиковую концентрацию в плазме в диапазоне 1–4 нг / мл, что соответствует примерно 0,01 мкМ, что значительно ниже теоретических концентраций, достигнутых в исследованиях на животных, а также, что наиболее важно, гораздо ниже концентраций, которые эффективен в моделях in vitro, основанных на клетках животных или человека.
Исходя из этого, предлагается, чтобы для того, чтобы CBD был эффективен для людей в качестве иммуномодулирующего препарата, следует рассмотреть возможность применения более высоких доз. Действительно, также с общей точки зрения, какие дозы CBD более эффективны при различных болезненных состояниях, остается предметом дискуссий, тем не менее, недавний обзор, в котором изучается, какие дозы применялись в клинических популяциях в различных медицинских контекстах, показал, что CBD хорошо себя чувствует. переносится при пероральных дозах до 50 мг / кг / день (Millar et al., 2019), что соответствует общему количеству 3,5 г / день для человека весом 70 кг. Недавно FDA и EMA одобрили CBD (как Epidiolex®, GW Pharmaceuticals) для лечения редких форм эпилепсии у детей с максимальными дозами 10 мг / кг два раза в день. Примечательно, что недавнее исследование детей и взрослых с резистентной к лечению эпилепсией показало, что Epidiolex® можно безопасно увеличить до максимальной дозировки 50 мг / кг / день в зависимости от переносимости и контроля припадков, с положительной линейной корреляцией между дозировкой CBD ( диапазон от 5 до 50 мг / кг / день) и уровень (диапазон от 7,1 до 1200 нг / мл) (Szaflarski et al.2019 ). Концентрация 1200 нг / мл соответствует примерно 3,8 мкМ, что довольно близко к CBD примерно 8 мкМ, которое было показано Zgair et al. ( 2017 г.) для подавления пролиферации и продукции провоспалительных цитокинов в CD3 + Т-клетках пациентов с РС. В исследовании Szaflarski et al. ( 2019 ), таким образом, следует рассматривать как доказательство концепции о том, что концентрации CBD, которые in vitro оказывают иммуномодулирующее действие, относящееся к РС, могут быть безопасно достигнуты у людей при условии использования соответствующих доз. Изучение периферического иммунного профиля и функции у людей с эпилепсией, получающих Epidiolex®, и, в частности, у тех, кто находится на режимах высоких доз, также может предоставить полезную информацию для правильного планирования клинических исследований CBD как иммуномодулятора у пациентов с РС с точки зрения режимов дозирования, таких как а также соответствующих конечных точек, которые необходимо измерить.
CBD имеет сложный фармакологический профиль (таблица 1 ), однако молекулярные мишени, на которые воздействует CBD, были изучены всего в нескольких исследованиях и только на моделях in vitro, основанных на клетках грызунов. Имеющиеся результаты не предполагают никакого участия либо CB1, CB2, 5-HT1A, TRPV1 или PPAR & gamma в CBD-зависимого уменьшения секреции ИЛ-17 от Т — клеток (Kozela и др. 2013 ), или из CB1 или CB2 в CBD-индуцированного ингибирования Пролиферация Т-клеток (Kozela et al. 2011 ) или CB1, CB2 или GPR55 в CBD-индуцированном ингибировании MOG 35–55 / IL-12-индуцированной секреции IL-6 и повышенном апоптозе в энцефалитогенных клетках селезенки мышей (González-García и др., 2017 ). Единственное доступное в настоящее время положительное свидетельство предполагает роль A 2A.рецепторы в CBD-индуцированном снижении секреции CCL2 из астроцитов мыши (Mecha et al. 2013 ). В этом отношении может представлять интерес тот факт, что EHP-101, новое химическое соединение, полученное из CBD, действующее как двойной агонист PPARγ и CB2, а также активатор пути фактора, индуцируемого гипоксией (HIF), оказывает анти- воспалительные эффекты in vitro в клеточных линиях мышиных RAW264.7 и BV2 и клетках первичной микроглии крысы, а также для снижения тяжести EAE у мышей C57BL / 6 J с либо (MOG 35–55 ) -индуцированным EAE, либо с индуцированной купризоном демиелинизацией, а также как и в модели TMEV-IDD SJL / J мышей (Наваррете и др. 2018 , 2020). В целом имеющиеся данные не позволяют сделать сколько-нибудь значимый вывод о молекулярных мишенях, участвующих в эффектах CBD при EAE и, возможно, при MS, за исключением тех случаев, когда очевидно, что его терапевтический потенциал не может быть объяснен только с помощью одной-единственной мишени. Между тем, имеются данные об активности синтетических производных CBD, таких как HU-446 и HU-465, которые оказывают ингибирующее действие на энцефалитогенную MOG 35–55 -специфическую Т-клеточную линию из лимфатических узлов мышей C57BL / 6 (Kozela et al. 2016b ), подчеркивают важность CBD также как молекулярного каркаса для разработки новых лекарств, нацеленных на иммунную систему.
Таким образом, доступные доклинические данные на моделях EAE на грызунах убедительно подтверждают, что CBD является эффективным иммуномодулирующим и модифицирующим заболевание лекарством, хотя его клеточные и молекулярные мишени остаются в значительной степени неисследованными. Напротив, несмотря на установленное использование CBD-содержащих препаратов при РС, данные у пациентов ограничены и обычно отрицательны, возможно, в основном из-за неадекватных терапевтических режимов, как с точки зрения дозы, так и с точки зрения продолжительности. Программа исследований, направленная на правильную оценку CBD как иммуномодулирующего препарата для РС, должна включать, прежде всего, подробную характеристику эффектов CBD на ключевые клеточные и молекулярные механизмы, участвующие в патогенезе и прогрессировании РС, включая, например: ( i) периферическая активация провоспалительных Т-клеток в результате их взаимодействия с антигенпрезентирующими клетками, такие как макрофаги; (ii) миграция активированных Т-клеток через гематоэнцефалический барьер, опосредованная молекулами адгезии, протеазами и хемокинами; (iii) реактивация Т-клеток в ЦНС посредством взаимодействия с микроглией с последующей секрецией провоспалительных цитокинов, таких как IFN-γ или IL-2, что приводит к активации макрофагов, других Т-клеток и В-клеток; (iv) вызванное воспалением повреждение олигодендроцитов, приводящее к разрушению миелиновой оболочки цитотоксическими медиаторами, такими как TNF-α и окислительными радикалами; (v) дифференцировка В-клеток в плазматические клетки, секретирование демиелинизирующих антител, в свою очередь, привлекающих макрофаги и запускающих каскад комплемента (Yamout and Alroughani (iii) реактивация Т-клеток в ЦНС посредством взаимодействия с микроглией с последующей секрецией провоспалительных цитокинов, таких как IFN-γ или IL-2, что приводит к активации макрофагов, других Т-клеток и В-клеток; (iv) вызванное воспалением повреждение олигодендроцитов, приводящее к разрушению миелиновой оболочки цитотоксическими медиаторами, такими как TNF-α и окислительными радикалами; (v) дифференцировка В-клеток в плазматические клетки, секретирование демиелинизирующих антител, в свою очередь, привлекающих макрофаги и запускающих каскад комплемента (Yamout and Alroughani (iii) реактивация Т-клеток в ЦНС посредством взаимодействия с микроглией с последующей секрецией провоспалительных цитокинов, таких как IFN-γ или IL-2, что приводит к активации макрофагов, других Т-клеток и В-клеток; (iv) вызванное воспалением повреждение олигодендроцитов, приводящее к разрушению миелиновой оболочки цитотоксическими медиаторами, такими как TNF-α и окислительными радикалами; (v) дифференцировка В-клеток в плазматические клетки, секретирование демиелинизирующих антител, в свою очередь, привлекающих макрофаги и запускающих каскад комплемента (Yamout and Alroughani приводя к разрушению миелиновой оболочки цитотоксическими медиаторами, такими как TNF-α и окислительными радикалами; (v) дифференцировка В-клеток в плазматические клетки, секретирование демиелинизирующих антител, в свою очередь, привлекающих макрофаги и запускающих каскад комплемента (Yamout and Alroughani приводя к разрушению миелиновой оболочки цитотоксическими медиаторами, такими как TNF-α и окислительными радикалами; (v) дифференцировка В-клеток в плазматические клетки, секретирование демиелинизирующих антител, в свою очередь, привлекающих макрофаги и запускающих каскад комплемента (Yamout and Alroughani2018 ; Hemmer et al. 2002 г.). Пока существуют лишь отрывочные доказательства, почти только на Т-клетках и в основном на моделях грызунов, и требуется гораздо больше работы, в первую очередь на человеческих клетках. Однако наиболее важные и неотложные потребности касаются разработки хорошо спланированных клинических испытаний, направленных на тестирование адекватных доз CBD на клинически значимых конечных точках эффективности. выше, чем те, которые использовались до сих пор, должны быть протестированы, чтобы должным образом оценить иммуномодулирующий потенциал CBD при рассеянном склерозе. Будущие исследования всегда должны включать тщательный мониторинг концентрации в плазме в зависимости от режимов дозирования для сбора ключевой информации, которая позволит справиться с присущей КБД фармакокинетической неоднородностью, что, вероятно, частично связано с фармакогенетическими факторами. Что наиболее важно, такие испытания должны включать в качестве первичных конечных точек эффективности клинически значимые показатели активности заболевания и / или прогрессирования инвалидности или, по крайней мере, доказательства активности заболевания, рецидивов и прогрессирования, оцененных с помощью магнитно-резонансной томографии, неврологические оценочные шкалы, показатели когнитивных нарушений, утомляемости. шкалы, оцененные пациентом и врачом, а также результаты, сообщенные пациентом (CHMP,2015 ). Тем не менее, даже на основе ограниченных доказательств, доступных на данный момент, CBD представляется очень многообещающим лекарством со значительным иммуномодулирующим и модифицирующим заболевание потенциалом для MS, а также дополнительными преимуществами, основанными на его хорошо установленном профиле безопасности и переносимости.