Рассеянный склероз (РС) — это хроническое аутоиммунное заболевание, которое поражает центральную нервную систему (ЦНС) и характеризуется демиелинизацией и нейродегенерацией, вызванной Th17 / Th1-иммунным ответом, который поражает главным образом молодых женщин. Хотя причины рассеянного склероза не полностью известны, общеизвестно, что заболевание характеризуется длительной очаговой деградацией миелиновой оболочки, с повреждением аксонов и нейронов. Молекулы липидов играют главную двойственную роль при рассеянном склерозе, как в качестве целевых молекул для разрушения миелина, так и в качестве медиаторов воспаления. Действительно, недавние кумулятивные данные свидетельствуют о том, что нарушения в липидсвязывающих белках миелина и сфинголипидов, которые придают повышенную иммуногенность, могут лежать в основе аутоиммунного ответа против миелиновой оболочки. В конце концов, ЦНС является вторым органом, богатым по содержанию липидов после жировой ткани. С другой стороны, растворимые факторы, называемые адипокинами, секретируемые жировой тканью, модулируют воспалительные реакции и способствуют метаболической дисфункции, которая может быть важной в патофизиологии РС. Накопление инвалидности у пациентов с РС происходит медленно, но постоянно, что часто приводит к снижению подвижности и физической активности, что приводит к большей слабости, усталости и связанному повышенному риску метаболического синдрома (МетС). В свою очередь, MetS может вызвать РС у восприимчивых людей и является плохим прогностическим фактором. Здесь мы рассмотрим, каковы факты, связывающие липиды, MetS и MS, что мы еще не знаем, и что мы должны сделать, чтобы продвинуть это поле вперед.
МИТОХОНДРИАЛЬНАЯ ФУНКЦИЯ ДЕЙСТВИЙ И НЕЙРОДЕГЕНЕРАЦИИ
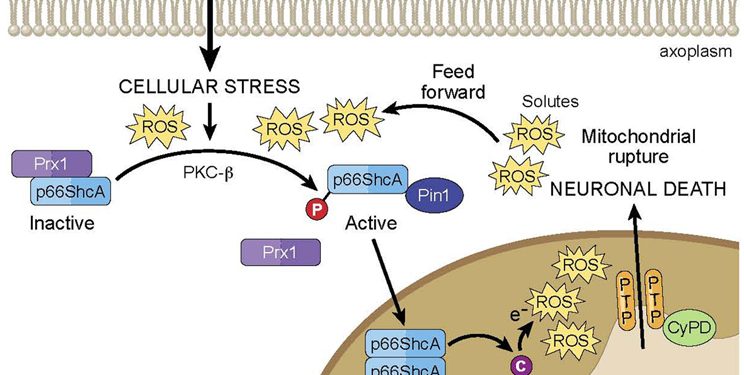
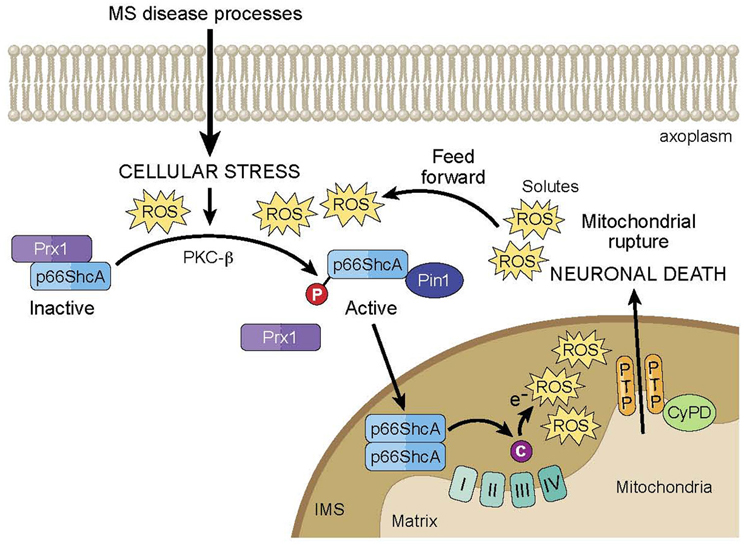
Один из механизмов, предположенных для объяснения диффузной нейродегенерации, обнаруженной у пациентов с РС, включает митохондриальную дисфункцию. Митохондрии являются важными внутриклеточными органеллами, участвующими в синтезе АТФ и регуляции кальция, а также являются основными источниками активных форм кислорода (АФК). Следовательно, диффузная митохондриальная дисфункция, вторичная к процессам заболевания MS, может привести к неадекватному производству энергии и внутриклеточной дисрегуляции. Эта дисфункция особенно вредна для нейронов, учитывая их уникальную удлиненную морфологию и зависимость от АТФ для распространения электрических сигналов, поддержания ионных градиентов и облегчения антероградной и ретроградной транспортировки вдоль аксонов. Накапливается in vitro и in vivo доказательство митохондриальной дисфункции при РС. Например, NAA, обычно используемый MRS-маркер нейрональной целостности, продуцируется нейрональными митохондриями. Следовательно, изменения в уровнях NAA также могут отражать митохондриальную дисфункцию в нейронах (Fu et al., 1998; Signoretti et al., 2001; Benarroch, 2008). Как упоминалось ранее, изменения в уровнях NAA соответствуют рецидивам и, как было показано, резко падают при острых воспалительных поражениях и частично обращаются, как спадает воспаление (Fu et al., 1998; Khan et al., 2005). Начальное резкое снижение NAA, несомненно, отражает обратимую митохондриальную дисфункцию в нейронах в пределах этих острых повреждений. Подобное уменьшение NAA при хронических очаговых поражениях белого вещества и NAWM также может свидетельствовать о хронической митохондриальной дисфункции в нейронах, а также о потере нейронов (Bjartmar et al., 2000). Кроме того, доказательства, связывающие митохондриальную дисфункцию с нейродегенерацией, были продемонстрированы посмертным анализом больного мозга, включая пораженные участки, NAWM и нелезионную кору головного мозга. Структурно, электронная микроскопия демиелинизированных поражений спинного мозга показывает резко уменьшенное количество митохондрий и микротрубочек (Dutta et al., 2006). Дальнейший анализ указывает на окислительное повреждение митохондриальной ДНК и нарушение активности митохондриальных ферментных комплексов в пораженной ткани. Су и соавт. Митохондриальный переход проницаемости при нейродегенерации
(Lu et al., 2000) и снижение экспрессии митохондриальных генов, специфичных для нейронов в нелезионной ткани (Dutta et al., 2006). Наконец, имеются убедительные доказательства митохондриальной дисфункции при визуализации in vivo двухтрансгенных мышей с меченными CFP митохондриями и YFPlabeledaxoplasm (Thy1-MitoCFP × Thy1-YFP16), индуцированными экспериментальным аутоиммунным энцефаломиелитом (EAE), acommonlyusedanimal модель для РС (MS) al., 2011). При мониторинге единичных аксонов у животных, вызванных EAE, аномальная морфология митохондрий была отмечена как самый ранний ультраструктурный признак повреждения, предшествующий структурным изменениям. Последующий анализ активных поражений в биопсиях пациентов с РС показал сходное повреждение митохондрий как в структурно интактных, так и в демиелинизирующих аксонах. В целом, эти многогранные исследования предоставляют убедительные доказательства того, что функция митохондрий может играть важную роль в нейродегенеративных механизмах РС.