1. Введение
Эти наборы рекомендуются для изучения экспериментального аутоиммунного энцефаломиелита (EAE), включая тестирование эффективности потенциальных терапевтических средств.
Каждый набор достаточен для индукции EAE у 10 мышей и состоит из:
- Антиген (MOG 35-55 или MOG 1-125 ) в эмульсии с полным адъювантом Фрейнда (три предварительно заполненных шприца)
- Токсин коклюша (PTX) в глицериновом буфере (один флакон)
EAE индуцируется у мышей C57BL / 6 1 путем иммунизации эмульсией MOG 35-55 или MOG 1-125 в полном адъюванте Фрейнда (CFA) с последующим введением коклюшного токсина в PBS, сначала в день иммунизации, а затем снова. на следующий день.
Типичное начало EAE составляет от 9 до 14 дней после иммунизации, с пиком заболевания через 3-5 дней после начала для каждой мыши. Пик продолжается от 1 до 3 дней, после чего наступает частичное восстановление. Примерно у 25% мышей после первоначального частичного выздоровления будет наблюдаться увеличение тяжести (рецидива) ЕАЭ. Обычно это происходит через 20-27 дней после иммунизации.
Обычно за мышами наблюдают в течение 4 недель, в течение которых мыши остаются хронически парализованными.
Для большинства исследований мы рекомендуем группы от 10 до 12 мышей, по 4-6 мышей в клетке.
В таблице 1 ниже приведены материалы, необходимые для индукции EAE.
Таблица 1 — Необходимые материалы (на комплект)
| Кол-во | Описание |
|---|---|
| 1 | Hooke Kit ™ MOG 35-55 / CFA Emulsion PTX ( EK-2110 ) или Hooke Kit ™ MOG 1-125 / CFA Emulsion PTX ( EK-2160 ) (см. «Приложение C — Выбор набора» ниже.) |
| 10 | Мыши C57BL / 6 1 , самки, от 9 до 13 недель (модель B6-F Taconic Biosciences или штамм C57BL / 6J The Jackson Laboratory ) |
| Стерильные полипропиленовые пробирки на 50 мл Шприцы на 1 мл Иглы 27G 1/2 дюйма (12 мм) | |
| Стерильный фосфатно-солевой буферный раствор (PBS) (стандартный состав, pH 7,4, без кальция и магния) |
2 Обзор метода
Используйте самок мышей C57BL / 6 в возрасте от 9 до 13 недель. Сведите к минимуму нагрузку на мышь во время всех процедур (см. «Устранение неполадок» ниже).
- Акклиматизируйте мышей как минимум за 7 дней до иммунизации.
- День 0 — Выберите дозировку PTX
- День 0 — Ввести эмульсию антигена, п / к
- День 0 — Подождите примерно 2 часа (не критично; от 1 до 6 часов допустимо)
- День 0 — Подготовка раствора PTX
- День 0 — Первая инъекция раствора PTX, внутрибрюшинно.
- День 1 — Приготовьте раствор PTX (снова)
- День 1 — Вторая инъекция раствора PTX, внутрибрюшинно.
Гук рекомендует вводить две дозы PTX, одну в день введения эмульсии (день 0), а вторую на следующий день (день 1).
Некоторые лаборатории используют другой график администрирования PTX; наш ограниченный опыт показывает, что дозирование PTX в любое время между днем 0 и днем 3 приводит к аналогичному EAE. Однако все тесты Гука проводятся с дозированием в день 0 и день 1, и это рекомендуемый график.
Большинство исследователей подсчитывают количество мышей ежедневно между 7 и 28 днями после иммунизации. (См. « Приложение A — Руководство по оценке EAE мыши ».)
В следующих разделах представлены подробные процедуры.
3 Контроль степени тяжести EAE путем выбора дозировки PTX
Многие факторы влияют на тяжесть ЕАЭ, как показано в Таблице 2 ниже.Таблица 2 — Факторы, влияющие на тяжесть EAE
| Фактор | Эффект |
|---|---|
| Стресс перед началом EAE | Сильно снижает тяжесть заболевания |
| Пожилой возраст | Более тяжелое заболевание и более равномерное начало EAE |
| Пол | Самки мышей демонстрируют более стойкое заболевание |
| Подвид и заводчик | Варьируется |
| Доза и активность PTX | Более высокие дозы увеличивают тяжесть ЕАЭ |
Дозировка PTX используется для контроля степени тяжести EAE, компенсируя эти факторы. Более высокие дозы PTX обычно увеличивают тяжесть EAE, более низкие дозы уменьшают ее (в некоторых пределах).
Поскольку указанные выше факторы варьируются от лаборатории к лаборатории, исследователям в разных лабораториях и в разных экспериментах требуются разные дозы PTX, чтобы вызвать аналогичную степень тяжести EAE, даже с идентичными PTX и мышами.
Чтобы добиться надежного и равномерного развития EAE, используйте самок мышей в возрасте от 9 до 13 недель, минимизируйте стресс у мышей и тщательно выбирайте дозировку PTX.
Кроме того, эффективность PTX для индукции EAE может резко различаться (до 10 раз) между разными партиями PTX.
Мы настоятельно рекомендуем пользователям набора установить «базовую» дозу PTX для своей лаборатории в пилотном эксперименте, вызывая EAE у 10 мышей с помощью Hooke Kit ™ MOG 35-55 / CFA Emulsion PTX (кат. № EK-2110) 2 . См. «Приложение D — Результаты дозозависимой реакции РТХ in vivo» .
Как только базовая доза PTX установлена, ее следует скорректировать для каждого эксперимента, как описано в следующих разделах.
2 набора Hooke Kits ™ EK-2110 (MOG 35-55 ) и EK-2160 (MOG 1-125 ) вызовут подобную степень тяжести EAE при одинаковой дозе PTX.
3.1 Влияние стресса
Стресс у мышей до развития EAE сильно снижает тяжесть EAE (см. «Приложение B — фоновая биология EAE» ), поэтому минимизация стресса у мышей очень важна для успешной индукции EAE.
Местные лабораторные условия, такие как помещение, диета, температура, влажность, шум, вибрация и патогены, могут вызывать стресс у мышей и, следовательно, влиять на развитие EAE.
Грубое обращение вызовет стресс у мышей, как и перемещение мышей на тележке. Всегда обращайтесь с мышами осторожно и старайтесь выполнять все процедуры в комнате для мышей.
3.2 Корректировка стресса от введения лечения (только профилактическое лечение)
Если мышей будут лечить терапевтически (начиная с первых признаков EAE у каждой мыши), лечение мало влияет на развитие EAE.
Но если мышей будут лечить профилактически (до начала EAE), может потребоваться дополнительный PTX для компенсации стресса от лечения, в зависимости от пути и частоты введения.
Например, мыши, получавшие ежедневную дозу (QD), подвергаются большему стрессу, чем мыши, не получавшие лечения. Точно так же мыши, которым вводили дозу два раза в день (BID), подвергаются еще большему стрессу.
Пероральное (пероральное), внутрибрюшинное (ip) и подкожное (sc) дозирование квалифицированным специалистом вызывает аналогичный стресс, в то время как внутривенное (iv) дозирование вызывает больший стресс.
Для профилактического лечения перорально, внутрибрюшинно или подкожно (начиная с или до иммунизации) увеличьте базовую дозу PTX на 10%, если мышам будут вводить дозу QD, и на 20%, если дозу BID.
Плохо переносимые носители или лечебные соединения могут вызывать особый стресс, как и неквалифицированное дозирование.
4 Подробный протокол
До использования все компоненты набора должны быть холодными (от 2 до 8 ° C).
Для наиболее равномерного развития EAE используйте самок мышей C57BL / 6 в возрасте от 9 до 13 недель на момент иммунизации. Все мыши должны быть одного возраста. Можно использовать мышей-самцов, но у них будет менее стойкий EAE, чем у самок.
Поскольку на восприимчивость к EAE влияет стресс мышей, один и тот же человек должен дозировать все группы в эксперименте, чтобы контролировать различия в технике инъекции.
Если некоторых мышей будут лечить тестируемыми соединениями, группам отрицательного контроля следует вводить дозу одного и того же носителя, с той же частотой, тем же путем, чтобы контролировать стресс от введения препарата.
Акклиматизируйте мышей в своей лаборатории не менее чем за 7 дней до иммунизации.
4.1 Введение антигенной эмульсии
Эмульсия будет вводиться подкожно в два участка по 0,1 мл / участок (всего 0,2 мл / мышь).
Хорошая техника подкожных инъекций важна для успешной индукции EAE, как для правильного введения эмульсии, так и для минимизации стресса у мышей. Поскольку на восприимчивость к EAE влияет стресс у мышей, один и тот же человек должен дозировать все группы в эксперименте.
Анестезия не требуется, но иммунизацию можно проводить под анестезией изофлураном.
(Эти процедуры предназначены для инъекции правой рукой; обратная при инъекции левой рукой.)
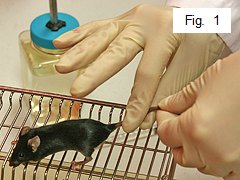
- Возьмитесь за хвост мыши пальцем правой руки (рисунок 1).
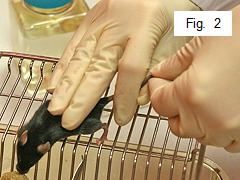
- Прижмите мышь к клетке тремя оставшимися пальцами правой руки (рис. 2).
- Левой рукой удерживайте мышь двумя пальцами за головой (рисунок 3).
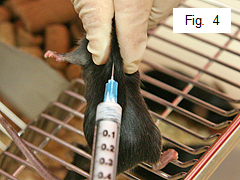
- Правой рукой введите мыши подкожно в верхнюю часть спины 0,1 мл эмульсии (рис. 4).Держите иглу в подкожном пространстве от 10 до 15 секунд, чтобы избежать утечки эмульсии. В качестве альтернативы, легкое нажатие на поршень шприца предотвратит утечку.
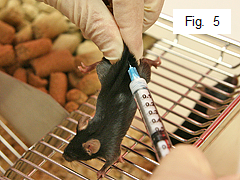
- Используя аналогичную технику, введите мыши подкожно в поясницу 0,1 мл эмульсии (рис. 5).Опять же, удерживайте иглу в подкожном пространстве от 10 до 15 секунд или слегка потяните за шприц, чтобы предотвратить утечку.Повторите (от 1 до 5) для всех мышей.
- Подождите примерно 2 часа, прежде чем приступить к первому введению PTX.(Точное время не имеет решающего значения; задержка от 1 до 6 часов приемлема, но задержка должна быть одинаковой для всех групп.)
4.2 Приготовление раствора токсина коклюша
В каждый набор входит флакон с 5 мкг PTX в 25 мкл глицеринового буфера (200 нг / мкл). Для дозирования этот PTX необходимо разбавить холодным PBS (от 2 до 8 ° C).
Раствор PTX следует готовить свежим в день 0 и снова свежим в день 1 в стерильных условиях с использованием шкафа биобезопасности.
Важно: поскольку дозировка PTX влияет на тяжесть EAE, объедините каждый препарат раствора PTX для всех мышей в эксперименте в одной пробирке на 50 мл следующим образом:
- Поместите PBS в пробирку на 50 мл: используйте 0,12 мл PBS для каждой мыши (т.е. 20% дополнительных, чтобы учесть потери при дозировании). Поместите общий объем для всех мышей в одну стерильную полипропиленовую пробирку на 50 мл.Пример: для 30 мышей: 30 * 0,12 мл = 3,6 мл PBS в пробирку.
- Добавьте PTX в PBS в пробирку на 50 мл:
- Кратковременно центрифугируйте флакон (ы) с PTX, чтобы убедиться, что материал находится на дне флакона (ов).
- Рассчитайте необходимое количество PTX 3 . Используйте формулу:Количество мышей * доза PTX (нг) * 1,2 / 200 = мкл PTX из флакона (ам)Пример: 30 мышей * 80 нг * 1,2 / 200 нг / мкл = 14,4 мкл
- Возьмите рассчитанный объем PTX из пузырьков и поместите в пробирку с PBS. Осторожно перемешайте (не перемешивайте).
- Держите раствор PTX на льду до введения. Введите PTX в течение 2 часов после приготовления.
3 Отрегулируйте концентрацию PTX так, чтобы она в 10 раз превышала предполагаемую дозу на мл, потому что каждый мл разбавленного PTX будет вводиться 10 мышам (0,1 мл / мышь).
4.3 Администрирование PTX
PTX будет вводиться внутрибрюшинно в дозе 0,1 мл / доза. Это будет повторено через 24 часа.
- Наберите 1 мл раствора PTX в шприц на 1 мл.
- Установите новую иглу 27G 1/2 дюйма (12 мм).
- Введите каждую мышь ip с 0,1 мл / мышь.
Повторите (от 1 до 3) для всех мышей.
- Через 22-26 часов повторите подготовку и инъекцию PTX (шаги с 1 по 3 выше) для всех мышей.
- Ежедневно проверяйте мышей на признаки EAE, начиная с 7-го дня после иммунизации. В большинстве случаев мышей оценивают до 28 дня (см. « Приложение A — Руководство по оценке EAE мышей »).
- При появлении первых признаков паралича дайте мышам кормовые гранулы и влажный корм на полу клетки, а также легкодоступную воду. HydroGel (ClearH2O, Portland ME) можно использовать в качестве источника воды при сильнейшем параличе.
5 Ожидаемые результаты
ЕАЕ будет последовательно индуцироваться у 90-100% мышей с началом паралича между 9 и 14 днями после иммунизации в день 0 и максимальным количеством баллов от 3,0 до 3,5 у большинства мышей. На рисунке 6 показаны типичные результаты.Рисунок 6 — Типичные результаты
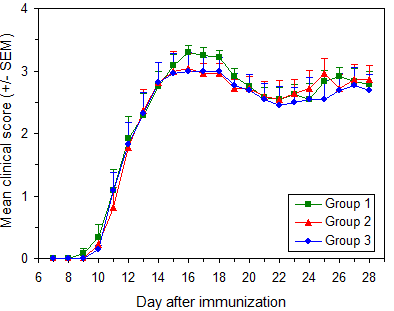
Индукция EAE у мышей C57BL / 6
Протокол: индукция EAE посредством активной иммунизации у мышей C57BL / 6
Данные взяты из трех независимых групп в одном эксперименте. Для иммунизации использовали Hooke Kit ™ MOG 35-55 / CFA Emulsion PTX ( EK-2110 ) с самками мышей C57BL / 6 в возрасте 11-13 недель (Taconic Biosciences).
Токсин коклюша из 3 флаконов был объединен перед введением.
Аналогичные результаты получены с использованием мышей C57BL / 6 из лаборатории Джексона, а также с MOG 1-125 / CFA Emulsion PTX ( EK-2160 ) с использованием рекомендованного протокола.
| Группа | Мыши / группа | Возраст на момент иммунизации | Средний максимальный балл ± стандартное отклонение | День начала заболевания ± стандартное отклонение | Болезнь заболеваемости |
|---|---|---|---|---|---|
| 1 | 11 | 11-13 недель | 3,46 ± 0,14 | 11,3 ± 1,4 | 100% |
| 2 | 11 | 11-13 недель | 3,36 ± 0,32 | 11,7 ± 1,8 | 100% |
| 3 | 11 | 11-13 недель | 3,18 ± 0,56 | 11,3 ± 1,7 | 100% |
5.1 Нормальные побочные эффекты индукции EAE
У всех мышей через 2–4 дня после инъекции появятся явные бугорки эмульсии в местах инъекции.
Большинство мышей сохранят эти шишки на время эксперимента (~ 30 дней).
Приблизительно от 10 до 40% мышей очищаются от эмульсии, развивая небольшие язвы (5 мм или меньше в диаметре) в местах инъекций. Эти язвы можно лечить мазью с антибиотиком, но обычно в этом нет необходимости — обычно они заживают в течение нескольких дней и образуются шрамы.
Наличие небольших язв или выступов эмульсии не коррелирует с развитием EAE.
5.2 Редкие побочные эффекты индукции EAE
У 3-10% мышей могут развиваться глубокие поражения кожи. Более мелкие поражения можно лечить мазью с антибиотиком. В случае более крупных поражений проконсультируйтесь с ветеринаром или усыпите мышь.
Редко (1-2% случаев) у мышей появляются красные неровные участки кожи с полным выпадением волос (алопеция), но без повреждений кожи (похоже на экзему). Пораженная область обычно имеет диаметр 25 мм или более, включая области, отличные от места инъекции эмульсии. Мыши будут чесать пораженный участок. У мышей с таким типом поражения почти никогда не разовьется ЕАЕ, и их следует усыпить и исключить из исследования.
Мы не знаем, почему у некоторых мышей появляются поражения, и не знаем, как их предотвратить.
6 Устранение неисправностей
Для успешной индукции EAE требуются процедуры обращения с мышами и содержания в них с низким уровнем стресса, хорошая техника инъекции, использование подходящих мышей и качественная, стабильная эмульсия антигена вместе с правильным количеством токсина коклюша.
Сведение к минимуму стресса у мышей очень важно для успешной индукции EAE:
- Акклиматизируйте мышей в своей лаборатории как минимум за 7 дней до иммунизации.
- Домашние мыши в тихой обстановке, без излишнего шума и вибрации.
- Избегайте чрезмерного обращения с мышами. Осторожно обращайтесь с мышами.
- Попробуйте проделать все процедуры в мышиной комнате. Избегайте перемещения мышей на тележках.
- Следуйте рекомендованной процедуре инъекции (см. « Введение антигенной эмульсии » выше).
Если у вас возникли трудности с индукцией EAE:
- Убедитесь, что EAE развивается у нелеченых мышей.
- Используйте самок мышей C57BL / 6 в возрасте от 9 до 13 недель при иммунизации.
- Используйте только анестезию изофлураном (анестезия не требуется).
- Подготовьте PTX в течение 2 часов после инъекции; держать на льду.
- Отрегулируйте дозу PTX (см. «Контроль степени тяжести EAE путем выбора дозировки PTX» ) выше.
Испытуемые препараты, вызывающие местное раздражение или повреждение тканей (обычно при внутрибрюшинном или подкожном введении), уменьшают или предотвращают развитие EAE. Такие составы не могут быть успешно протестированы в ЕАЕ, если не будет разработан состав с лучшей переносимостью.
Приложение A — Руководство по оценке EAE для мыши
Обычно EAE оценивается по шкале от 0 до 5. Большинство исследователей также дают мышам промежуточные оценки (т.е. 0,5, 1,5, 2,5, 3,5), когда клиническая картина находится между двумя определенными баллами.
Метод подсчета очков немного отличается в зависимости от стадии заболевания (начало / пик или выздоровление) для каждой отдельной мыши.
Надежная оценка EAE требует навыков, которые появляются после значительного опыта. Чтобы избежать неосознанной предвзятости при подсчете, мы настоятельно рекомендуем оценивать мышей вслепую человеком, не знающим, какие мыши получали какое лечение.
Мы рекомендуем следующие рекомендации по оценке для мышей в начале и на пике EAE:
Оценка EAE мыши — начало и пик
| Счет | Клинические наблюдения |
|---|---|
| 0,0 | Нет очевидных изменений двигательной функции по сравнению с неиммунизированными мышами.При поднятии за основание хвоста он напряжен и стоит прямо. Задние лапы обычно разведены. Когда мышь идет, нет ни походки, ни наклона головы. |
| 0,5 | Кончик хвоста вялый.При взятии за основание хвост имеет напряжение, за исключением кончика. В хвосте чувствуется напряжение мышц, при этом хвост продолжает двигаться. |
| 1.0 | Вялый хвост.При поднятии за основание хвоста, вместо того, чтобы стоять прямо, весь хвост накрывает палец. Задние лапы обычно разведены. Признаков движения хвоста не наблюдается. |
| 1.5 | Вялый хвост и подавление задних конечностей.При взятии за основание хвоста весь хвост накрывает палец. Когда мышь падает на решетку, по крайней мере одна задняя лапа постоянно проваливается. Ходьба очень слегка шаткая. |
| 2.0 | Вялый хвост и слабость задних конечностей.При взятии за основание хвоста лапы не расставляются, а держатся ближе друг к другу. Когда мышь наблюдается при ходьбе, ее походка явно шаткая. Пальцы одной ступни могут волочиться, но другая нога не имеет явных ограничений движения. — ИЛИ -Мышь имеет оценку 0,0, но при наблюдении за ходьбой наблюдаются явные признаки наклона головы. Баланс плохой. |
| 2,5 | Вялый хвост и волочение задних лап.Обе задние лапы имеют некоторое движение, но обе тянутся за лапы (мышь спотыкается на задних лапах). — ИЛИ -Никакого движения одной ногой / полное волочение одной ноги, но движение другой ногой. — ИЛИ -Тяжесть EAE при поднятии руки кажется легкой (0,0–1,5 балла), но при сильном наклоне головы мышь иногда падает. |
| 3.0 | Вялый хвост и полный паралич задних конечностей (наиболее часто). — ИЛИ -Вялый хвост и почти полный паралич задних конечностей. Одна или обе задние ноги могут грести, но ни одна из них не может двигаться вперед от заднего бедра. — ИЛИ -Вялый хвост с параличом передней и задней лапы. — ИЛИ -Все:Сильный наклон головы,Ходить только по краям клетки,Прижавшись к стене клетки,Вращение при поднятии за основание хвоста. |
| 3.5 | Вялый хвост и полный паралич задних конечностей. В дополнении к:Мышь перемещается по клетке, но, когда ее кладут на бок, не может самостоятельно выпрямиться. Задние лапы вместе с одной стороны тела. — ИЛИ -Мышь перемещается по клетке, но задняя часть тела плоская, как блин, что создает вид горба в передней части мыши. |
| 4.0 | Вялый хвост, полный паралич задних конечностей и частичный паралич передних конечностей.Мышь минимально перемещается по клетке, но кажется настороженной и кормящей.Часто эвтаназия рекомендуется после того, как мышь наберет 4,0 балла в течение 2 дней. Однако при ежедневном п / к введении жидкости большинство мышей C57BL / 6 могут выздороветь до 3,5 или 3,0, в то время как мыши SJL могут полностью выздороветь, даже если они достигнут 4,0 балла на пике заболевания. Когда мышь подвергается эвтаназии из-за тяжелого паралича, для этой мыши на оставшуюся часть эксперимента вводится оценка 5,0. |
| 4.5 | Полный паралич задних и частичных передних конечностей, отсутствие движений по клетке. Мышь не бдит.Мышь имеет минимальные движения в передних лапах. Мышь почти не реагирует на прикосновения.Рекомендуется эвтаназия. Когда мышь подвергается эвтаназии из-за тяжелого паралича, для этой мыши на оставшуюся часть эксперимента вводится оценка 5,0. |
| 5.0 | Мышь самопроизвольно перекатывается в клетке (рекомендуется эвтаназия). — ИЛИ -Мышь найдена мертвой из-за паралича. — ИЛИ -Мышь умерщвлена из-за сильного паралича. |
На стадии восстановления EAE у большинства мышей будет хвост, который больше не будет вялым, но и не нормальным; он кажется жестким и «зацепленным». Задние лапы могут начать двигаться (крутить педали), но мышь не может ходить. Любое изменение затрудняет подсчет очков.
Мы рекомендуем следующие модификации вышеуказанных критериев оценки для этих мышей:
Оценка EAE мыши — изменена
| Счет | Клинические наблюдения |
|---|---|
| 0,0 | Хвост, удерживаемый за основание хвоста, несколько «загнутый» и жесткий, но он совершает полные вращения вокруг оси тела («вертолет»). Мышь здорова. Никаких признаков раскачивания. |
| 0,5 | Мышь выглядит нормальной, но хвост «загнутый» и жесткий. Хвост не совершает полных оборотов вокруг оси тела («вертолет»). Мышь здорова. Никаких признаков раскачивания. |
| 3.0 | Мышь находится на боку (как описано выше для оценки 3,5), но задние лапы слишком подвижны. Мышь не может ходить. — ИЛИ -Мышь ходит неустойчиво (как описано выше для оценки 2,5) и не может сделать более двух шагов, не упав на бок. Мышь не может сама выпрямиться. — ИЛИ -Мышь плохо двигается в задних лапах (как описано выше для оценки 2,5) и имеет частичный паралич передней ноги, о чем свидетельствует то, что голова находится ниже обычного, и мышь не может выпрямиться, когда кладется на бок. |
| Все остальные оценки | Вычтите 0,5 из оценки всех мышей либо с жестким, «крючковатым» хвостом, либо с педалированием задних лап. |
Приложение B — биология фона EAE
Обзор
Экспериментальный аутоиммунный энцефаломиелит (EAE) является наиболее часто используемой мышиной моделью рассеянного склероза (MS) человека. Из-за большого сходства с РС EAE используется для изучения патогенеза аутоиммунитета, воспаления ЦНС, демиелинизации, переноса клеток и индукции толерантности.
EAE характеризуется параличом, воспалением ЦНС и демиелинизацией. EAE опосредуется миелин-специфическими CD4 + T-клетками, но CD8 + -клетки и B-клетки также могут играть роль в некоторых моделях EAE.
EAE индуцируется у мышей C57BL / 6 иммунизацией MOG 35-55 или MOG 1-125 в эмульсии CFA с последующим введением токсина коклюша (PTX) в PBS. Эмульсия обеспечивает антиген, который инициирует размножение и дифференцировку MOG-специфических аутоиммунных Т-клеток.
PTX усиливает развитие EAE, обеспечивая дополнительный адъювант и облегчая проникновение аутоиммунных Т-клеток в ЦНС.
Финголимод (FTY720, Gilenya) является наиболее часто используемым положительным контролем в этой модели.
Экспериментальная модель
Хронический EAE развивается у мышей C57BL / 6 после иммунизации эмульсией MOG 35-55 / CFA или MOG 1-125 / CFA с последующей инъекцией коклюшного токсина. Эта модель используется для проверки способности соединений предотвращать или смягчать болезнь EAE. Его можно проводить с соединением, дозированным с момента иммунизации (профилактическое лечение), или с целью обращения вспять течения заболевания и облегчения выздоровления путем дозирования соединения с момента начала EAE (терапевтическое лечение).
Антиген MOG 1-125 используется для тестирования терапевтических средств, которые специфически нацелены на В-клетки; Сообщается, что развитие EAE после иммунизации MOG 1-125 нарушается у мышей с дефицитом B-клеток.
В модели используются самки мышей C57BL / 6 в возрасте от 9 до 13 недель в начале исследования. Обычно EAE развивается через 8-18 дней после иммунизации. Развитие EAE обычно отслеживают в течение 4 недель (28 дней) после иммунизации.
Стресс до развития EAE снижает тяжесть EAE. Помимо любых эффектов соединения, введение лечения в период индукции заболевания (~ 0-10 дней после иммунизации) откладывает начало заболевания и снижает тяжесть заболевания. Это происходит из-за стресса от введения соединения и воздействия носителя на мышей. Чем чаще вводят и чем хуже переносится носитель, тем сильнее влияние на развитие заболевания.
Стресс, связанный с лечением и введением носителя, мало влияет на развитие заболевания после появления клинических признаков EAE.
Профилактическое лечение
В профилактических исследованиях лечение начинают до начала заболевания, во время иммунизации и группового распределения.
Профилактические исследования оценивают, повлияет ли лечение на течение заболевания как до, так и после первых клинических признаков EAE.
Чтобы компенсировать стресс от лечения в исследованиях профилактического лечения и достичь целевой степени тяжести заболевания, мы индуцируем ЕАЕ с помощью более высокой дозы токсина коклюша, чем в терапевтических исследованиях. Доза токсина коклюша основана на нашем предыдущем опыте работы с моделью в соответствии с ожидаемым стрессом из-за дозирования (путь, частота и состав носителя).
Мышей распределяют по группам лечения сбалансированным образом, чтобы получить группы с аналогичным распределением массы тела.
В профилактических исследованиях среднее время до начала заболевания обычно является наиболее чувствительной мерой эффективности соединения.
Небольшие изменения иммунного ответа могут привести к отложенному началу заболевания — подавление активации и пролиферации Т-клеток, презентации антигена, дифференцировки в клетки Th1 и / или Th17 — все это приведет к отложенному началу EAE.
Отсроченное начало EAE, сопровождающееся более низкой максимальной степенью тяжести, указывает на общую эффективность лечения по сравнению с группой отрицательного контроля.
Некоторые исследования покажут отсроченное начало EAE без других значительных эффектов соединения. В этих случаях соединение может повлиять на ранний путь развития иммунного ответа, но в конечном итоге избыточные процессы компенсируют потерю заблокированного пути. Другое возможное объяснение заключается в том, что препарат не смог поддерживать блокаду пути в течение всего исследования.
Соединения, которые задерживают начало EAE, часто также вызывают более высокие конечные оценки EAE, чем у мышей, получавших носитель. Обычно это вызвано не тем, что соединение ухудшает ЕАЕ, а тем, что пик заболевания у мышей, получавших соединение, откладывается и совпадает с периодом выздоровления у мышей, получавших носитель.
FTY720, наиболее распространенный положительный контроль в этой модели, является очень сильным ингибитором развития EAE при пероральном приеме 0,5 мг / кг или более QD. При дозе ~ 0,1 мг / кг FTY720 только отсрочивает начало EAE, не снижая максимальной тяжести заболевания.
Когда соединение вводится профилактически, наиболее важным показателем эффективности является снижение максимальной тяжести заболевания (средний максимальный балл, MMS). Уменьшение MMS указывает на общее снижение тяжести EAE.
Лечебное лечение
Исследования терапевтического лечения обычно начинают лечение во время начала EAE. В некоторых исследованиях, когда соединения проверяются на их способность обращать вспять течение хронического EAE, лечение начинают через 7-14 дней после начала заболевания. Мышей распределяют в группы лечения по мере развития у них EAE (непрерывный набор) или в фиксированное время после иммунизации, но всегда сбалансированным образом для получения групп с аналогичным временем начала EAE и аналогичными оценками начала EAE. Если зачисление происходит после начала EAE, мышей также балансируют по максимальному баллу перед зачислением.
Чтобы получить группы с высокой степенью однородности, EAE обычно индуцируется у мышей на 10% больше, чем необходимо в исследовании; это обеспечивает больший пул мышей для балансировки групп.
Терапевтические исследования оценивают, сможет ли лечение обратить вспять течение болезни или улучшить выздоровление от EAE.
Результаты обычно анализируются путем синхронизации баллов с датой начала заболевания для каждой мыши.
Наиболее важным показателем в этой модели является средний конечный клинический балл EAE. Это клинический результат эксперимента; уменьшение по сравнению с группой отрицательного контроля указывает на эффективность лечения.
Ход развития EAE у нелеченых мышей
У отдельных мышей течение болезни будет несколько отличаться. Большинство мышей проявляют начальные признаки EAE между 9 и 14 днями после иммунизации. После начала EAE пик заболевания почти всегда наступает через 3-4 дня. Максимальный результат сохраняется в течение нескольких дней, после чего мыши частично выздоравливают. У некоторых мышей болезнь будет оставаться максимальной до конца исследования. Реже мышь остается на пике тяжести всего один день, а затем начинает восстанавливаться.
Степень выздоровления во многом зависит от максимальной степени тяжести, достигнутой мышью. По нашему опыту, мыши, у которых показатель EAE составляет 2,5, никогда не выздоравливают полностью. Скорее всего, это связано с повреждением аксонов, которое происходит у мышей с обширным воспалением. Большинство мышей, не получавших лечения или получавших носитель, полностью не выздоровеют, но их конечная оценка обычно будет на 0,5–1,5 балла ниже, чем их максимальная оценка. Примерно у 25% мышей, не получавших лечения или получавших носитель, наблюдалось ухудшение ЕАЕ между 24 и 28 днями после иммунизации, напоминающее рецидив. Спинной мозг этих мышей во время обострения ЕАЭ имеет большое количество воспалительных очагов (≥ 7 очагов на разрез), аналогично гистологическим данным во время начала и пика ЕАЭ, что позволяет предположить, что это истинные рецидивы с новой волной воспаление спинного мозга.
Когда за мышами наблюдают в течение более длительного периода времени (более 6 недель), тяжесть заболевания обычно медленно увеличивается, напоминая хроническое прогрессирующее течение болезни, наблюдаемое у пациентов с РС-человеком.
В ходе EAE изменения массы тела отражают тяжесть заболевания. Мыши часто теряют в весе на следующий день после иммунизации. Это, по-видимому, связано с эффектами введенного адъюванта и коклюшного токсина. Затем мыши постепенно увеличивают свою массу тела до начала болезни. В день начала EAE мыши постоянно теряют 1-2 г веса тела (5-10% веса тела). Снижение веса продолжается по мере прогрессирования тяжести ЕАЭ, при этом потеря веса достигает около 20% от первоначальной массы тела на пике заболевания. Снижение веса, скорее всего, связано как с параличом, так и с пониженным потреблением пищи, а также с высокой выработкой провоспалительных цитокинов, таких как TNF, во время острой фазы воспаления. После достижения пика болезни мыши медленно набирают вес, даже если их клинические показатели не улучшаются. Это увеличение веса может быть связано с понижением регуляции воспаления, что приводит к снижению уровня провоспалительных цитокинов в крови. Необработанные или обработанные носителем мыши обычно имеют около 90% веса тела до иммунизации через 28 дней после иммунизации.
Гистология
Обычно гистологический анализ выполняется либо в конце исследования (обычно примерно через 28 дней после иммунизации), либо в то время, когда группа носителя достигает пика заболевания (обычно через 14-18 дней после иммунизации).
Воспаление при EAE обычно начинается в поясничной области спинного мозга, а к пику заболевания распространяется на весь спинной мозг.
В начале болезни количество воспалительных очагов сильно коррелирует с тяжестью заболевания. Количество очагов несколько увеличивается до пика заболевания, когда обычно по всему спинному мозгу обнаруживаются 6-15 воспалительных очагов на срез. В хронической стадии EAE (начинающейся через несколько дней после пика заболевания) многие воспалительные очаги рассасываются, что обычно приводит к 3-4 воспалительным очагам в каждом отделе спинного мозга примерно через 28 дней после иммунизации.
Поскольку наибольшее количество воспалительных очагов присутствует на ранней стадии заболевания, если гистологический анализ проводится в конце исследования, мыши с поздним началом EAE часто имеют больше воспалительных очагов в спинном мозге, чем можно было бы ожидать на основании их клинических данных. счет. Например, в 28-дневном исследовании мышь с началом EAE на 27 дней после иммунизации и конечной клинической оценкой 2, вероятно, будет иметь больше воспалительных очагов, чем мышь с началом EAE через 9 дней после иммунизации и конечной оценкой 3,5. Точно так же мышь, у которой рецидив незадолго до окончания исследования (рецидив определяется как увеличение клинической оценки на 1 или более пунктов), обычно будет иметь больше воспалительных очагов в конце исследования, чем мышь со стабильным хроническим заболеванием, даже если в конце исследования у этих двух пациентов был одинаковый клинический балл.
Демиелинизация обычно не обнаруживается в течение первых двух дней после начала заболевания, но обнаруживается на пике заболевания (через 4–5 дней после начала EAE) и продолжается во время хронической фазы EAE. Показатели демиелинизации не сильно меняются от пика до 28 дней после иммунизации и обычно составляют в среднем от 1,2 до 2,5.
Демиелинизацию оценивают в срезах, окрашенных антимиелиновым основным белком (анти-MBP, с использованием иммуногистохимии) и окрашенными гематоксилином и эозином (H&E).
В срезах анти-MBP демиелинизация наблюдается в виде заметных неокрашенных участков в трактах белого вещества и связана с наличием больших вакуолей.
На срезах, окрашенных H&E, нарушение нормальной структуры и наличие больших вакуолей свидетельствует о демиелинизации.
Апоптотические клетки идентифицируются в срезах H&E и обычно не обнаруживаются в течение первых двух дней развития болезни. Они обнаруживаются на пике и во время хронической стадии EAE. Среднее количество апоптотических клеток обычно составляет от 2 до 4 на секцию.
Приложение C — Выбор комплекта
Hooke Kit ™ EK-2110 содержит MOG 35-55 в качестве антигена; набор ЭК-2160 содержит МОГ 1-125 .
Оба набора рекомендуются для использования с самками мышей C57BL / 6 в возрасте от 9 до 13 недель. EK-2110 (MOG 35-55 ) также можно использовать с мышами (C57BL / 6 x SJL) F1; с этими мышами используйте меньшую дозу PTX (обычно от 50 до 75% дозы, необходимой для мышей C57BL / 6).
Любой антиген можно использовать для изучения развития EAE, включая тестирование эффективности потенциальных терапевтических средств.
Антиген MOG 1-125 рекомендуется для тестирования терапевтических средств, специфически нацеленных на В-клетки; Сообщается, что развитие EAE после иммунизации MOG 1-125 нарушается у мышей с дефицитом B-клеток [1] .
Информацию о выборе модели и антигена см. В Учебном центре Hooke ( http://hookelabs.com/learning ).
Приложение D — Результаты дозозависимой реакции РТХ in vivo
Примечание. Это приложение предназначено для использования только с Hooke PTX, номер лота 1008 . (Если вы используете другую партию, см. Обновленный протокол на сайте hookelabs.com/protocols .)
Эффективность PTX для индукции EAE может различаться до 10 раз между разными партиями PTX (Таблица D1). Поэтому при переходе на новую партию PTX необходимо изменить дозировку.
К сожалению, степень тяжести EAE не зависит от дозы PTX, и форма кривой доза-ответ отличается для каждой партии PTX.
Поэтому, чтобы помочь клиентам выбрать дозу PTX, которая будет лучше всего работать в их лабораториях, мы представляем результаты экспериментов Hooke по индукции EAE доза-ответная реакция in vivo, проведенных для характеристики партии PTX 1008.
В каждом эксперименте EAE индуцировали с помощью Hooke Kit ™ EK-2110 с использованием PTX, лот 1008. В остальном мышей не лечили. Каждый эксперимент также включал одну или несколько доз предыдущей партии РТХ 1007 для сравнения.
В таблице D1 ниже показаны средние результаты пяти экспериментов.Таблица D1 — Средние результаты EAE для партии PTX 1008
| PTX lot 1008 доза (нг) | MMS | День начала EAE (медиана) | Смертность | Заболеваемость EAE |
|---|---|---|---|---|
| 50 | 3,16 | 12,8 | 2,5% | 97,5% |
| 100 | 3,33 | 11,9 | 4,0% | 100,0% |
| 150 | 3,43 | 11,5 | 5,0% | 100,0% |
| 200 | 3,46 | 11.2 | 3,3% | 100,0% |
В таблице D2 и на рисунках с D1 по D5 ниже представлены более подробные результаты этих экспериментов.
Мы предлагаем клиентам просмотреть эти дозовые реакции и выбрать дозу PTX в соответствии с их экспериментальными и институциональными требованиями.
Таким образом, данные по индукции EAE с использованием PTX партий 1007 и 1008 показывают, что во всем диапазоне испытанных доз (от 50 до 200 нг):
- Потенциал PTX партии 1008 составляет примерно 50% от эффективности партии 1007.
- Лот 1008 PTX вызывает начало EAE немного позже, чем лот 1007
- ПТХ партия 1008 дает более низкую смертность, чем партия 1007.
Как и в случае с большинством результатов in vivo, между экспериментами существуют значительные различия.
Рекомендуемая доза Гука для партии PTX 1008 составляет 100 нг для каждого из двух введений (день 0 и день 1). Это доза, которую мы используем в наших внутренних исследованиях. Однако дозы от 50 до 150 нг вызывают хороший EAE.
Если приоритетом является предотвращение чрезмерно тяжелого EAE (например, для выявления увеличения тяжести EAE у генетически модифицированных мышей или из-за требований IACUC), более низкие дозы PTX лота 1008 — ваш лучший выбор. По нашим результатам, 50 нг / доза дали хороший ЕАЕ в 3 из 4 испытаний при этой дозе, но в одном испытании тяжесть заболевания была слабее, чем цель Гука (рисунки D1 – D5).
Если приоритетом является получение надежного и тяжелого ЕАЭ, предпочтительнее от 100 до 150 нг / доза — ни одно из испытаний Гука in vivo не имело недостаточной тяжести ЕАЭ с этими дозами PTX лота 1008.
Как упоминалось выше, эти дозы являются ориентировочными и могут нуждаться в корректировке с учетом ваших конкретных лабораторных условий.
Подробные результаты
Таблица D2 ниже суммирует результаты пяти испытаний доза-эффект с PTX лот 1008 (исходные данные для таблицы D1 выше).Таблица D2 — Сводные результаты для партии PTX 1008 — EAE у мышей C57BL / 6
| Номер исследования Гука | PTX lot 1008 доза (нг) | MMS | День начала EAE (медиана) | Смертность | Заболеваемость EAE |
|---|---|---|---|---|---|
| 20171207-H1 | 50 | 3,05 | 12,5 | 0% | 90% |
| 100 | 3,25 | 12.0 | 0% | 100% | |
| 200 | 3,55 | 11,5 | 0% | 100% | |
| 20180515-H | 50 | 3,35 | 12,5 | 0% | 100% |
| 100 | 3,44 | 13.0 | 0% | 100% | |
| 150 | 3,67 | 12,5 | 10% | 100% | |
| 200 | 3,44 | 12.0 | 0% | 100% | |
| 20180620-H | 50 | 3.10 | 15.0 | 10% | 100% |
| 100 | 3,05 | 13.0 | 0% | 100% | |
| 150 | 3,30 | 13,5 | 0% | 100% | |
| 20180727-H | 50 | 3,15 | 11.0 | 0% | 100% |
| 100 | 3,55 | 10,5 | 20% | 100% | |
| 150 | 3,65 | 10.0 | 10% | 100% | |
| 200 | 3,40 | 10.0 | 10% | 100% | |
| 20180830-H | 100 | 3,35 | 11.0 | 0% | 100% |
| 150 | 3.10 | 10.0 | 0% | 100% |
На рисунках с D1 по D5 ниже показаны средние клинические баллы для каждого эксперимента, перечисленные в таблице D1 выше.