2 июня 1941 года в возрасте 37 лет бейсболист Лу Гериг скончался от амиотрофического бокового склероза (БАС), прогрессирующего заболевания мышечной дегенерации. Сегодня, спустя почти 80 лет после его смерти, ученые все еще ищут первопричину — и эффективное лечение — для условия.
Теперь ученые из Sanford Burnham Prebys обнаружили, что белок под названием мембралин играет ключевую роль в БАС, и определили генную терапию, стимулирующую мембралин, которая продлила выживаемость мышей с симптомами, подобными БАС. Исследование было опубликовано в журнале клинических исследований .
«БАС — это разрушительное состояние, которое остро нуждается в новых методах лечения. Однако исследователи все еще сталкиваются с основами: что вызывает БАС и что заставляет его прогрессировать», — говорит Джон Равитс, доктор медицинских наук, автор исследования и профессор клинической неврологии в Калифорнийском университете. Сан Диего. «Это исследование дает новое важное представление о механизме (ах), который может стимулировать БАС, и потенциальное терапевтическое направление, которые являются важными первыми шагами в поиске эффективных лекарств».
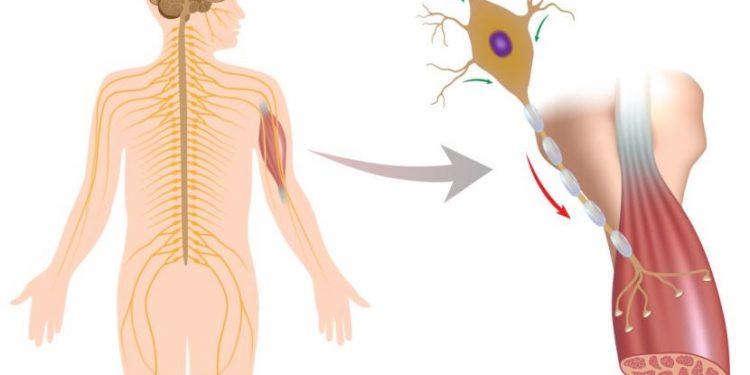
БАС, часто называемая болезнью Лу Герига, вызвана потерей моторных нейронов в головном и спинном мозге, что приводит к постепенному сокращению мышц. Большинство людей в возрасте от 40 до 70 лет, когда им ставят диагноз; приблизительно 16 000 американцев имеют условие, согласно Ассоциации ALS. По неизвестным причинам, у военных ветеранов почти в два раза больше шансов поставить диагноз этой болезни. Там нет никакого лечения или эффективного лечения.
«Наши результаты идентифицируют новый механизм патогенеза БАС и позволяют предположить, что модулирование мембралина обладает потенциалом в терапии БАС», — говорит Хуаси Сюй, доктор философии, старший автор статьи и профессор, а также руководитель руководства Жанны и Гари Хербергеров в Сэнфорде Бернхем Исследовательский центр нейробиологии и старения им. Пребиса. «Эти выводы помогают информировать о разработке потенциальных методов лечения, которые могут замедлить или остановить прогрессирование заболевания».
Многое о мембралине, который был открыт в 2002 году, остается загадкой. Ученые знают, что белок является частью механизма утилизации белка в клетке, который называется системой деградации, связанной с эндоплазматическим ретикулумом, и работа Сюй ранее показала причастность белка к болезни Альцгеймера. Чтобы лучше понять роль мембралина в нейродегенеративных заболеваниях, он и его команда создали мышей, которым не хватало белка в различных клетках мозга, таких как двигательные нейроны, астроциты, микроглия и олигодендроциты.
«Мы были удивлены фенотипом мышей с недостатком мембралина», — говорит Лу-Лин Цзян, доктор философии, первый автор исследования и доктор наук в лаборатории Сюй. «У них были явные нарушения мышц, которые отражали симптомы БАС у людей. Это открытие было особенно неожиданным — и случайным — поскольку предыдущие исследования по исследованию ассоциаций всего генома (GWAS) никогда не идентифицировали ген мембралина как потенциального виновника в БАС».
Ученые разработали серию экспериментов для дальнейшего изучения своих результатов, включая анализ нескольких моделей ALS на мышах, изучение астроцитов, в которых отсутствует белок, и анализ образцов спинного мозга от людей с ALS и без него. Их результаты показали, что нейротрансмиттер под названием глутамат накапливается в области за пределами мембрано-дефицитных астроцитов. Известно, что избыток глутамата убивает нейроны, поэтому это свидетельство дало ключ к патогенезу БАС. Избыток глутамата был вызван подавлением транспортера глутамата, называемого EAAT2. Анализ образцов ткани от людей с БАС подтвердил, что уровни мембралина и переносчика EAAT2 сильно коррелируют и оба снижаются при заболевании человека.
В рамках исследования ученые также разработали адено-ассоциированный вирус (AAV), который может повышать уровень мембралина. Мыши ALS, получавшие AAV, усиливающий мембралин, жили почти на две недели дольше, чем мыши, не получая лечения, что указывает на то, что усиление мембралина или ассоциированных белков является перспективным в качестве потенциального терапевтического подхода.
Затем ученые планируют выяснить, встречается ли этот же механизм — нарушение экспрессии EAAT2 и сверхэкспрессия глутамата — при болезни Альцгеймера, другом расстройстве, которое крайне необходимо для эффективного лечения.
Источник истории:
Материалы предоставлены медицинским исследовательским институтом Sanford Burnham Prebys . Примечание: содержание может быть отредактировано по стилю и длине.