Рассеянный склероз (МS) характеризуется демиелинизированными поражениями центральной нервной системы. Разрушение миелина и вторичное повреждение аксонов и нейронов приводит к значительной инвалидности, особенно у людей с прогрессирующим РС. Накопленные данные свидетельствуют о том, что потенциал для восстановления миелина существует при РС, хотя по неясным причинам этот процесс не удается. Клетки, ответственные за продуцирование миелина, олигодендроцитов и их предшественников, клеток-предшественников олигодендроцитов (OPCs), были идентифицированы в месте поражения даже у взрослых. Их присутствие предполагает возможность того, что эндогенная ремиелинизация без трансплантации донорских стволовых клеток может быть механизмом восстановления миелина при РС. Стратегии разработки новых методов лечения были сфокусированы на индукции сигнальных путей, которые стимулируют созревание OPC в миелин-продуцирующие олигодендроциты, которые затем могут ремиелинизировать поражения. Мы исследовали фармакологические подходы для усиления дифференцировки OPC и определили, что комбинация двух агентов, трийодтиронина (T3) и кветиапина, приводит к аддитивному эффекту на дифференцировку OPC и последующую продукцию миелина посредством как перекрывающихся, так и различных сигнальных путей. Хотя конечная продукция миелина требует биосинтеза холестерина, мы определили, что кветиапин усиливает экспрессию генов на этом пути более мощно, чем Т3. Два блокатора выработки холестерина, бетулин и симвастатин, снижали дифференцировку OPC в миелин-продуцирующие олигодендроциты.
Вступление
Этиология рассеянного склероза (МS) остается неизвестной, но ее отличительным признаком является наличие демиелинизирующих поражений в центральной нервной системе (ЦНС) [ 1 , 2 ]. Считается, что рецидивирующий ремиттирующий РС является результатом аутоиммунной атаки на миелиновые антиген-несущие клетки, хотя роль иммунной системы при прогрессирующем РС менее четко определена [ 3 — 5]. Лечение рассеянного склероза в основном было направлено на ограничение иммунной атаки на клетки ЦНС, чтобы сдержать повреждение. В то время как было несколько методов лечения с различной степенью эффективности при замедлении заболевания, репаративные методы лечения остаются неуловимыми. Относительно недавняя область исследований была сосредоточена на восстановлении миелина, что может обеспечить альтернативный или дополнительный подход к доступным в настоящее время терапевтическим вариантам.
Во время развития поражения MS олигодендроциты теряются в различной степени, и демиелинизированные аксоны могут подвергаться вторичной дегенерации. Наличие демиелинизированных, но интактных аксонов и тонко миелиновых аксонов, которые считаются частично ремиелинизированными, позволяет предположить, что возможность ремиелинизации существует даже у взрослых с МS [ 6 , 7 ]. Вероятно, ремиелинизация зависит от мобилизации, миграции и созревания клеток-предшественников олигодендроцитов (OPC) в зрелые миелин-продуцирующие олигодендроциты (OL) [ 8 , 9 ]. Открытие того факта, что OPC присутствуют у взрослых в гораздо больших количествах, чем считалось ранее, обеспечило существенную поддержку обоснованию разработки методов лечения, основанных на стимуляции OPC [ 10].— 14 ]. Созревание OPC и, в конечном счете, производство миелина включает в себя ряд различных этапов и путей [ 15 , 16 ], и их лучшее понимание имеет решающее значение для разработки новых подходов к восстановлению [ 7 ].
Было проведено несколько исследований, рассекающих пути, участвующие в созревании OPCs in vivo, и нацеленных на процесс стимулирования репарации. Одной из молекул, которая была тщательно изучена, является гормон щитовидной железы, трийодтиронин (T3), который запускает процесс созревания, при котором OPCs прекращают пролиферировать и дифференцируются в миелин-продуцирующие клетки [ 17 ]. Предыдущие исследования на животных показали, что введение Т3 улучшает ремиелинизацию, что указывает на критическую роль этой молекулы [ 18 , 19 ].
В то время как белки миелина были в центре иммунологического аспекта MS, миелин состоит в основном из липидов, и одной гистологической особенностью зрелых OL на самом деле являются насыщенные липидами вакуоли. Таким образом, при производстве нового миелина значительный биогенез липидов, в частности холестерина, должен быть резко увеличен [ 20 ]. Исследования блокирования холестерина показали смешанные результаты, но предполагают, что значительное истощение холестерина является вредным для клеток линии OL [ 21 — 24 ]. Кроме того, некоторые соединения, усиливающие дифференцировку, имеют открытый биосинтез холестерина как важный сигнальный путь [ 25 — 27 ].
Кветиапин является атипичным антипсихотиком, который используется в нескольких психиатрических учреждениях. Он также исследуются в качестве возможного терапевтического агента для повышения ремиелинизации в MS на основе позитивных данных в пробирке [ 28 — 30 ] и в естественных условиях . В экспериментах на животных моделях демиелинизации, кветиапин EAE улучшает, скорее всего , по крайней мере , частично посредством воздействия на иммунную систему [ 31 ], а также способствует дифференциации в OPC моделей cuprizone [ 28 , 32 — 34 ].
Чтобы дополнительно выяснить механизмы, с помощью которых агенты, такие как T3 и кветиапин, оказывают свое благотворное влияние на дифференцировку OPC, мы стремились проанализировать сигнальные пути, которые способствуют дифференцировке, определяя, таким образом, можно ли повысить дифференцировку OPC и ремиелинизацию путем нацеливания на комплементарные и аддитивные пути.
материалы и методы
Олигодендроцитарные клетки-предшественники культуры
OPCs были получены из коры головного мозга щенков грызунов P4-P7, как описано ранее [ 35 ]. Щенков крысы декапитировали, затем кортикальные слои рассекали и ферментативно диссоциировали с использованием набора для нервной диссоциации (P) (Miltenyi Biotec). OPCs были положительно отобраны путем мечения микрошариками A2B5 и прохождения через магнитные колонки (Miltenyi Biotec). Клетки высевали и размножали в течение 3-4 дней в OPC-среде (модифицированной из [ 36].], составленная из модифицированной по Дульбекко среды Игла с В27, глютамином, пенициллином / стрептомицином, пируватом натрия, микроэлементами B (все от ThermoFisher Scientific), апо-трансферрином 100 мкг / мл, бычьим сывороточным альбумином 100 мкг / мл, прогестероном 60 нг / мл, путресцин 16 мкг / мл, селенит натрия 40 нг / мл, инсулин 50 мкг / мл, инсулин, N-ацетилцистеин 5 мкг / мл, биотин 10 нг / мл, гидрокортизон 50 нг / мл (все от MilliporeSigma)) с рекомбинантным человеческий PDGF-AA (PeproTech) до достижения оптимальной плотности. После пролиферации клетки дифференцировали в течение 96 часов в среде OPC с добавлением либо T3 (45 нМ; Sigma-Aldrich), кветиапина гемифумарата (1 мкМ, Sigma-Aldrich), либо обоих. Медиа была пополнена на 48 часов. Для ингибирования синтеза холестерина бетулин (0,03, 0,3 и 3 мкг / мл; Sigma-Aldrich) или симвастатин (0,1, 1 и 10 мкМ; Sigma-Aldrich) добавляли в среду в начале и через 48 часов во время анализа дифференцировки. Все соединения разводили в ДМСО до конечной концентрации 0,1% от конечного объема. 0,1% ДМСО использовали в качестве контроля транспортного средства.
Для экспериментов, в которых добавка B27 не использовалась, она была заменена коктейлем дифференциации, исключая T3, но включая все другие составляющие добавки B27; L-карнитин 2 мкг / мл, этаноламин 1 мкг / мл, D-галактоза 15 мкг / мл, путресцин 16,1 мкг / мл, биотин 10 нг / мл, селенит натрия 14,35 нг / мл, кортикостерон 20 нг / мл, линолевая кислота 1 мкг / мл, линоленовая кислота кислота 1 мкг / мл, липоевая кислота 47 нг / мл, прогестерон 6,3 нг / мл, ретинол ацетат 100 нг / мл, ретинол (все транс) 100 нг / мл, D, L-альфа-токоферол 1 мкг / мл, D, L-альфа — токоферола ацетат 1 мкг / мл, альбумин (бычий) 2,5 мг / мл, каталаза 2,5 мкг / мл, глутатион 1,0 мкг / мл, инсулин 4 мкг / мл, супероксидаза дисмутаза 2,5 мкг / мл, трансферрин 5 мкг / мл — все от MilliporeSigma.
Количественная ПЦР
РНК выделяли из культивируемых OPC с использованием RNeasy Plus Mini Kit (Qiagen). Затем кДНК синтезировали из выделенной мРНК с использованием набора для синтеза кДНК iScript (Bio-Rad). Количественную ПЦР проводили на этих образцах с использованием набора SensiMix SYBR & Fluorescein (Bioline) в системе обнаружения ПЦР Touch в реальном времени CFX384 (Bio-Rad). Мишени были нормализованы к эталонному гену hprt1 , и был проведен дельта-дельта-КТ-анализ для определения кратного изменения экспрессии каждого гена. Целевые гены и их последовательности были следующими: mbp Forward 5′-3 ‘CACAAGAACTACCCACTACGG, Reverse 5′-3’ GCCTCTCCCCTTTCCTTG, hmgcs1 Forward 5′-3 ‘GATGGTGTAGATGCTGGAAAGTA, Reverse 5′-3’ GTCAGGGAGAGAGФорвард 5′-3′ AAGAGTCGCTGTGTTCATCTC, обратный 5′-3′ CCTGCTTGTACTCTGCTCTAAC, fdft1 вперед 5′-3′ ACTGGCACTTCCCTACTAGA, обратный 5′-3′ CGTAGCCTACTAACCACCAATAC, sqle вперед 5′-3′ TGCAGTCTATGCCACGTATTT, обратный 5′-3′ AGAGCACGCTTTGTACAGTATAG, cyp51 Вперед 5′-3 ‘ACTGAAAGACTCCTGGGTAGA, обратный 5′-3’ CAAACGGCACATAGGCAAAC, hprt1 Вперед 5′-3 ‘GGTGAAAAGGACCTCTCGAAG, Обратный 5′-3’ GCTTTTCCACTTTCGCTGATG .
Иммуноцитохимическая
Дифференцированные OPC фиксировали 4% PFA в течение 15 минут. После фиксации их инкубировали в течение ночи с мышиными моноклональными антимиелиновым основным белком (MBP) (1: 1000; клон SMI-99 Biolegend) и кроличьими поликлональными анти-Olig2 (1: 1000; MilliporeSigma) антителами. На следующий день их инкубировали во вторичных антителах против мышей Alexa Fluor 488 (1: 1000; Invitrogen) и против кроликов 594 (1: 1000; Invitrogen) в течение 2 часов. Ядерное окрашивание DAPI проводили в течение 10 минут, которое промывали перед визуализацией. Изображения были получены с использованием IncuCyte S3 50400, анализ выполнен с использованием версии IncuCyte S3 2017A Rev2. Общая интегрированная интенсивность для MBP (общая сумма интенсивности флуоресценции объектов на изображении: флуоресцентные единицы x мкм 2/ изображение) и количество положительных по Olig2 клеток определяли количественно, а отношение интегральной интенсивности MBP / число Olig 2 определяли для 16 изображений на лунку, из 2 лунок на условие, в общей сложности в 3 экспериментах. Изображения с более высоким разрешением были получены с использованием эпифлуоресцентного микроскопа при 20-кратном увеличении и лазерного конфокального микроскопа с использованием 63-кратных объективов. Для окрашивания холестерина после фиксации клетки окрашивали мышиным моноклональным анти-Olig2 (1: 500; MilliporeSigma) в течение ночи. На следующий день их инкубировали с вторичной анти-мышиной 594 (1: 1000; Invitrogen) и комплексом филипинов (MilliporeSigma) 50 мкг / мл в течение 2 часов. Изображения были получены с использованием микроскопа Keyence BZ-X700. Анализ проводился с использованием ImageJ v 1.52a Национального института здравоохранения. Площадь окрашенного филипином в пикселях и количество положительных по Olig2 клеток определяли количественно,
Визуализация живых клеток
Цитотоксичность различных соединений определяли путем культивирования OPC в присутствии соединения и реагента IncuCyte Cytotox Green (Essen Bioscience) в среде OPC. В клетках, где нарушена целостность мембраны, реагент связывается с ДНК, увеличивая ее флуоресценцию. В IncuCyte S3 50400 на каждую лунку каждые 2 часа брали девять изображений в течение 72 часов. Для каждой копии было 2 лунки. Анализ проводился с использованием программного обеспечения IncuCyte S3, версия 2017A Rev2.
Анализ генного массива
Микрочипы Afflymetrix были завершены на культурах T3, кветиапина, T3 плюс кветиапина и контрольных OPC в начале (день 0), через 48 часов и 96 часов после начала анализа дифференцировки. Анализ обогащения набора генов (GSEA) [ 37 ] проводился путем сравнения образцов, обработанных T3, с образцами, обработанными кветиапином и T3 плюс кветиапин, для определения пути обогащения генов, связанных с T3, QTP и T3 + QTP по сравнению с контролем [ 38 ].
Вестерн-блот
OPCs в культуре лизировали в буфере RIPA в присутствии ингибиторов протеазы и фосфатазы (коктейль Halt протеазы и ингибитора фосфатазы; ThermoFisher) после 96 часов дифференцировки в присутствии T3 45 нМ, кветиапина 1 мкМ, комбинации обоих или носителя DMSO. Белок определяли количественно с использованием анализа BCA, и образцы денатурировали путем нагревания до 95 ° C в течение 10 минут с 4X SDS восстанавливающим буфером (Boston BioProducts). Электрофорез проводили в 12% полиакриламидном геле в течение 1 часа 15 минут при 110 В, и отдельные белки переносили на нитроцеллюлозную мембрану с использованием Trans-Blot ® Turbo ™.система блоттинга (Bio-Rad). После блокирования 5% сухим молоком мембраны окрашивали антителами MBP (1: 1000) (клон SMI99, Biolegend) и актина (1: 5000) (Sigma-Aldrich, клон AC-74) в течение ночи, затем вторичными антителами IRDye ®. 700CW и 800CW для обнаружения с использованием системы визуализации Odyssey (LI-COR). Интенсивность была определена для полос MBP и Actin. Соотношение MBP / Actin определяли для каждого образца, затем нормализовали к контрольному условию. Всего было проведено шесть независимых экспериментов. Каждый набор образцов запускался в двух экземплярах. Среднее значение дубликатов было включено в приведенный анализ.
животные
Все протоколы на животных были одобрены и придерживались руководящих принципов Комитета по уходу и использованию животных при Институте Джона Хопкинса. Крыс содержали в учреждении Джона Хопкинса, в котором не было патогенов. SAS Sprague Dawley — беременные крысы были приобретены у Charles River.
статистический анализ
Для КПЦР и иммуногистохимии использовали односторонний ANOVA с множественным сравнительным тестом Тьюки. Столбцы представляют стандартную ошибку среднего. Был проведен t-тест Стьюдента для анализа вестерн-блоттинга, сравнения между каждым условием лечения и контролем. Значение p ≤ 0,05 использовалось в качестве предела значимости для всех статистических тестов.
Результаты
Кветиапин и Т3 обладают аддитивными эффектами в индукции дифференцировки OPC
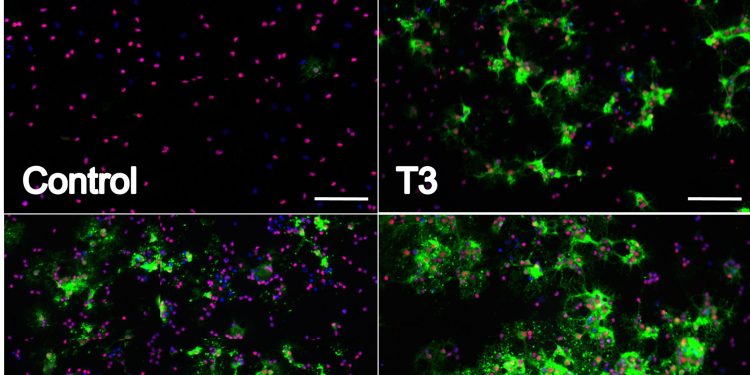
Чтобы исследовать влияние кветиапина и Т3 на дифференцировку OPC, мы создали первичные культуры OPC, добавили каждый агент отдельно или в комбинации и провели всестороннюю оценку характерных особенностей дифференцировки OPC. В частности, мы использовали генетический, белковый и морфологический анализы для количественной оценки процесса дифференциации. Экспрессию и продукцию основного белка миелина оценивали с помощью КПЦР и IC из культур, обработанных либо T3, кветиапином, либо обоими. Как показано на фиг.1а , наблюдалось значительное увеличение экспрессии гена MBP с любым агентом, отдельно и при тестировании в комбинации (в каждом случае р <0,001). В сочетании их влияние на экспрессию MBP было аддитивным. Эти эффекты не наблюдаются на более ранних этапах эксперимента ( рис. S1). Чтобы определить, что эффекты кветиапина не были вызваны небольшим количеством Т3, обнаруженным в добавке к среде В27, специфические компоненты среды были добавлены отдельно вместо добавки В27, результаты этих экспериментов показали, что кветиапин индуцирует Дифференцирование OPC даже при отсутствии T3 ( фиг.2A S2a ). Небольшое количество T3 в коммерческой добавке B27 действительно приводило к более высокой экспрессии MBP, чем в домашних средах без T3 ( рис. S2b ), что достигало значимости в некоторых, но не во всех сравнениях. Затем мы оценили влияние T3 и кветиапина на поверхностную экспрессию MBP с использованием IC ( Рис. 1b ). Как показано на рисунке 1свсе клетки показали характерную морфологию OL и имеют экспрессию MBP, но клетки, обработанные кветиапином, имеют ореол круглой формы, окружающий ядра (нижние панели), тогда как клетки, обработанные только T3 (верхняя правая панель), по-видимому, имеют более длинные и более разветвленные проекции. Хотя каждый агент приводил к увеличению экспрессии MBP, комбинация была аддитивной ( фиг.1d ). Для дальнейшей количественной оценки экспрессии белка мы собрали лизаты из культур и сделали вестерн-блот для MBP. Они показали увеличение синтеза MBP каждого отдельного соединения и аддитивный эффект комбинации Т3 и кветиапина ( фиг.1е и 1f ).
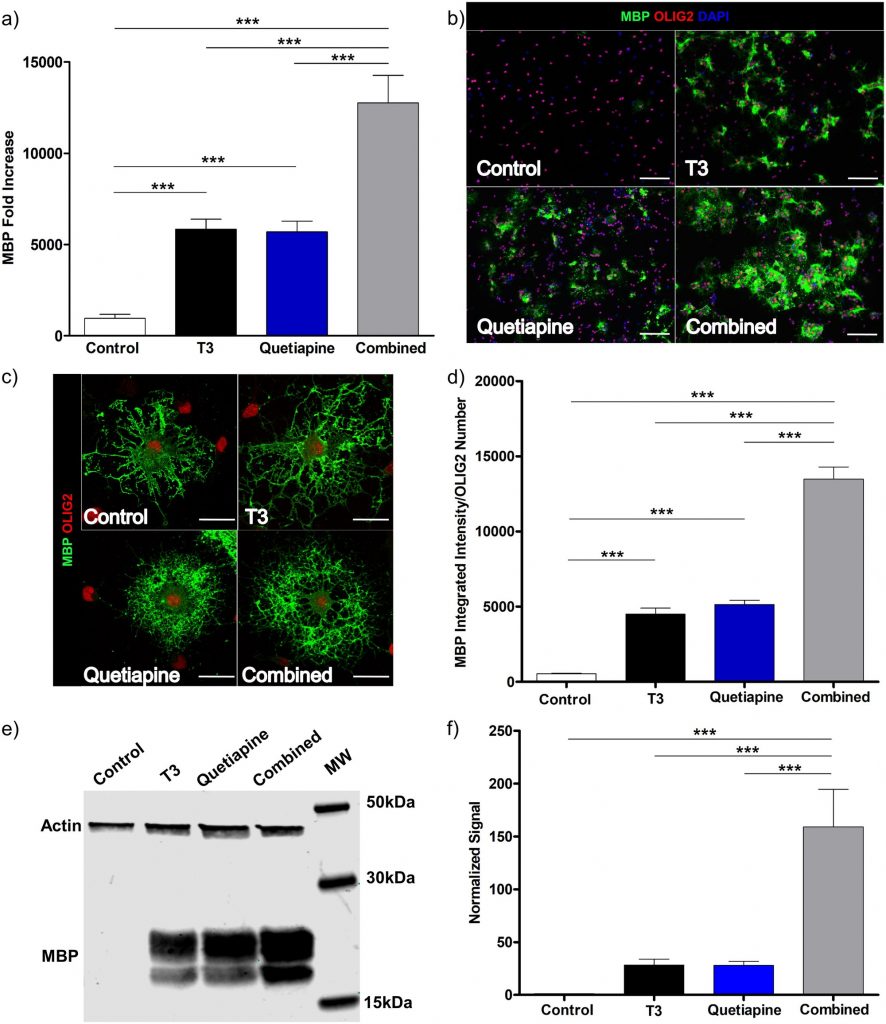
Рис. 1. Кветиапин индуцирует дифференцировку OPC и оказывает аддитивное влияние на дифференцировку, индуцированную T3.
OPC, выделенные от 4-7-дневных крыс, культивировали в течение 96 часов в условиях PDGF 20 нг / мл, затем индуцировали дифференцировку в среде OPC с добавлением T3 45 нМ (черный), кветиапина 1 мкМ (синий) или обоих (серый) для 96 часов В качестве контроля использовали среду OPC с 0,1% ДМСО (наполнитель) (белый). (а) Экспрессию MBP измеряли с помощью КПЦР. Образец до обработки в день 0 использовали для нормализации результатов генов. Столбики ошибок представляют стандартную ошибку среднего из 3 независимых выделений и экспериментов. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (p ** <0,001, *** p <0,0001). (б)Иммуноцитохимия: покрытые клетки фиксировали 4% PFA, окрашивали на MBP (зеленый), Olig2 (красный) и DAPI (синий). Репрезентативные изображения в 20X, для контроля (вверху слева), T3 (вверху справа), кветиапина (внизу слева), T3 плюс кветиапина (внизу справа), масштабная линейка 100 мкм. (c) Изображения конфокальной микроскопии с помощью лазерного сканирования 63Х контроля (вверху слева), Т3 (вверху справа), кветиапина (внизу слева), Т3 плюс кветиапина (внизу справа), масштабная линейка 20 мкм. (d) Было определено соотношение между количественным определением интенсивности MBP и положительным числом ячеек OLIG2, гистограмма представляет результаты 6 различных экспериментов, а столбцы ошибок являются стандартной ошибкой среднего значения. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** р <0,0001). (д)Белковый лизат из культуры OPC получали через 4 дня обработки в условиях, упомянутых выше, и проводили вестерн-блоттинг, (e) репрезентативное изображение и (f) результаты количественного определения из 6 различных экспериментов, односторонний анализ ANOVA с множественным сравнительным анализом Tukey. был запущен (*** р <0,0001).
Кветиапин индуцирует экспрессию генов пути биосинтеза холестерина с и без T3
Чтобы определить сигнальные пути, через которые каждый из этих агентов опосредовал свои индивидуальные эффекты, мы провели набор генов для идентификации дифференциально модулированных генов. Для достижения этого (как видно на рис. 1 ) были созданы культуры OPC, обработанные либо Т3, кветиапином, либо и тем, и другим, и были проанализированы дифференциальные паттерны экспрессии генов. Интересно, что имелись четкие закономерности влияния повышающей регуляции и понижающей регуляции на экспрессию генов агентами, как показано на диаграммах Венна ( фиг. 2a и 2b ). Эти различные закономерности дополнительно проиллюстрированы на тепловой карте, показывающей, что верхние гены дифференциально активированы обоими соединениями ( рис. 2в ). Полный список генов, значительно повышенных с помощью T3 ( таблица S1 ), кветиапина (S2 Table ) или комбинированная терапия ( S3 Table ) на 48 и 96 часах. Далее, подтверждая наши выводы, некоторые гены, которые ранее были обнаружены с положительной регуляцией T3 (Klf9, Hr, Dbp и Nt5e), также активируются с помощью T3 в наших данных [ 17 ].
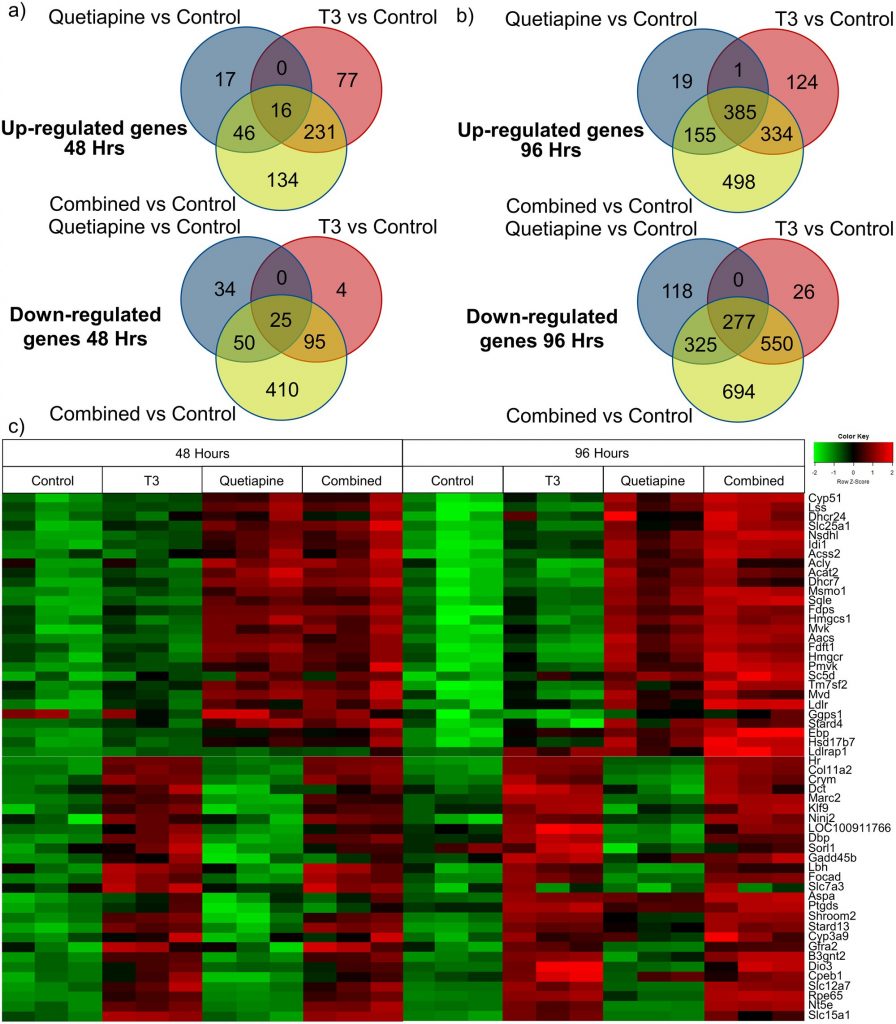
Рис. 2. Матрица экспрессии генов, демонстрирующая паттерны дифференциально регулируемых генов в OPC, обработанных либо T3, либо кветиапином на 48 и 96 часах культивирования.
Генную матрицу Affymetrix проводили на OPC, обработанных; T3 45 нМ, кветиапин 1 мкМ, оба, или контроль транспортного средства в течение 48 часов и 96 часов. Результаты были нормализованы для образцов до обработки в день 0. Диаграммы Венна, показывающие количество активированных (вверху) и пониженных (внизу) генов через 48 часов (а) и 96 часов (б) для условий Т3, кветиапина и Т3 плюс кветиапин по сравнению с контрольным состоянием. Значимость определяли как кратное изменение> 1,5 и вероятность ложного обнаружения <0,05. (c) Тепловая карта, показывающая закономерности генов через 48 часов и 96 часов с повышением активности кветиапина (верхняя половина) и Т3 (нижняя половина).
Чтобы определить сигнальные пути, индуцированные кветиапином, мы провели анализ обогащения набора генов (GSEA), который показывает, что наборы генов пути синтеза холестерина активированы на образцах, обработанных кветиапином, по сравнению с Т3 ( рис. 3а ). Соответственно, в этих наборах генов мы обнаружили, что гены, участвующие в последовательных этапах пути синтеза холестерина, были усилены ( Fig 3b и 3c ), такие как hmgcs1 , hmgcr , fdft1 , sqle, cyp51 с помощью анализа КПЦР. Это увеличение, по-видимому, более полно опосредовано кветиапином, потому что каждый из этих генов был значительно повышен в регуляции только кветиапина и его комбинации, но не только в условиях Т3. Это также подтвердило результаты генного чипа Affymetrix, которые показывают общее увеличение экспрессии генов на каждом этапе пути синтеза холестерина. Анализ меток пути выявил мишени E2F и наборы генов контрольных точек G2M, которые также модулируются каждым соединением индивидуально, а также комбинацией T3 и кветиапина ( таблица S4 ).
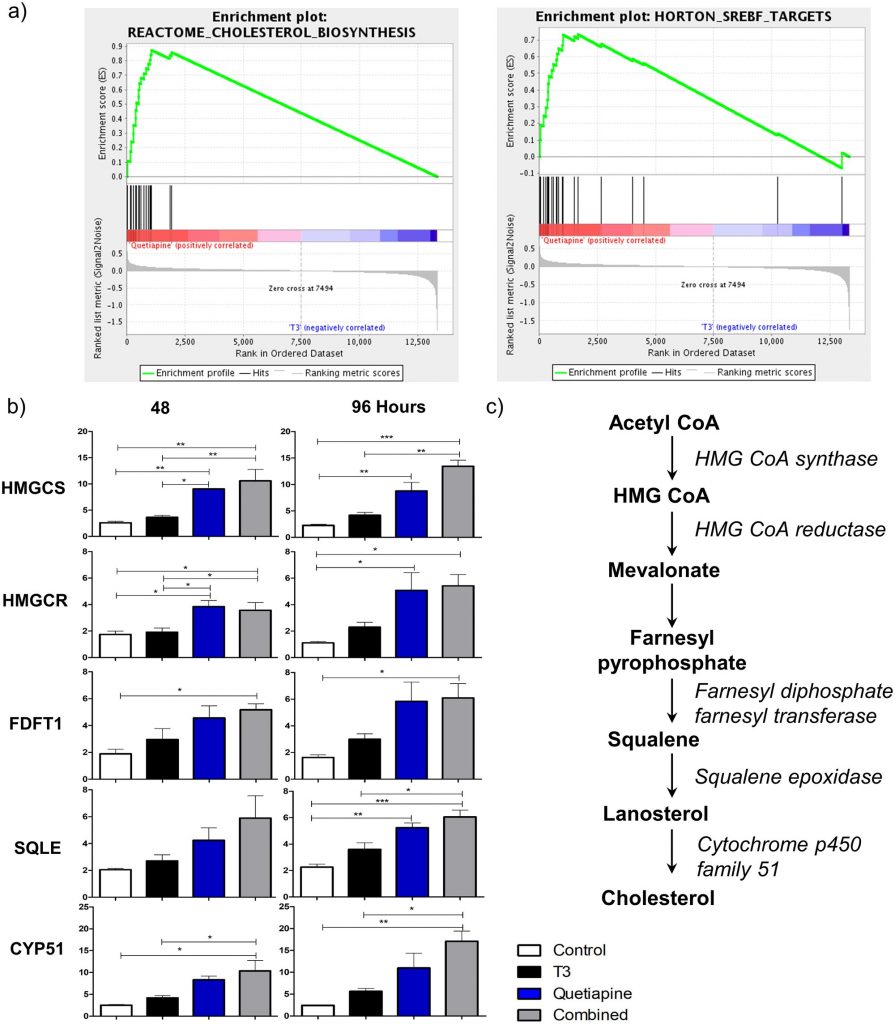
Рис. 3. Анализы обогащения набора генов и КПЦР показывают, что гены биосинтеза холестерина сильнее индуцируются кветиапином, чем Т3.
(а) Графики обогащения для наборов генов пути холестерина, которые были дифференциально активированы кветиапином по сравнению с Т3. (b) КПЦР для hmgcs1 , hmgcr , fdft1 , sqle и cyp51 выполняли с использованием РНК, выделенной из OPC, индуцированных для дифференцировки в средах OPC, с добавлением T3 45 нМ (черный), кветиапина 1 мкМ (синий) или обоих (серый) в 48 и 96 часов В качестве контроля использовали среду OPC с 0,1% ДМСО (белый). Образец до обработки в день 0 использовали для нормализации результатов генов. Столбики ошибок представляют стандартную ошибку среднего из 3 независимых выделений и экспериментов. (* р <0,01, ** р <0,001, *** р <0,0001). (с)Схематическое представление пути синтеза холестерина, промежуточные продукты представлены жирным шрифтом, ферменты, участвующие в курсиве.
Чтобы подтвердить, что экспрессия генов холестерина была связана с увеличением содержания холестерина в клетках, проводили окрашивание на холестерин. Он показал увеличение холестерина в OPCs, обработанных T3 и кветиапином, и аддитивный эффект с обоими соединениями ( Fig 4 ).
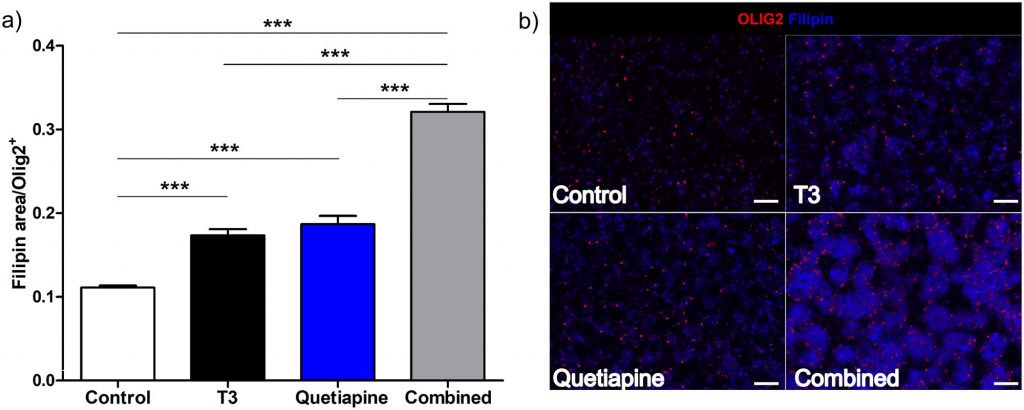
Рис. 4. Т3 и кветиапин индуцируют выработку холестерина.
OPC, выделенные от 4-7-дневных крыс и культивированные в течение 96 часов в условиях PDGF 20 нг / мл, затем индуцировали для дифференцировки в среде OPC с добавлением T3 45 нМ (черный), кветиапина 1 мкМ (синий) или обоих (серый) для 96 часов В качестве контроля использовали среду OPC с 0,1% ДМСО (наполнитель) (белый). (а) Клетки фиксировали 4% PFA, затем окрашивали на олиг2 и филипин. Было определено соотношение между окрашенной филипином площадью и положительным числом клеток OLIG2, гистограмма представляет результаты 6 различных экспериментов, а столбцы ошибок — стандартная ошибка среднего. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** р <0,0001). (б) Репрезентативные изображения в 20X, для контроля (вверху слева), T3 (вверху справа), кветиапина (внизу слева), T3 плюс кветиапина (внизу справа), масштабная линейка 200 мкм.
Ингибиторы продукции холестерина бетулин и симвастатин подавляют экспрессию генов MBP и продукцию белка, не влияя на жизнеспособность клеток
Для дальнейшего изучения специфической роли синтеза холестерина мы проверили влияние ингибитора синтеза холестерина бетулина на экспрессию MBP. Бетулин ингибирует синтез холестерина на первом этапе его биосинтеза, препятствуя активации белка, связывающего регуляторный элемент стерола (SREBP) [ 39 ]. Культуры генерировали, как описано выше, с добавлением Т3, кветиапина или обоих, с бетулином или без него в различных концентрациях, и количественно определяли экспрессию гена MBP ( фиг.5а ). Во всех случаях бетулин эффективно отключал экспрессию гена MBP. Иммуноокрашивание для MBP показало сходные результаты ( фиг.5b и 5c), Производство MBP практически исключено, что снова подтверждает утверждение о том, что дифференцировка была остановлена из-за нарушения синтеза холестерина, а не из-за гибели клеток, как описано ниже ( S3 Fig ).
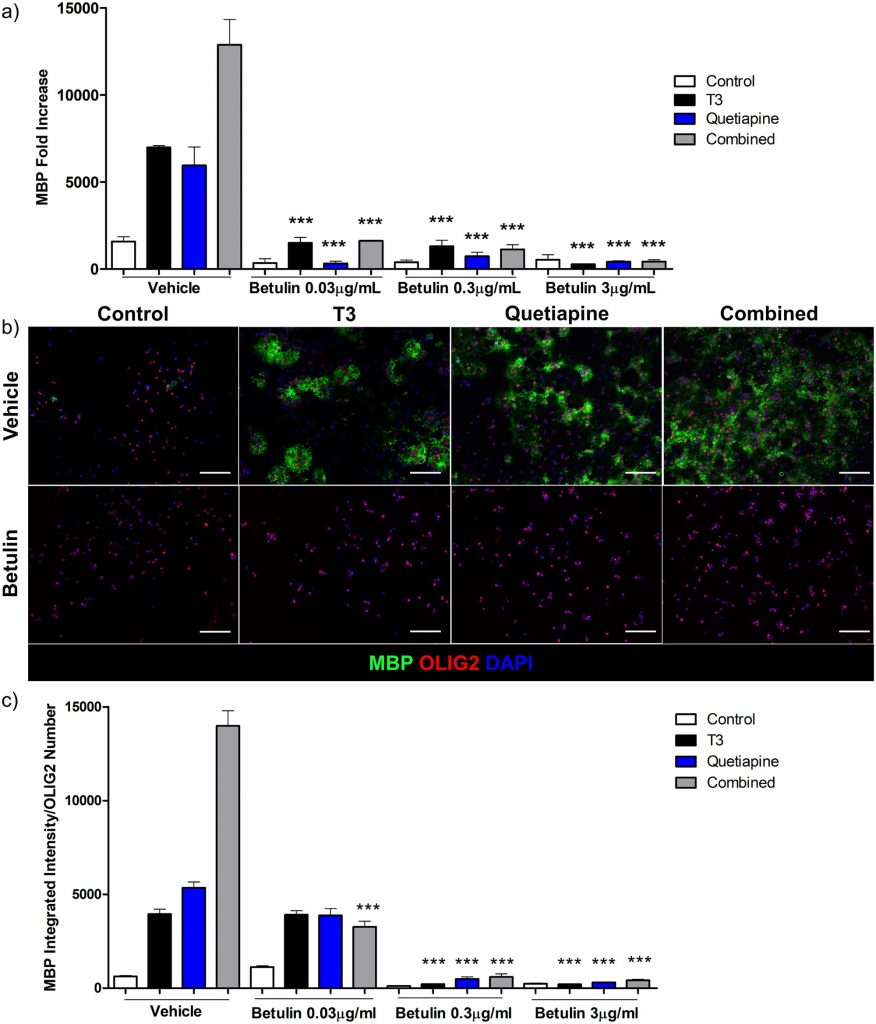
Рис. 5. Ингибитор синтеза холестерина бетулин подавляет экспрессию гена OPC и белка MBP.
(а) КПЦР для MBP проводили с использованием РНК, выделенной из OPC, обработанных T3 45 нМ (черный), кветиапином 1 мкМ (синий) или обоими (серый) в течение 96 часов, или средой OPC с 0,1% ДМСО (белый), в присутствии различных дозы бетулина 0,03, 0,3 и 3 мкг / мл в то же время. Образец до обработки в день 0 использовали для нормализации результатов генов. Столбики ошибок представляют стандартную ошибку среднего из 3 независимых выделений и экспериментов. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** p <0,0001 для условий, обработанных бетулином, по сравнению с тем же состоянием без бетулина, например, T3 с бетулином 3 мкг / мл по сравнению с носителем T3). (b) Иммуноцитохимия для MBP (зеленый), Olig2 (красный) и DAPI (синий) из OPC, дифференцированных с носителем (верхний ряд) и бетулином 3 мкг / мл (нижний ряд). (с)Было определено соотношение между количественным определением интенсивности MBP и положительным числом клеток OLIG2 из 3 экспериментов с OPC, обработанными T3 45 нМ (черный), кветиапином 1 мкМ (синий) или обоими (серый) в течение 96 часов или средой OPC с 0,1% ДМСО (белый) ), в присутствии разных доз бетулина 0,03, 0,3 и 3 мкг / мл в течение одного и того же времени. Столбики ошибок представляют стандартную ошибку среднего. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** p ≤ 0,0001 для условий, обработанных бетулином, по сравнению с тем же состоянием без бетулина).
Аналогично, симвастатин, который ингибирует биосинтез холестерина ниже по потоку от SREBP путем блокирования HMG-CoA-редуктазы [ 40 ], затем биосинтеза холестерина, также снижает экспрессию генов MBP ( фиг. 6a ) и уровни белка ( фиг. 6b и 6c ) в OPC, но только при самой высокой концентрации. изучал.
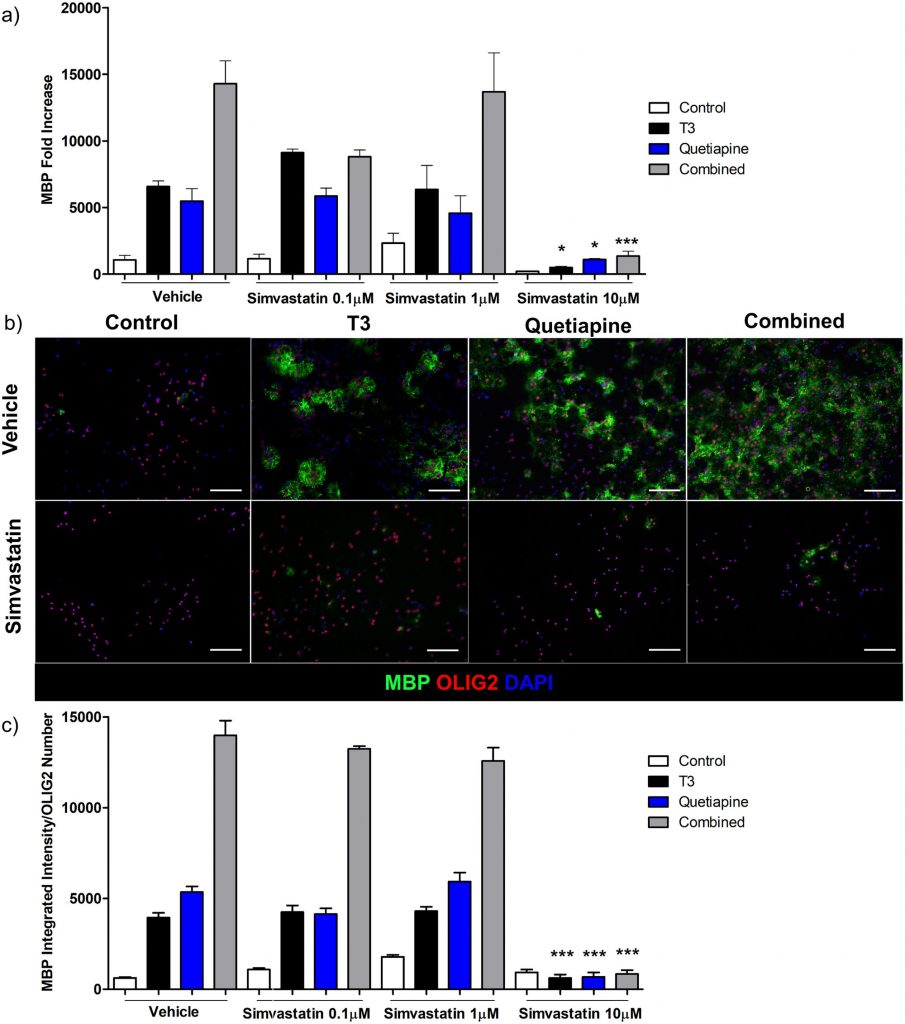
Рис 6. Ингибитор синтеза холестерина симвастатин подавляет экспрессию гена OPC и белка MBP.
(а) КПЦР для MBP проводили с использованием РНК, выделенной из OPC, обработанных T3 45 нМ (черный), кветиапином 1 мкМ (синий) или обоими (серый) в течение 96 часов или средой OPC с 0,1% ДМСО (белый), в присутствии различных дозы симвастатина 0,1, 1 и 10 мкМ в то же время. Образец до обработки в день 0 использовали для нормализации результатов генов. Столбики ошибок представляют стандартную ошибку среднего из 3 независимых выделений и экспериментов. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** p <0,0001 для условий лечения симвастатином по сравнению с тем же состоянием без симвастатина, например, T3 с симвастатином 10 мкМ по сравнению с носителем T3). (b) Иммуноцитохимия для MBP (зеленый), Olig2 (красный) и DAPI (синий) из OPC, дифференцированных с носителем (верхний ряд, такие же репрезентативные изображения, как на рисунке 5b).) и симвастатин 10 мкМ (нижний ряд). (c) Было определено соотношение между количественным определением интенсивности MBP и положительным числом клеток OLIG2, из 3 экспериментов с носителем (те же данные о состоянии носителя, что и на 5c, поскольку эти эксперименты проводились одновременно) и OPC, обработанных T3 45 нМ (черный), Кветиапин 1 мкМ (синий) или оба (серый) в течение 96 часов или OPC-среда с 0,1% ДМСО (белый) в присутствии разных доз симвастатина 0,1, 1 и 10 мкМ в течение одного и того же времени. Столбики ошибок представляют стандартную ошибку среднего. Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** p <0,0001 для условий лечения симвастатином по сравнению с тем же состоянием без симвастатина).
В дополнение к окрашиванию DAPI, указывающему на то, что клетки все еще присутствовали, мы как перечислили OLIG2-положительные и DAPI-положительные клетки, так и измерили выживаемость клеток в продольном направлении, используя IncuCyte, чтобы убедиться, что ингибирующие эффекты не были результатом токсичности бетулина или симвастатина ( S3 и S4 Fig. ). Ни бетулин, ни симвастатин не привели к значительной гибели клеток или сдвигу в соотношениях клеток OLIG2 + / DAPI + в культурах при самых высоких дозах бетулина и симвастатина, что свидетельствует о том, что ингибирование является результатом нацеливания на специфический путь [ 39 ], а не известная способность бетулина индуцировать апоптоз при более высоких концентрациях [ 41]. Эти данные также подтверждают критическую роль биосинтеза холестерина в экспрессии и продукции генов MBP в процессе дифференцировки OPC.
обсуждение
Идентификация сигнальных путей , участвующих в дифференцировке OPC, который может облегчить миелина ремонт, стал центром обоих биологических исследований и разработки терапии [ 6 , 7 , 15 — 18 , 25 — 27 , 30]. По мере того как становится яснее, что регенерация миелина является вероятной стратегией для демиелинизирующих заболеваний, лучшее понимание механизмов, с помощью которых OPCs можно дифференцировать в зрелые, миелин-продуцирующие OL, будет иметь решающее значение для рационального развития новых методов лечения. В частности, прогрессирующая форма рассеянного склероза страдает от недостатка лечения и остается практически не улучшенной иммунотерапией. Таким образом, акцент на разработке новых подходов к нацеливанию нейропротективных / регенеративных возможностей клеток ЦНС имеет решающее значение для продвижения лечения.
Хотя неясно, как инициируется повреждение аксонов, нейронов и ПР и в некоторых случаях поддерживается, потенциал восстановления после повреждения кажется многообещающим, особенно на ранних стадиях, когда аксоны все еще могут быть неповрежденными и поддаются ремиелинизации. Наличие OPCs и многочисленные исследования, указывающие на то, что их можно мобилизовать и дифференцировать даже у взрослых, подчеркивают эту возможность, поскольку элементы, необходимые для восстановления, могут быть уже на месте [ 1 , 8 — 11 ]. Растет число сообщений, демонстрирующих, что на животных моделях после демиелинизации OPCs расширяются, мобилизуются и дифференцируются, а также демонстрируется ремиелинизация аксонов, что указывает на восстановление миелинового повреждения [ 11 , 32 ,33 ]. Таким образом, потенциал для этого процесса, чтобы произвести заметный биологический эффект, высок.
Т3 — хорошо изученный агент, который, как известно, вызывает дифференциацию OPC. Благодаря своим мощным эффектам он стал стандартным компонентом культуры ОЛ [ 17 , 18 , 26 , 30 , 42 , 43 ]. В дополнение к его эффектам in vitro было показано, что он обладает положительным эффектом in vivo, что подтверждается его способностью стимулировать миелинизацию развития, опосредованную OPCs [ 43 ], и смягчать опосредованную купризоном демиелинизацию [ 42].]. В дополнение к подтверждению известных сигнальных путей, усиленных T3, таких как KLF9, мы сообщаем о дополнительных генах, некоторые из которых, по-видимому, работают совместно с другими пролодифференцирующими лекарственными средствами, такими как кветиапин. Эти результаты дополняют понимание механизмов, с помощью которых T3 оказывает свое критическое воздействие на OPC.
Кветиапин является интригующим средством, которое, как было показано, обладает несколькими возможными терапевтическими эффектами в контексте MS / EAE. Было показано, что атипичный антипсихотик подавляет аутоиммунитет, удаляет свободные радикалы, ингибирует воспалительные эффекты микроглии [ 44 , 45 ] и астроцитов, а также защищает гематоэнцефалический барьер после травмы [ 46 ]. Таким образом, он имеет привлекательность в качестве возможного терапевтического средства, поскольку уже имеет лицензию на использование в качестве антипсихотического средства. В дополнение к этим известным эффектам, данные свидетельствуют о том, что он может оказывать определенное влияние на липидные профили, что привело нас к гипотезе о том, что он может специфически регулировать синтез холестерина [ 47 ], который необходим для образования миелина [ 20].], как было показано с другими атипичными антипсихотическими препаратами [ 48 ].
Биосинтез холестерина является сложным процессом, который жестко регулируется у млекопитающих. В многостадийном процессе изопентенилпирофосфат образуется в мевалонатном пути с последующим образованием сквалена в результате конденсации шести молекул изопентенилпирофосфата, который затем подвергается циклической реакции, приводящей к превращению, в результате которого образуется холестерин. Здесь мы покажем , что несколько ферментов , важных для катализировать процесс, а именно hmgcs1 , HMGCR , fdft1 , cyp51 , и sqle, индуцируются только T3 и кветиапином или кветиапином. В сочетании лечение оказывает аддитивное влияние на их экспрессию. Чтобы продемонстрировать функциональную значимость, мы стремились специфически блокировать процесс синтеза холестерина, чтобы проверить, будут ли потеряны эффекты дифференцировки Т3 и кветиапина. С этой целью мы использовали соединение бетулин, которое является ингибитором процессинга белков, связывающих регуляторные элементы стеролов (SREBP), семейство транскрипционных факторов, которые регулируют выработку холестерина, липидов и жирных кислот. SREBPs играют важную роль в гомеостазе производства холестерина, и нарушение их функции оказывает глубокое влияние на синтез холестерина [ 49].]. Мы обнаружили, что добавление бетулина отменяет стимулирующие эффекты Т3 и кветиапина, как по отдельности, так и в комбинации, что продемонстрировало, что синтез холестерина имеет решающее значение для индукции экспрессии MBP обоими этими агентами.
Предыдущие исследования статинов показали мощные противовоспалительные эффекты HMG-CoA редуктазы с помощью истощения изопреноидов (фарнезили-пирофосфат и геранилгеранильный-пирофосфат) , а не холестерин в иммунных клетках [ 40 , 50 — 57 ]. Тем не менее, было отмечено, что его влияние на миелинизацию является переменным, причем в некоторых исследованиях предполагалось ингибирующее действие, а в других — отсутствие эффекта или даже положительное влияние на OPCs через ингибирование Rho [ 24 , 58 ]. Наши данные согласуются с представлением о том, что высокие дозы статинов потенциально ограничивают синтез холестерина и выработку миелина в клетках линии OL [ 23 , 24 , 59], но низкие дозы могут по-прежнему оказывать благотворное влияние на воспаление и другие пути без снижения уровня холестерина до такой степени, что клетки линии OL больше не могут экспрессировать и продуцировать MBP.
В то время как наше исследование согласуется с предыдущими сообщениями о важности сигнального пути биосинтеза холестерина в ПР дифференциации родословная клеток [ 20 — 23 , 27 ], остается неясным , как это липид имеет решающее значение для экспрессии гена МВР и не образование только вниз по течению миелина, который на 70% липидный. Синтез изопреноидов, которые важны для изопренилирования определенных сигнальных белков клеток и роста клеток, играет роль в дифференцировке линии OL, и блокирование этого этапа также может нарушать образование миелина [ 22]. Кроме того, мы заметили изменение морфологии клеток, обработанных кветиапином, для которых характерно появление ореола вокруг ядер, что можно объяснить сферическим накоплением холестерина вокруг ядер, но для полного понимания этого явления потребуется дальнейшее исследование транспорта холестерина.
Стоит отметить, что синтез холестерина также участвует в выработке витамина D, желчных кислот и гормонов, которые могут быть снижены у людей с РС [ 60 — 69 ]. Следовательно, исследования, направленные на понимание наличия внутренних дефектов или ингибиторов пути биосинтеза холестерина, могут быть полезными. Кроме того, учитывая недавние данные о том, что статины оказывают противовоспалительное действие как на периферии, так и на ЦНС, и, таким образом, могут ингибировать атрофию головного мозга при прогрессирующем РС [ 70 ], очень важно понять, могут ли длительные высокие концентрации статинов ингибировать восстановление миелина путем снижение уровня холестерина в клетках линии OL.
Мы отмечаем, что наше исследование в некоторых отношениях отличается от двух других сообщений, посвященных изучению влияния кветиапина на клетки-линии олигодендроцитов [ 71 , 72 ]. Fang et al. показал индукцию Olig1 / 2 кветиапином. Они использовали клеточную линию CG4, которая экспрессирует Olig1 / 2 при дифференцировке. Наши свежеизолированные первичные OPCs уже экспрессировали Olig 1/2, что позволяет предположить, что они совершены по линии происхождения, и, следовательно, может не потребоваться дополнительная активация этих транскрипционных факторов, чтобы дифференцироваться в олигодендроциты, экспрессирующие MBP. Кондо и соавт. провели анализ экспрессии гена ex vivo РНК лобной коры от животных, получавших кветиапин против носителя, и обнаружили подавление Cdkn 1a. Хотя мы не видели подавления Cdkn1a в нашем массиве, другие члены семейства Cdkn были подавлены (см.Таблица S3 ), и это расхождение может относиться к срокам отбора проб, а также к различному воздействию лекарств in vivo .
Другим потенциальным ограничением нашего исследования является то, что некоторые эффекты T3 отдельно или комбинированной терапии могли быть замаскированы низкими уровнями T3, обнаруженными в коммерческой добавке B27, которую мы использовали. Тем не менее, мы смогли продемонстрировать, что канонические гены T3, о которых сообщают другие, были индуцированы коммерческой средой B27 плюс T3 по сравнению с одной средой. Что наиболее важно, кветиапин все еще имел те же пролодифференцирующие эффекты на OPC, даже когда его использовали с домашним B27, за исключением T3, что подтверждает независимую роль этого соединения в обеспечении дифференцировки OPC через путь биосинтеза холестерина.
Таким образом, это исследование сообщает о новом открытии, что кветиапин модулирует путь биосинтеза холестерина аддитивным способом с T3, усиливая эффекты на дифференцировку OPC и продукцию миелина. Взятые вместе, эти результаты позволяют предположить, что комбинаторные подходы к индукции дифференцировки OPC могут быть полезны. Дальнейшее понимание сигнальных сигналов, необходимых для содействия восстановлению миелина, а также тех существующих факторов, которые ингибируют дифференцировку OPC, будет иметь решающее значение для перевода этих наблюдений в клинические условия.
Вспомогательная информация
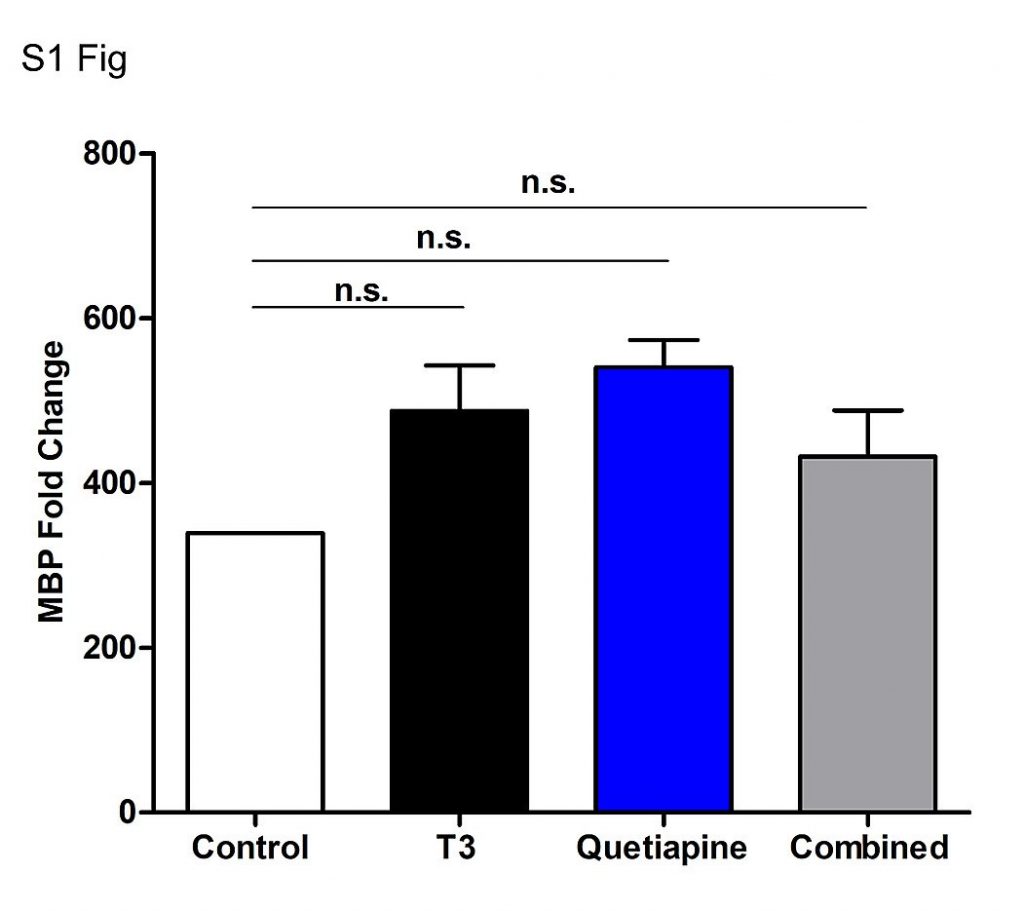
В качестве контроля использовали среду OPC с 0,1% ДМСО (наполнитель) (белый).
Экспрессию MBP измеряли с помощью КПЦР.
Образец до обработки в день 0 использовали для нормализации результатов генов.
Столбики ошибок представляют стандартную ошибку среднего из 3 независимых выделений и экспериментов.
Был проведен односторонний анализ ANOVA с многократным сравнительным анализом Тьюки (не значимым).
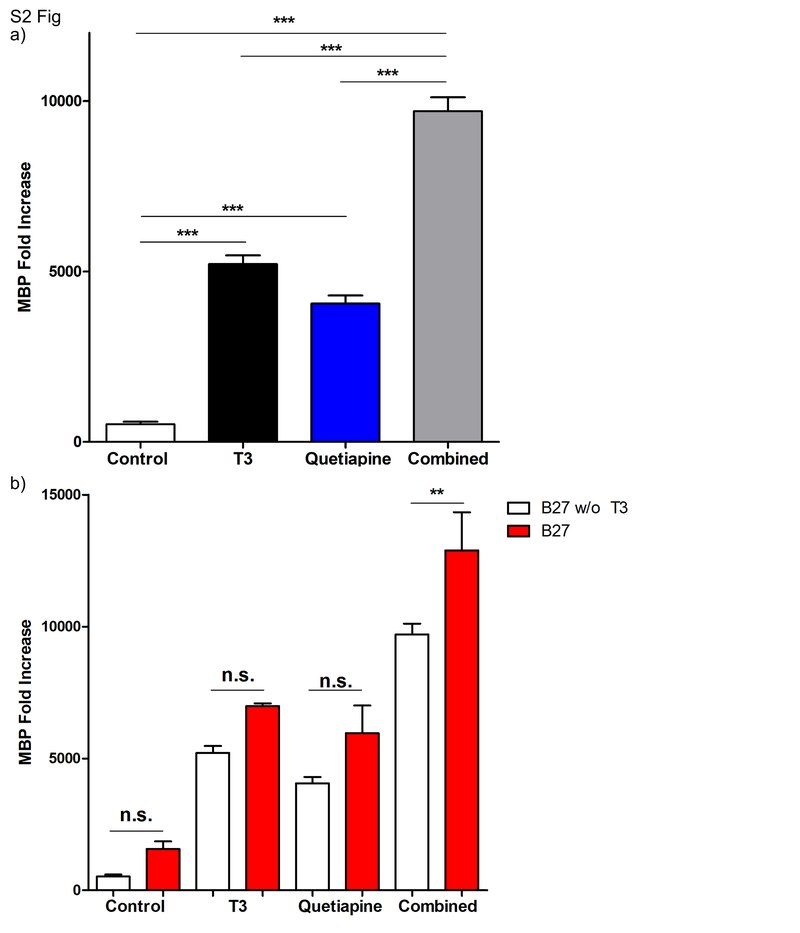
OPC, выделенные от 4-7-дневных крыс, культивировали в течение 96 часов с PDGF 20 нг / мл в среде OPC, приготовленной со всеми компонентами B27, кроме T3.
(
а ) Через 96 часов в среду добавляли либо Т3, 45 нМ (черный), кветиапин 1 мкМ (синий) или оба (серый) в течение дополнительных 96 часов.
В качестве контроля использовали среду OPC с 0,1% ДМСО (наполнитель) (белый).
Экспрессию MBP измеряли с помощью КПЦР.
Образец до обработки в день 0 использовали для нормализации результатов генов.
Столбики ошибок представляют стандартную ошибку среднего из 2 независимых выделений и экспериментов.
Был проведен односторонний анализ ANOVA с множественным сравнительным анализом Тьюки (*** р <0,0001).
(
б ) Сравнение между OPC, обработанными в среде с добавкой B27 (красный) (как на
рисунке 1a)) или со всеми компонентами B27, кроме T3 (белый) (как на рис. S2a).
Экспрессию MBP измеряли с помощью КПЦР.
Образец до обработки в день 0 использовали для нормализации результатов генов.
Значимость определяли с использованием одностороннего анализа ANOVA с множественным сравнительным анализом Тьюки (не значимым, ** р <0,001).
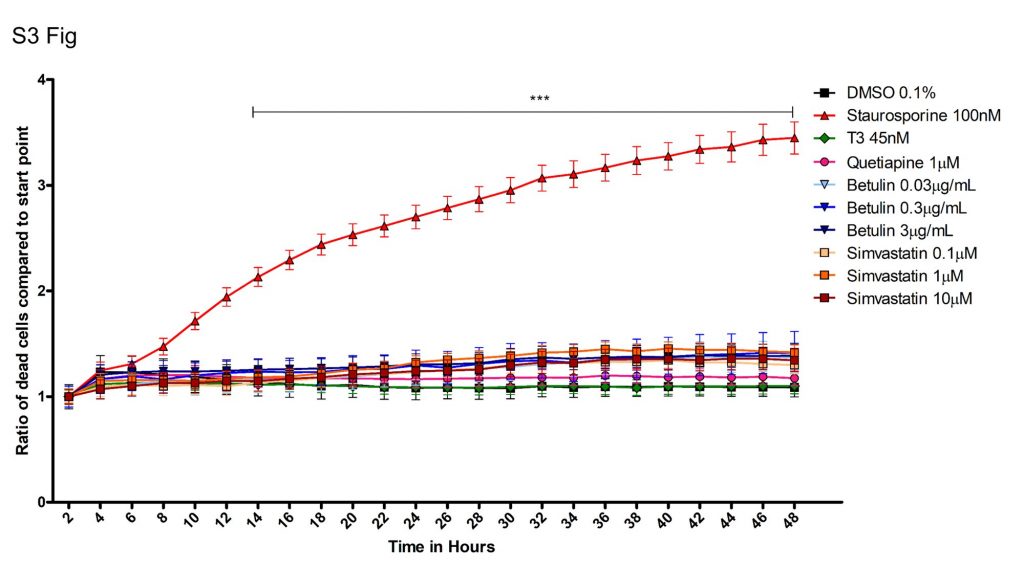
Анализ клеточной токсичности каждого соединения проводили на культивируемых OPC в присутствии IncuCyte Cytotox Green Reagent.
(а) Было рассчитано отношение количества мертвых клеток в каждый момент времени к количеству мертвых клеток в начале эксперимента.
Столбики ошибок представляют стандартную ошибку среднего.
Был проведен двухсторонний анализ ANOVA с последующими тестами Тьюки (*** р <0,0001 для стауспорина по сравнению с ДМСО носителя 0,1%).
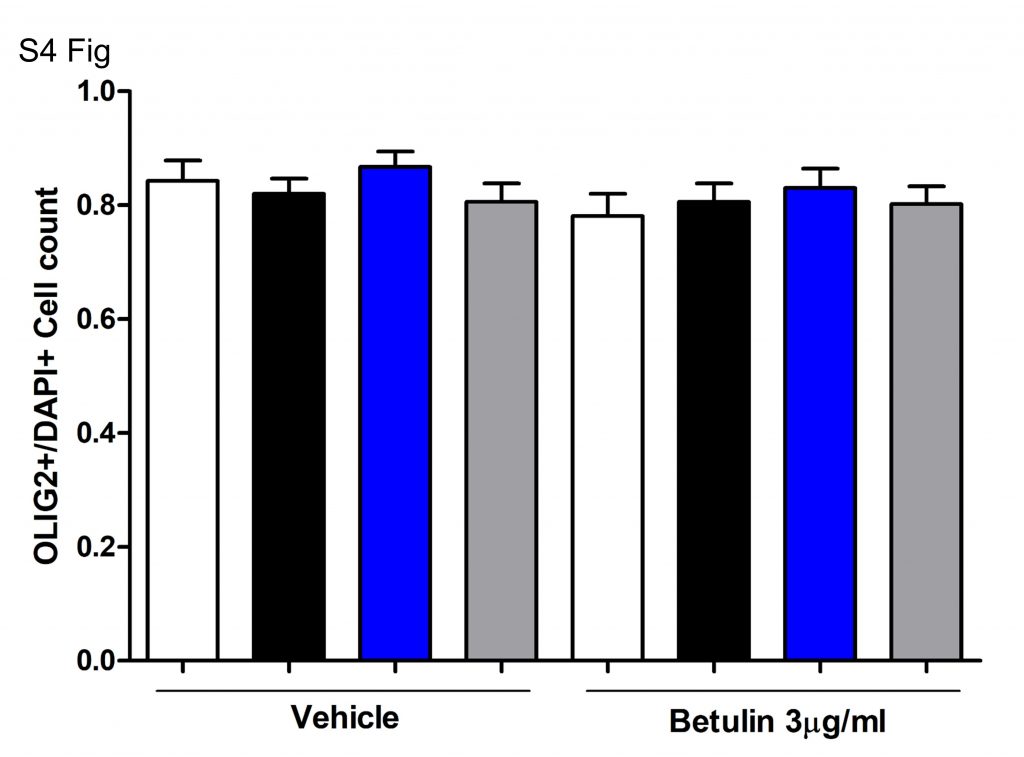
Были подсчитаны положительные по OLIG2 и DAPI клетки, и показано соотношение для каждого условия: T3 45 нМ (черный), кветиапин 1 мкМ (синий) или оба (серый) в течение 96 часов.
OPC носитель с 0,1% ДМСО (носитель) использовали в качестве контроля (белый) в присутствии или в отсутствие бетулина 3 мкг / мл.
Столбики ошибок представляют стандартную ошибку среднего.
Односторонний анализ ANOVA не показал значительной разницы.
S1 Табл. Генный массив T3 регулируется генами.
(XLSX)
S2 Табл. Генный массив кветиапина регулируется генами.
(XLSX)
S3 Табл. Массив генов T3 плюс кветиапин-регулируемые гены.
(XLSX)
S4 Табл. Отличительными признаками путей, регулируемых Т3, кветиапином или их комбинацией.
(XLSX)
Подтверждения
Авторы хотят поблагодарить Хейли Дж. Страсбургер за техническую поддержку и ядро многофотонной визуализации в отделе нейронауки Университета Джона Хопкинса за сотрудничество с использованием микроскопа Кейенса.