Исследования показали, что введение трегалозы оказывает нейрозащитное действие на животных моделях. Когда вводили трегалозу, животные с нейродегенеративными заболеваниями жили дольше с уменьшенной невропатологией и облегченными поведенческими фенотипами. Эти исследования на животных также показали активацию аутофагии и уменьшение белковых агрегатов. Воспалительные реакции уменьшились, а глиоз уменьшился в ответ на трегалозу. Больше нейронов выжило в определенных областях мозга в моделях болезни.
Нейропротекторные свойства трегалозы упоминались в исследованиях на животных. Выращивание C. elegans в среде для выращивания, содержащей трегалозу, увеличивает продолжительность жизни. Мышиные модели с неврологическими дефектами частично оправились от своих поведенческих и нейробиологических дефектов. Пероральное введение трегалозы улучшило двигательную дисфункцию и увеличило продолжительность жизни трансгенных мышей (tg) модели болезни Хантингтона (HD). Супероксиддисмутаза 1 (SOD1) мутантные tg мыши имели значительно увеличенную продолжительность жизни и повышенное выживание нейронов при введении трегалозы. Паркин — / — / Тау VLWу мышей было показано значительное уменьшение фосфорилированных тау-положительных нейритных бляшек и астроглиоза в головном мозге.
В модели болезни Паркинсона (БП) мышей с 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (МРТР) трегалоза ингибировала снижение уровней дофамина в полосатом теле и предотвращала глиоз.
В клетках, однако, соединение аутофагии активации и уменьшение белковых агрегатов до трегалозов остаются спорные. Тщательный анализ потока аутофагии и белковых агрегатов показал, что, в отличие от предыдущей гипотезы, трегалоза вмешивается в поток аутофагии и увеличивает, а не уменьшает, уровни белковых агрегатов в культивируемых клетках. Эти результаты повышают вероятность того, что причина индукции аутофагии и совокупного клиренса в моделях нейродегенеративных заболеваний на животных не может быть связана с прямым действием трегалозы на нейроны. Нейропротекторное действие трегалозы у животных может быть косвенным.
Каков может быть механизм нейропротекции трегалозой? В отличие от прямого поглощения трегалозы в культуре, трегалоза, обработанная животным в питьевой воде, вероятно, будет гидролизоваться ферментом трегалоза в кишечнике. Даже если некоторое количество трегалозы попадает в кровоток, гематоэнцефалический барьер (ГЭБ) ограничивает доступ трегалозы к мозгу.
Одна из возможностей заключается в том, что эффекты трегалозы проявляются на уровне кишечника. Например, трегалоза может влиять на микробиоту кишечника. Трегалоза может защитить микробы от вредных стрессов и повысить выживаемость. За прошедшие годы накопилось все больше доказательств того, что микробиота кишечника оказывает широкое влияние на многие физиологические системы, включая центральную нервную систему, что повышает вероятность того, что трегалоза выполняет свои нейрозащитные функции через передачу сигналов микробиота-кишечник-мозг. В соответствии с этой гипотезой только пероральный прием трегалозы, а не внутрибрюшинная инъекция, эффективно индуцирует аутофагию в мозге мышей, указывая тем самым, что нейропротекторные эффекты трегалозы нуждаются в желудочно-кишечной (GI) системе.
С другой стороны, нельзя исключить возможность того, что трегалоза проходит через кровоток и попадает в мозг, оказывая свои нейропротекторные функции непосредственно нейронам. Имеются сообщения об обнаружении трегалозы в плазме крови и ее связи с диабетом. Он также обнаруживается в печени и почках, но функции трегалозы в этих органах до сих пор неизвестны. Недавнее исследование Martano et al. обнаружил трегалозу в мозге мышей, особенно в гиппокампе и коре головного мозга. Эндогенная трегалоза была обнаружена как в астроцитах, так и в нейронах, но гидролизующий фермент трегалоза был локализован только в нейронах. Астроциты смогли захватить и высвободить трегалозу во внеклеточное пространство. Однако источник трегалозы был неясен, поскольку ферменты, синтезирующие трегалозу, не присутствуют у позвоночных. Эти результаты повышают вероятность того, что трегалоза может перемещаться из кишечника в мозг через кровь или других носителей и действовать непосредственно на нейроны. Как только трегалоза достигает мозга, она может воздействовать непосредственно на нейроны и другие клетки, влияя на сворачивание белка, действовать как сигнальная молекула для активации стрессовых реакций или регулировать механизмы аутофагии и гибели клеток. Однако).
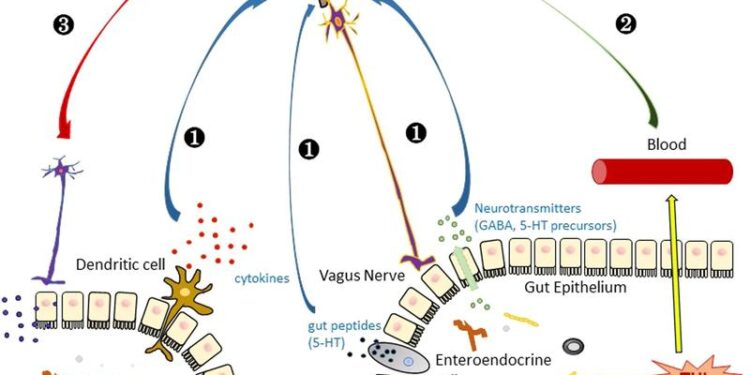
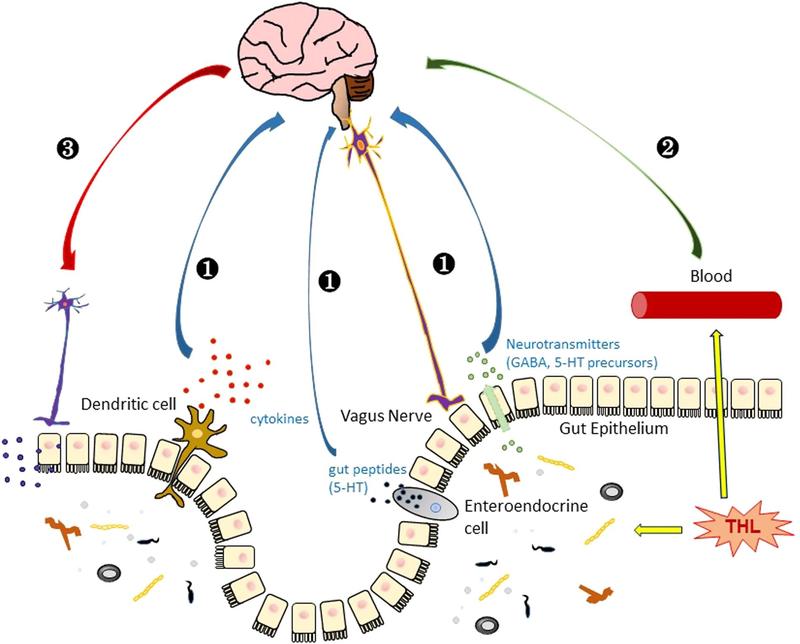
Схематическое изображение гипотезы о функции трегалозы в головном мозге.
(1) Трегалоза косвенно влияет на функцию мозга через регуляцию кишечных микробов, которые посылают сигналы в мозг путем активации дендритного иммунитета или секреции нейротрансмиттеров и кишечных пептидов, которые могут доставляться через блуждающий нерв в мозг. (2) Прямой транспорт трегалозы в мозг, который проходит через гематоэнцефалический барьер и влияет на нейрональные клетки. (3) Мозг посылает сигналы в кишечную систему, чтобы модулировать функцию трегалозы.
Вывод
Нейропротективные эффекты трегалозы были довольно последовательными на многих различных моделях нейродегенеративных заболеваний. Была выдвинута гипотеза, что трегалоза непосредственно действует на нейроны и вызывает аутофагию, тем самым способствуя очищению от белковых агрегатов. Однако тщательное изучение литературы подняло вопрос о том, может ли трегалоза напрямую вызывать аутофагический процесс. Недавняя статья, действительно, показала, что обработка нейрональных клеток трегалозой препятствует прогрессии аутофагосом в аутолизосомы. Кроме того, неясно, может ли трегалоза доставляться в паренхиму мозга при введении животным и в каком количестве. Мы предполагаем, что потребление трегалозы оказывает нейропротекторное действие на моделях нейродегенеративных заболеваний через прямой или косвенный механизм, который может включать микробиоту кишечника.
Перевод источник