Хотя точные причины рассеянного склероза все еще остаются неизвестными, предполагается что заболевание вызывается сочетанием генетических факторов и факторов риска окружающей среды. А какой? На мышиной модели заболевания исследователи из Женевского университета (UNIGE) и Женевских университетских больниц (HUG) Швейцария, изучали потенциальную связь между транзиторными церебральными вирусными инфекциями в раннем детстве и развитием этого церебрального аутоиммунного заболевания в более позднем возрасте. Действительно область мозга пораженная вирусной инфекцией в детском возрасте, претерпевает изменения которые могут через долгое время привести к тому, что иммунная система повернется против себя в этом точном месте, вызывая аутоиммунные поражения. Эти результаты которые публикуются в журнале Science Translational Medicine, предоставьте первый шаг к ответу на одну из возможных экологических причин этого серьезного заболевания.
Рассеянный склероз поражает одного из 1000 человек в Швейцарии, две трети из которых составляют женщины. Это наиболее распространенное аутоиммунное заболевание поражающее мозг. На сегодняшний день до сих пор нет ни лекарства ни четкого понимания факторов вызывающих это заболевание в возрасте около 30 лет. «Мы спрашивали себя были ли среди них возможные вирусные инфекции головного мозга, которые могли бы заболеть в раннем детстве», — говорит Дорон Мерклер, профессор кафедры патологии и иммунологии медицинского факультета UNIGE и старший консультант службы клинической патологии. Такие временные инфекции головного мозга могут быстро контролироваться иммунной системой, при этом пораженный человек даже не замечает никаких симптомов. «Но эти временные инфекции могут при определенных обстоятельствах оставить местный след.
Детство: поворотный момент влияющий на риск заболевания
Ученые индуцировали временную вирусную инфекцию в группе взрослых мышей и в группе мышей в очень молодом возрасте, чтобы проверить эту гипотезу. Карин Штейнбах, исследователь из того же отдела, объясняет: «В обоих случаях у мышей не было признаков заболевания, и они ликвидировали инфекцию в течение недели с аналогичным противовирусным иммунным ответом».
Затем ученые позволили двум группам мышей повзрослеть, прежде чем их перенесли с самореактивными клетками, которые могут воздействовать на нормальную структуру мозга и как полагают также способствуют заболеванию пациентов с рассеянным склерозом. «Эти самореактивные клетки присутствуют у большинства из нас, но они не обязательно вызывают заболевание так как они контролируются различными регуляторными механизмами и обычно не имеют доступа к мозгу», — объясняет Карин Штейнбах. Действительно в группе мышей инфицированных вирусом во взрослом возрасте перенесенные аутореактивные клетки не получили доступа к мозгу, и никаких повреждений мозга не наблюдалось. Однако у тех мышей, которые были инфицированы в очень молодом возрасте, аутореактивные клетки получили доступ к мозгу в зрелом возрасте, и мигрировали в точное место где ранее произошла инфекция. В результате самореактивные клетки начали атаковать структуру мозга в этих областях, что привело к развитию поражений головного мозга. Почему была такая разница в зависимости от возраста, в котором мыши перенесли предшествующую вирусную инфекцию?
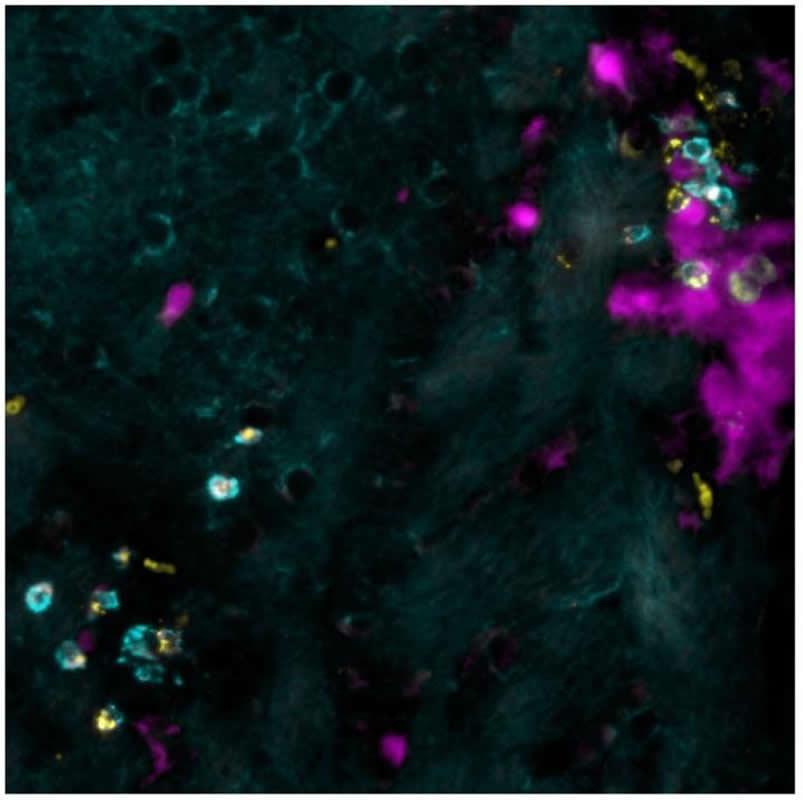
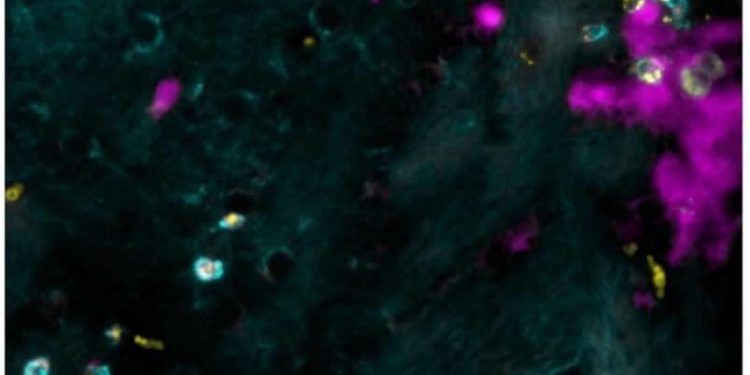
Накопление Т-клеток дает сигнал
Во время анализа мозга в когорте мышей, которые в очень молодом возрасте преодолели вирусную инфекцию, исследователи наблюдали накопление подтипа иммунных клеток: так называемых «резидентных Т-клеток памяти». «В нормальных условиях эти клетки распределены по всему мозгу и готовы защитить его в случае вирусной атаки. Но здесь клетки накапливаются в избытке в точном месте инфантильной инфекции в мозге », — говорит профессор Мерклер. Впоследствии исследователи обнаружили, что эти клетки продуцируют молекулу, которая специфически привлекает самореактивные клетки, позволяя им получать доступ к мозгу и вызывать аутоиммунные поражения мозга. «Чтобы подтвердить это наблюдение, — продолжает профессор, — мы заблокировали рецептор который передает сигнал самореактивным клеткам.
Подобное явление также встречается у людей
«Затем мы посмотрели, можем ли мы найти аналогичное накопление резидентных Т-клеток памяти, которые продуцируют эту молекулу у людей с рассеянным склерозом, и мы действительно это сделали», — говорит Карин Штейнбах. По аналогии, ученые предполагают, что самореактивные Т-клетки у людей могут получить доступ к мозгу по тому же механизму, что и у мышей, что требует дальнейших исследований.
«Мы продолжаем наши исследования в этом направлении. Мы особенно хотим понять, почему резидентные T-клетки памяти накапливаются в этих отдельных точках в мозге ребенка после инфекции, но не во взрослом возрасте », — заключает Карин Штейнбах. В будущем знания, полученные в результате этих исследований, могут помочь нам лучше понять возможные причины рассеянного склероза.ОБ ЭТОЙ НЕЙРОБИОЛОГИЧЕСКОЙ ИССЛЕДОВАТЕЛЬСКОЙ СТАТЬЕ
Источник:
Университет Женевы.
Контакты для СМИ:
Дорон Мерклер — Университет Женевы.
Источник изображения:
Изображение приписано UNIGE.
Оригинальное исследование: открытый доступ
«Т-клетки памяти, находящиеся в мозге, созданные в раннем возрасте, предрасполагают к аутоиммунному заболеванию у мышей». Дорон Мерклер и соавт.
Наука Трансляционная Медицина . doi: 10.1126 / scitranslmed.aav5519
Аннотация
Резидентные Т-клетки памяти мозга, созданные в раннем возрасте, предрасполагают к аутоиммунному заболеванию у мышей
Эпидемиологические исследования связывают вирусные инфекции в детском возрасте с риском развития аутоиммунных заболеваний в зрелом возрасте. Однако механистическая связь между этими событиями остается неуловимой. Мы сообщаем, что преходящая вирусная инфекция головного мозга в раннем возрасте, но не в более позднем возрасте, ускоряет аутоиммунное заболевание мозга, вызванное адоптивным переносом миелин-специфических CD4 + T-клеток в местах предыдущей инфекции у взрослых мышей. Инфекция мозга мышей в раннем возрасте имитировала хроническую воспалительную сигнатуру, состоящую из резидентных Т-клеток памяти, экспрессирующих лиганд 5 хемокинов (мотив CC) (CCL5). Блокада передачи сигналов CCL5 через CC-хемокиновый рецептор типа 5 предотвращала образование поражений головного мозга на мышиной модели аутоиммунного заболевания. В мозге мыши и человека, CCL5 + TRM были локализованы преимущественно в местах активации микроглии. Это исследование раскрывает, как преходящие вирусные вирусные инфекции в критическом окне в жизни могут оставить постоянные хемотаксические сигналы и создать долгоживущую разрешающую среду для аутоиммунитета.