Нейродегенеративные заболевания (НБ) представляют собой растущую проблему для здоровья, связанную с тяжелым бременем из-за деструктивных и долгосрочных клинических эффектов. Клеточные агрегации неправильно свернутых белков являются наиболее частым патологическим признаком многих поздних НБ, называемых протеинопатиями, включая болезнь Паркинсона (БП), болезнь Альцгеймера (БА), таупатии, боковой амиотрофический склероз (БАС) и болезни распространения полиглутамина (polyQ), такие как Болезнь Хантингтона (HD) и различные спиноцеребеллярные атаксии (SCA), такие как SCA3 (Renna et al., 2010). Неправильно свернутые белки могут быть получены посттрансляционной конъюгацией (например, гиперфосфорилированным тау-белком при БА) или эндопротеолитическим расщеплением (например, β-амилоидными пептидами) или генетическими мутациями в конкретных белках (таких как HTT при HD, α-синуклеин при PD,
Как правило, неправильно свернутые белки не накапливаются в клетках и удаляются с помощью механизмов контроля качества клеток. Однако олигомеры частично устойчивы ко всем известным протеолитическим путям и имеют тенденцию расти в фибриллярные тельца включения (Ciechanover and Kwon, 2015). Более того, агрегаты, обогащенные β-слоями, могут взаимодействовать с различными клеточными молекулами и прямо или косвенно нарушать систему убиквитин-протеасома, а также опосредованную шапероном аутофагию. Новые данные свидетельствуют о том, что аутофагия тесно связана с ND (Ciechanover and Kwon, 2015). Биохимический анализ показал, что аутофагические вакуоли многочисленны в посмертных образцах мозга многих ND и локализованы совместно с патологическими белками (Tan et al., 2014). Следовательно,
Одним из таких кандидатов является трегалоза, которая, как сообщалось, обладает нейропротекторным действием на животных моделях различных ND, таких как PD, AD и HD. Трегалоза, также известная как микоза, представляет собой невосстанавливающий дисахарид, который состоит из двух молекул глюкозы (связанных в конфигурации α, α-1, 1) и широко присутствует в микроорганизмах, растениях и беспозвоночных. Физические и химические свойства трегалозы обусловлены ее невосстанавливающими свойствами, что приводит к химической стабильности, высокой гидрофильности и сильной устойчивости как к кислотному гидролизу, так и к расщеплению глюкозидазами (Lee et al., 2018). Проглатывание трегалозы, как правило, безопасно как часть диеты и не вызывает быстрого повышения уровня глюкозы в крови. В дозах до 50 г трегалоза безопасна для человека, и не сообщалось о симптомах у большинства субъектов, за исключением лиц с дефицитом трегалозы, у которых; Возможны побочные эффекты со стороны желудочно-кишечного тракта. В исследованиях на животных летальных исходов после внутривенного введения не наблюдалось, хотя спорадически возникала диарея. Трегалоза всасывается аналогично глюкозе при пероральном или внутривенном введении. Однако он частично гидролизуется до глюкозы с помощью фермента треалазы, присутствующего в щеточной кайме кишечника и проксимальных канальцах почек, печени и крови (Emanuele, 2014).
Трегалоза может защищать биомакромолекулы и биологические системы, используя множество различных механизмов [Рисунок 1] . Первоначально он был известен как химический шаперон, который оказывает стабилизирующее действие на белковые структуры и предотвращает агрегацию белков. Было показано, что трегалоза стабилизирует частично развернутый белок Хантингтин и ингибирует агрегацию β-амилоида (Aβ) и прионного белка скрепи (PrPSc) в клеточных моделях HD, AD и прионных заболеваний соответственно (Lee et al., 2018). Более того, трегалоза может оказывать значительные антиоксидантные и противовоспалительные эффекты как in vivo, так и in vitro , поглощая свободные радикалы кислорода и предотвращая индуцибельную экспрессию синтазы оксида азота или образование оксида азота, соответственно (Emanuele, 2014).
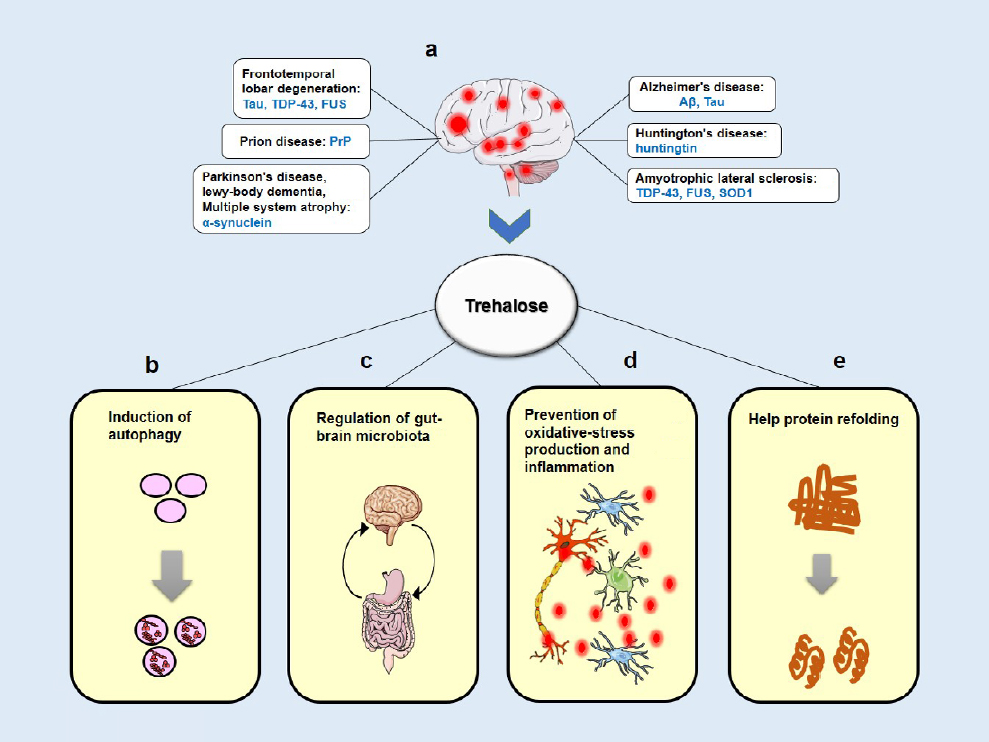 | Рисунок 1: Схематическое изображение предполагаемых в основном нейрозащитных механизмов трегалозы. (а) При большинстве нейродегенеративных заболеваний различные белки претерпевают конформационные изменения в своей структуре и накапливаются в головном мозге. (b) Трегалоза увеличивала клиренс токсичных белков за счет увеличения образования аутофагических вакуолей. (c) Один из возможных механизмов состоит в том, что трегалоза оказывает нейрозащитное действие, влияя на микробиоту кишечника. (d) Лечение трегалозой снижает количество активных форм кислорода и уменьшает воспалительную реакцию. (e) Трегалоза уменьшает патологию мутантного белка, действуя как химический шаперон и влияя на укладку и агрегацию белка. |
Недавно индукция аутофагии была предложена в качестве основной теории для объяснения механизма нейропротекции трегалозой в моделях протеинопатии (как in vitro, так и in vivo).) (Hosseinpour-Moghaddam et al., 2018). В экспериментах на клеточных культурах обработка трегалозой увеличивала клиренс мутантных белков Хантингтина, α-синуклеина и тау-белка за счет увеличения аутофагического потока в различных клетках млекопитающих. Было высказано предположение, что эти защитные эффекты опосредованы внутриклеточной трегалозой. Подобные наблюдения были сделаны в исследованиях на животных, в которых пероральное и внутрибрюшинное введение трегалозы индуцировало аутофагию и уменьшало агрегацию белка. Более того, воспаление и глиоз были уменьшены, а поведенческие и нейробиологические дефекты были частично восстановлены в ответ на трегалозу (Lee et al., 2018). Например, пероральное введение трегалозы значительно снижает нерастворимые SOD1 и убиквитинированные белки в тканях спинного мозга мышей с БАС. В модели трансгенных мышей HD трегалоза уменьшала количество агрегатов полиглутамина в головном мозге, улучшала двигательную дисфункцию, уменьшала атрофию мозга и увеличивала продолжительность жизни по сравнению с контрольными мышами, получавшими глюкозу, что позволяет предположить, что нейропротективные эффекты не были связаны с повышением уровня глюкозы после гидролиза трегалозы (Yoon et al., 2017 ). Трегалоза улучшала когнитивные функции и уменьшала аномальное отложение Aβ в гиппокампе модели трансгенных мышей с БА. Кроме того, трегалоза способствовала синаптической активности за счет активации факторов роста и маркеров нейрогенеза в гиппокампе мышей, что может коррелировать с когнитивным улучшением. Лечение трегалозой также замедлило патологические признаки в модели БП у мышей (Khalifeh et al., 2019, 2020).
Несмотря на положительное направление активации аутофагии в некоторых моделях ND, нет точного описания механизма, с помощью которого трегалоза управляет аутофагией. Было показано, что трегалоза, как независимый от mTOR активатор аутофагии, стимулирует de novo экспрессию аутофагических белков, включая SQSTM1 / p62 и MAP1LC3B, и способствует преобразованию LC3-I в LC3II. Он также действует через модуляцию различных молекулярных шаперонов, таких как HSP90 и SigmaR1. Сообщалось, что трегалоза индуцирует аутофагию в гепатоцитах AMPK-зависимым образом посредством ингибирования транспортера глюкозы SLC2A8 / GLUT8, который вызывает голодание по глюкозе и активирует аутофагию. Тем не менее, для запуска аутофагии трегалоза должна быть импортирована в клетки, а удаление SLC2A8, которое также действует как импортер трегалозы,
Недавнее исследование показало, что трегалоза проявляет свои метаболические эффекты через изменения лизосом, вызывая их быстрое увеличение и временную проницаемость. Такие лизосомные модификации могут быть вызваны лизосомным осмотическим стрессом, который приводит к лизосомному Ca 2+.высвобождение и активация PPP3 / кальциневрина. PPP3 / кальциневрин как фосфатаза специфически нацеливается на TFEB и индуцирует его перемещение в ядро. TFEB-индуцированный аутофагический поток стимулирует экспрессию генов, необходимых для активации аутофагии, включая ATG10, ATG12, BECN1, SQSTM1 / p62 и MAP1LC3B. Более того, устойчивые к треалазе аналоги трегалозы, мелибиозы и лактулозы показали аналогичные эффекты (Rusmini et al., 2019). Лизосомный распад и накопление аутофагосом также были описаны в мозге PD, а совместная локализация TFEB с α-синуклеином была обнаружена в тельцах Леви (Khalifeh et al., 2019). Примечательно, что нарушение аутофагосомы и дефектное слияние аутофагосома-лизосома также были обнаружены в других ND. Некоторые исследования показали, что нейрозащитный механизм трегалозы у животных может быть косвенным. При пероральном введении трегалоза может гидролизоваться в кишечнике, что повышает вероятность того, что нейропротекторные эффекты трегалозы осуществляются через передачу сигналов микробиота-кишечник-мозг (Lee et al., 2018). Anin vitroисследование показало, что трегалоза блокирует аутофагический поток, что противоречит представлению о том, что она является индуктором аутофагии. Авторы сообщили, что трегалоза нарушает целостность лизосомальной мембраны и ведет к предотвращению слияния аутофагосома-лизосома и накопления α-синуклеина в нейрональных клетках; однако жизнеспособность клеток не изменилась (Khalifeh et al., 2019). Примечательно, что Мартано и др. (2017) показали, что трегалоза присутствует в гиппокампе грызунов в виде эндогенного метаболита. Они обнаружили, что трегалоза биосинтезируется в первичных астроцитах как эндогенный метаболит, который используется нейронами и участвует в созревании нейронов за счет увеличения ветвления дендритов. Кроме того, в мозге мышей фермент треалаза в основном обнаруживается в нейронах, но не в астроцитах (Martano et al., 2017; Halbe, Rami, 2019).
Терапевтический потенциал трегалозы привлекателен благодаря ее положительным эффектам в различных моделях нейродегенерации, которые решительно поддерживают ее применение в клинических условиях. К настоящему времени было проведено несколько клинических испытаний трегалозы, обычно при таких заболеваниях, как отек желтого пятна, депрессивное расстройство и мышечные дистрофии. В недавнем открытом исследовании без группы плацебо у пациентов с SCA3 ежедневное введение 100 г трегалозы пероральным путем продемонстрировало умеренное улучшение тяжести заболевания. Побочные эффекты со стороны желудочно-кишечного тракта были зарегистрированы у семи пациентов, двое из них отказались от лечения из-за тяжелой диареи. У людей около 99,5% пероральной трегалозы метаболизируется ферментативно в эпителии тонкой кишки и не всасывается в виде неповрежденной молекулы. следовательно, для достижения адекватной концентрации в крови требуются большие дозы трегалозы, и это может привести к желудочно-кишечным симптомам, таким как диарея и метеоризм. Поэтому внутривенное введение было предложено в качестве альтернативного подхода к введению, который может обеспечить более высокие концентрации трегалозы в тканях. Безопасность, переносимость и эффективность внутривенного введения трегалозы (13,5 г или 27 г в неделю) были недавно протестированы в исследовании фазы II у пациентов с SCA3, и в течение периода до 1 года серьезных побочных эффектов выявлено не было (Zaltzman et al. , 2020). Более того, внутривенный раствор трегалозы (90 мг / мл) оказался безопасным и хорошо переносимым пациентами с окулофарингеальной мышечной дистрофией, а несколько зарегистрированных конечных точек улучшились после введения трегалозы.
Таким образом, появляется все больше данных о терапевтическом потенциале трегалозы при ND. Трегалоза общепризнана как безопасное вещество и широко используемый ингредиент, одобренный FDA, в фармацевтических препаратах, включая парентеральные препараты. Его безопасность может облегчить дальнейшие клинические испытания этого многообещающего агента в клинических исследованиях. Похоже, что трегалоза может вызывать более значительные эффекты при введении на пресимптоматической стадии ND до появления широко распространенной нейродегенерации. Помимо времени лечения, также необходимо получить информацию о правильной дозировке и способе введения трегалозы. До сих пор неизвестно, зависит ли нейрозащитное действие трегалозы от дозы. Более того, хотя внутривенный путь введения обеспечивает значительно более высокую биодоступность трегалозы по сравнению с пероральным путем, остается неясным, опосредует ли кишечная микробиота основную роль в нейрозащитных эффектах трегалозы. Также необходимы дальнейшие исследования, чтобы выяснить, происходят ли изменения в функции мозга при прямом или косвенном пути трегалозы.