Иммунологические аспекты аутоантител, направленных против паранодальных и узловых белков, составляют важную область исследований. Контактин-1 и контактин-1-ассоциированный белок, глиомедин и нейрофасцин (NF) являются белками, связанными с узлом Ранвье [ 1 , 2 ] . Антитела против этих белков были идентифицированы при хронических демиелинизирующих состояниях, таких как рассеянный склероз (MS) и хроническая воспалительная демиелинизирующая полирадикулонейропатия (CIDP); и при острых демиелинизирующих заболеваниях, таких как синдром Гийена-Барре [ 3 , 4 ], Миелиновые и параноидальные аксоглиальные соединения, фланкирующие узлы Ранвье, являются не просто пассивными передатчиками электрических сигналов: они играют важную роль в поддержании структурной целостности миелин-аксолемальных взаимодействий, двунаправленной сигнализации и регуляции ионных каналов [ 5 ] .
Здесь мы сосредоточимся на NF155, главной составляющей паранодального перехода Ранвье [ 6 ] . NF155 принадлежит к семейству L1 молекул адгезии трансмембранных клеток [Figure 1] , обычно представляя эволюционную хорошо консервативную структуру доменного белка с шестью доменами иммуноглобулина и пятью доменами фибронектина типа III, трансмембранным доменом и цитоплазматическим доменом со 113 аминокислотами [ 7 , 8 ] . Он экспрессируется в параноидах концевыми петлями миелина [ 9 ]и его основная функция заключается в стабилизации этих параноидов. Другие изоформы NFs (NF166, NF180 и NF186) в равной степени участвуют в динамических механизмах синаптической стабилизации, нервного отростка и кластеризации натриевых каналов [ 7 ] .
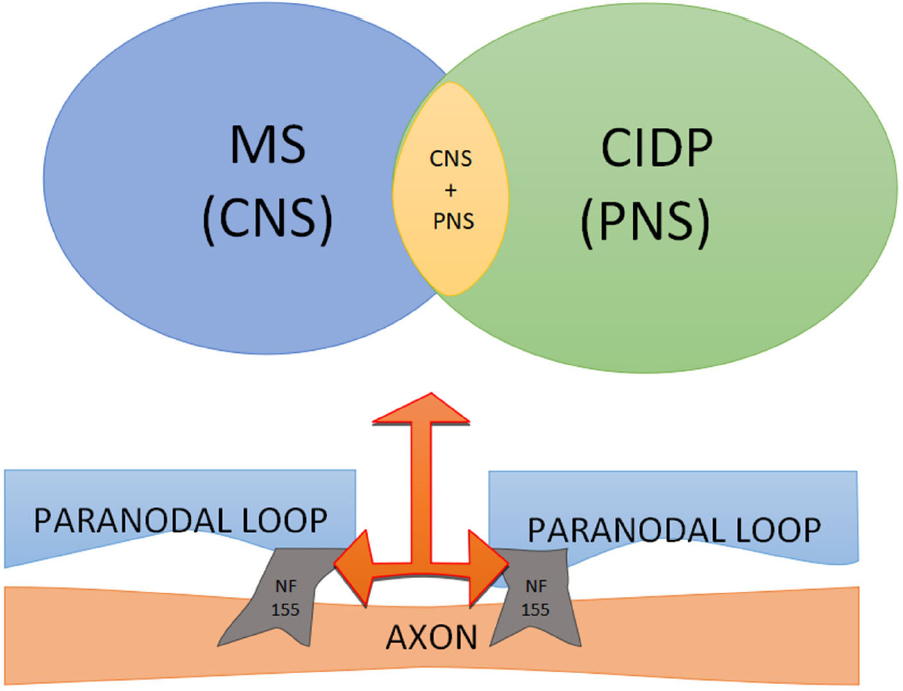
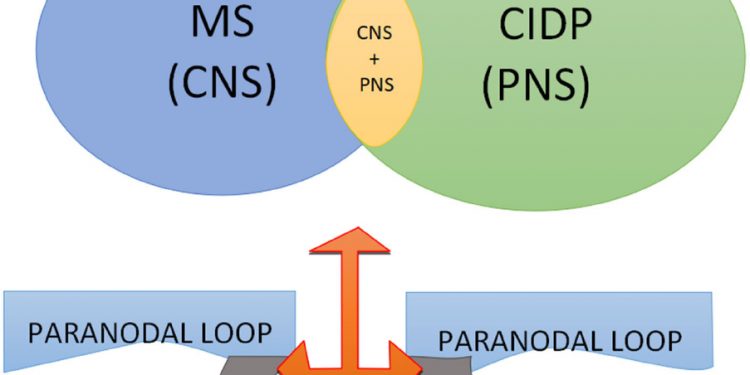
Рисунок 1. Neurofascin 155 (NF155) представляет собой трансмембранную адгезивную молекулу, расположенную в паранодальной области в центральной (ЦНС) и периферической нервной системе (ПНС), что оправдывает различные клинические проявления. CIDP: хроническая воспалительная демиелинизирующая полирадикулоневропатия; МС: рассеянный склероз
Пациенты с CIDP, которые представляют антитела против NF155, имеют определенное течение болезни, которое включает начало в более молодом возрасте, тремор, атаксию, дизартрию, нистагм, чрезвычайно высокие уровни белка в спинномозговой жидкости, симметричный гипертрофия спинного корешка и сплетения [ 10 , 11 ].
Кроме того более 70% этих пациентов могут иметь аномальные зрительные вызванные потенциалы, во время курса CIDP [ 10 ] . Пациенты с CIDP с анти-NF155-антителами могут иметь демиелинизирующие поражения в центральной нервной системе, а также замечательно плохой ответ на внутривенные курсы иммуноглобулина [ 12 ]. В целом у пациентов с CIDP с перекрывающейся центральной и периферической демиелинизацией, связанной с наличием антител против NF155, наблюдается большая инвалидность.
В дополнение к особенностям периферической демиелинизации, связанным с присутствием антител NF155, заболевания центральной нервной системы также показывают специфические особенности при выявлении антител против NF155. Десять процентов пациентов , выполняющих диагностические критерии МS [ 13 ], может иметь антитела против NF155 [ 14 ].
Описаны случаи неврологического заболевания с типичным приступом рассеянного склероза, которые впоследствии были диагностированы как CIDP [ 15 — 17 ] . Интересно что наличие антител против NF155 значительно чаще встречается у пациентов с первичными прогрессирующими формами РС, чем у пациентов с рецидивирующим заболеванием [ 18 ].,
Пациенты, у которых вырабатываются антитела против NF155, могут в конечном итоге представлять другую форму демиелинизирующего заболевания с центральным и периферическим поражением. В этих случаях часто наблюдаются признаки поражения мозжечка, спинного мозга и сплетения, демиелинизации зрительного нерва и высокого уровня белка в спинномозговой жидкости. Антитела против NF155 могут образовывать биомаркер для конкретной формы демиелинизирующего неврологического заболевания. NF155 не активирует комплемент [ 9 ] . Поэтому, по крайней мере, теоретически, пациенты с антителами против NF155 могут хорошо реагировать на терапию с использованием окрелизумаба и ритуксимаба. «Анти-NF155 демиелинизация» может представлять собой другое заболевание со специфическим проявлением и терапевтическим лечением.
Источники
- 1. Огата Х., Ямасаки Р., Хиваташи А., Ока Н., Кавамура Н. и др. Характеристика IgG4 антинейрофацин 155 антител положительной полиневропатии. Ann Clin Transl Neurol 2015; 2: 960-71.DOI PubMed PMC
- 2. Stathopoulos P, Alexopoulos H, Dalakas MC. Аутоиммунные антигенные мишени в узле Ранвье при демиелинизирующих расстройствах. Nat Rev Neurol 2015; 11: 143-56.DOI PubMed
- 3. Querol L, Siles AM, Alba-Rovira R, Jauregui A, Devaux J, et al. Антитела против периферических нервных антигенов при хронической воспалительной демиелинизирующей полирадикулоневропатии. Sci Rep 2017; 7: 14411.DOI PubMed PMC
- 4. Кира Дж.И., Ямасаки Р., Огата Х. Анти-нейрофашин аутоантитела и демиелинизация. Neurochem Int 2018; doi: 10.1016 / j.neuint.2018.12.011.DOI PubMed
- 5. Шафер Д.П., Бансал Р., Хедстром К.Л., Пфейффер С.Е., Расбанд М.Н. Требуется ли образование и поддержание параноидного распределения нейрофасцина 155 на липидные рафты? J Neurosci 2004; 24: 3176-85.DOI PubMed
- 6. Илла И. Лекция Артура Эсбери: хроническая воспалительная демиелинизирующая полирадикулонейропатия: клинические аспекты и новые модели аутоиммунитета животных к узловым компонентам. J Peripher Nerv Syst 2017; 22: 418-24.DOI PubMed
- 7. Крибель М., Вухтер Дж., Тринкс С., Волкмер Х. Нейрофаскин: переключение между нейрональной пластичностью и стабильностью. Int J Biochem Cell Biol 2012; 44: 694-7.DOI PubMed
- 8. Hortsch M, Nagaraj K, Mualla R. Семейство молекул клеточной адгезии L1: отвратительное количество мутаций и функций белка. Adv Neurobiol 2014; 8: 195-229.DOI PubMed
- 9. Pomicter AD, Shroff SM, Fuss B, Sato-Bigbee C, Brophy PJ и др. Новые формы нейрофасцина 155 в центральной нервной системе: изменения в моделях паранодальных нарушений и рассеянный склероз. Brain 2010; 133: 389-405.DOI PubMed PMC
- 10. Огата Х., Мацусе Д., Ямасаки Р., Кавамура Н., Мацусита Т. и др. Общенациональное исследование комбинированной центральной и периферической демиелинизации в Японии. J Neurol Neurosurg Psychiatry 2016; 87: 29-36.DOI PubMed
- 11. Бейли Л., Монгин М., Делорм С., Apartis Е., Сахеб С. и др. Тремор, связанный с хронической воспалительной демиелинизирующей полиневропатией и антителами против нейрофасцина-155. Tremor Other Hyperkinet Mov (NY) 2018; 8: 606.DOI PubMed PMC
- 12. Devaux JJ, Miura Y, Fukami Y, Inoue T, Manso C, et al. Neurofascin-155 IgG4 при хронической воспалительной демиелинизирующей полиневропатии. Неврология 2016; 86: 800-7.DOI PubMed PMC
- 13. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, et al. Диагностические критерии рассеянного склероза: пересмотр критериев Макдональда в 2010 году. Ann Neurol 2011; 69: 292-302.DOI PubMed PMC
- 14. Kawamura N, Yamasaki R, Yonekawa T, Matsushita T, Kusunoki S, et al. Антитела против нейрофасков у пациентов с сочетанной центральной и периферической демиелинизацией. Neurology 2013; 81: 714-22.DOI PubMed
- 15. Klehmet J, Staudt M, Diederich JM, Siebert E, Meinl E, et al. Neurofascin (NF) 155- и NF186-специфический Т-клеточный ответ у пациента, развивающего центральную понтоцеребеллярную демиелинизацию после 10 лет CIDP. Front Neurol 2017; 8: 724.DOI PubMed PMC
- 16. Shimizu M, Koda T, Nakatsuji Y, Ogata H, Kira JI и др. Случай положительного антитела против нейрофасцина 155 в сочетании с центральной и периферической демиелинизацией успешно лечили с помощью плазменного обмена. Риншо Шинкейгаку 2017; 57: 41-4.DOI PubMed
- 17. Итайя К, Иноуэ М, Иидзука Н., Симидзу Ю., Юки Н. и др. Случай 17-летнего мужчины с положительной реакцией на нейрофасцин-155, хроническая воспалительная демиелинизирующая полирадикулонейропатия с тремором и атаксией. Rinsho Shinkeigaku 2016; 56: 633-6.DOI PubMed
- 18. Стич О., Перера С., Бергер Б., Яриус С., Вильдеманн Б. и др. Распространенность антител к нейрофасцину-155 у пациентов с рассеянным склерозом. J Neurol Sci 2016; 364: 29-32.DOI PubMed