Особенности
Антитела против нейрофацина обнаруживаются при рассеянном склерозе и хронической воспалительной демиелинизирующей полирадикулоневропатии.
Антитела IgG4 против нейрофасцина связаны с уникальными свойствами, которые в совокупности называются парано-патопатия.•
Роль антител IgG4 против нейрофасканов заключается в блокаде взаимодействий между параноидальными белками.
Аннотация
Заболевания демиелинизации, вовлекающие центральную и периферическую нервную системы, являются этиологически гетерогенными, причем как клеточно-опосредованный, так и гуморальный иммунитет играют патогенные роли. Недавно аутоантитела против узловых и паранодальных белков, такие как нейрофасцин 186 (NF186), нейрофасцин 155 (NF155), контактин-1 (CNTN1), контактин-ассоциированный белок 1 (CASPR1) и глиомедин, были обнаружены не только в условиях хронического демиелинизирования, таких как как рассеянный склероз (MS) и хронических воспалительных демиелинизирующих полирадикулоневропатия, но и в острых состояниях демиелинизирующих, таких как синдром Гийена-Барре, Лишь меньшая часть этих пациентов обладает антителами против нодального / параноидального белка; тем не менее, эти аутоантитела, особенно аутоантитела подкласса IgG4 к параноидальным белкам, связаны с уникальными особенностями, и эти состояния в совокупности называются нодопатия или паранодопатия. Создание концепции IgG4-связанной нодопатии / паранодопатии вносит вклад в диагностику и стратегию лечения, поскольку неврологические заболевания, связанные с аутоантителами IgG4 , часто не поддаются традиционной иммунотерапии.
IgG4 не фиксирует комплементы и не интернализует антигены-мишени, поскольку IgG4 существует в моновалентной биспецифической форме in vivo., Аутоантитела IgG4 могут препятствовать взаимодействию белок-белок. Таким образом, основная роль антипаранодальных белковых антител IgG4 может заключаться в блокаде взаимодействий между NF155 и CNTN1 / CASPR1, что приводит к нарушению проводимости, что согласуется с суральной. Патология нерва с отрывом параноидальной концевой петли от аксонов с неповрежденными междоузлиями при отсутствии воспаления. Однако еще предстоит выяснить, как эти аутоантитела, принадлежащие к одному и тому же подклассу IgG4, могут вызывать каждое специфическое для аутоантитела IgG4 проявление. Другая важная проблема заключается в выяснении механизма возникновения антител IgG4 к нодальным / параноидальным белкам. Антитела IgG4 развиваются при хронической антигенной стимуляции и могут блокировать антитела, которые облегчают аллергическое воспаление, препятствуя связыванию аллерген-специфического IgE с аллергенами . Таким образом, антигены окружающей среды, перекрестно реагирующие с узловыми и параноидальными белками, могут требовать дальнейшего изучения.
Ключевые слова
Хроническая воспалительная демиелинизирующая полирадикулоневропатия Комбинированная центральная и периферическая демиелинизация, Рассеянный склероз, Нейрофаскин 155 Узел Ранвье Paranode
1 . Вступление
Воспалительная демиелинизация, поражающая центральную нервную систему (ЦНС) и периферическую нервную систему (ПНС), имеет гетерогенные механизмы, причем как клеточно-опосредованный, так и гуморальный иммунитет играют патогенные роли. В хронических условиях демиелинизирующих, таких как рассеянный склероз (MS) и хронических воспалительных демиелинизирующих полирадикулоневропатия (CIDP),аутоантителапротив узловыми и paranodal белков, таких как neurofascin186 (NF186) (Матейдр., 2007), neurofascin155 (NF155) (Матейдр al., 2007;Ng et al., 2012;Kawamura et al., 2013;Querol et al., 2014 ; Огата и др., 2015 ; Devaux et al., 2016 ; Kadoya et al., 2016 ), контактин-1 (CNTN1) ( Querol et al., 2013 ; Doppler et al., 2015 ; Miura et al., 2015 ) и контактин-ассоциированный белок 1 (CASPR1) ( Doppler et al. ., 2016 ), были открыты и много изучены. Даже при остром демиелинизирующем заболевании , таком как синдром Гийена-Барре , антитела против узловых белков , таких как NF186, глиомедин и контактин, были обнаружены у меньшинства пациентов ( Devaux et al., 2012). Демиелинизирующие заболевания, связанные с этими аутоантителами, в настоящее время признаны нодопатиями или парано-патопатиями ( рис. 1 ). Среди этих аутоантител антитела против NF186 и -NF155 были обнаружены при демиелинизирующих расстройствах как ЦНС, так и ПНС ( Mathey et al., 2007 ; Kawamura et al., 2013 ; Ogata et al., 2015 ). Таким образом, знание анти-нейрофаскиновых (NF) антител становится все более важным. В этом обзоре мы опишем клинические и иммунологические особенности демиелинизирующих заболеваний, связанных с антителами против NF, с особым акцентом на комбинированную центральную и периферическую демиелинизацию (CCPD) и CIDP.

2 . Neurofascins
Среди узловых и параноидальных белков NF, молекула клеточной адгезии имеет решающее значение для формирования и поддержания узлов Ранвье . В результате альтернативного сплайсинга четыре основных полипептида NF продуцируются и экспрессируются в нервных тканях; NF186, NF180, NF166 и NF155 (рис. 2) (Kriebel et al., 2012 ). Эти полипептиды в основном состоят из шести иммуноглобулиноподобных доменов, до пяти доменов фибронектина типа III (FN), трансмембранного домена и короткий цитоплазматический домен. NF180 и NF166 являются незрелыми нейрональными белками. В зрелой нервной системе преобладают нейрональная изоформа NF186 и глиальная изоформа NF155 (Kriebel et al., 2012 ). NF155 и NF186 различаются по своим внеклеточным доменам; NF155 несет FN3, в то время как NF186 не имеет этого домена, и вместо этого имеет домен муцина между FN4 и FN5.
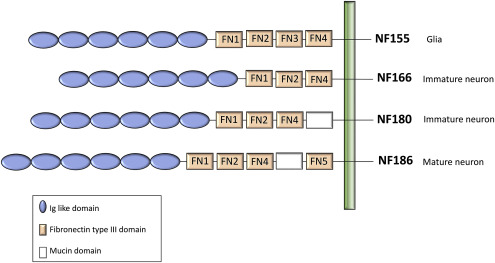
Аксонал NF186 взаимодействует с анкирином-G для кластеризации натриевых каналов в узлах Ранвье ( Davis et al., 1996) ( рис. 3 ). В PNS NF186 взаимодействует с глиомедином в матриксе и в микроворсинках клеток Шванна, чтобы способствовать прикреплению микроворсинок аксон-шваннских клеток ( Stathopoulos et al., 2015 ). В ЦНС некоторые белки внеклеточного матрикса могут играть роли, аналогичные глиомедину (Stathopoulos et al., 2015 ). Генетическая абляция NF186 приводит к потере молекулы адгезии нейрональных клеток (NrCAM), другой молекулы аксональной адгезии, которая связывается с анкирином и молекула адгезии клеток Шванна, глиомедин, приводящая к некластеризации натриевых каналов (Na v ) и анкирин-G в узлах ЦНС и ПНС, что сопровождается проникновением паранодальных петель в узловую область (Thaxton et al., 2011 ). Это указывает на то, что NF186-зависимая сборка узлового комплекса действует как молекулярная граница, чтобы ограничить миграцию параноидальных петель в узловые области.
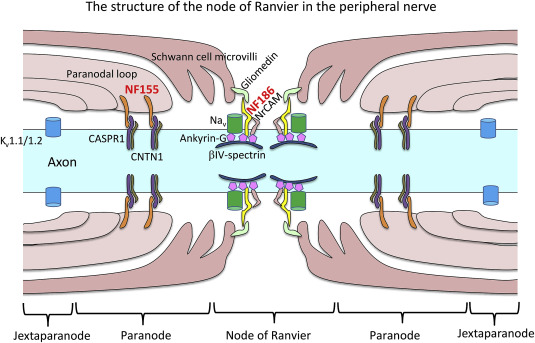
Глиальный NF155 экспрессируется в паранодальных петлях олигодендроцитов в ЦНС ( Tait et al., 2000 ) и в клетках Шванна в PNS ( Sherman et al., 2005 ). Glial NF155 взаимодействует с аксонными CNTN1 и CASPR1 ( Pedraza et al., 2001 ). У NF-нулевых мышей трансгенная экспрессия NF155 в миелинизированной глие рекрутирует CNTN1 и CASPR1, восстанавливая аксон-глиальный комплекс адгезии в параноидах. Однако кластеризация натриевого канала и NrCAM в узлах не была восстановлена ( Sherman et al., 2005), предполагая решающую роль NF186 в сборке узловых комплексов. Glial NF155 образует септатоподобные поперечные полосы между концевыми петлями и аксонами вместе с аксонами CNTN1 и CASPR1 для поддержания кластеризации ионных каналов в узлах Ранвье ( Sherman et al., 2005 ). Миелинизирующая глиа-специфическая абляция NF155 вызывала заметное снижение скорости нервной проводимости вместе с миграцией паранодальных калиевых каналов CASPR1 и юкстапаранодального (Kv1.1) в направлении узловой области ( Pillai et al., 2009 ), предполагая, что NF155 необходим для отделения узловых управляемые напряжением натриевые каналы из юкстапаранодальных калиевых каналов. Как потеря NF155 и CNTN1 у генетически модифицированных мышей приводит к разрушению септоподобных соединений, оставляя большой разрыв между аксолеммой и концевыми петлями клетки Шванна, что снижает скорость нервной проводимости ( Boyle et al., 2001 ;Sherman et al., 2005 ; Pillai et al., 2009 ), эти молекулы считаются основными для поддержания солевой проводимости.
3 . Рассеянный склероз
MS является демиелинизирующим заболеванием ЦНС, в то время как прогрессирование инвалидности определяется атрофией серой матери и широко распространенным нейроаксональным повреждением, которое не ограничивается демиелинизирующими поражениями ( Li et al., 2006 ; Fisniku et al., 2008 ). Недавнее исследование предоставило доказательства ранней и персистирующей нейроаксональной дегенерации на протяжении всего курса MS ( Azevedo et al., 2018 ). В вскрытых головном мозге MS раннее изменение паранодальных структур было обнаружено в активно демиелинизирующих поражениях, где NF155 теряется, а калиевые каналы (Kv1.2) проникают в NF186-позитивные узлы ( Howell et al., 2006). В remyelinating теневых бляшек, восстановление NF155 на paranodes, а также группирование из натриевых каналов и NF186 в узлах произошло ( Howell и др., 2006 ).
Mathey et al. (2007) впервые сообщили о наличии аутоантител, распознающих внеклеточный домен как NF155, так и NF186 примерно у трети пациентов с РС. Антитела против NF чаще обнаруживались при хронической прогрессирующей MS, чем рецидивирующей ремиттирующей MS (RRMS). Пассивный перенос антител против NF усугублял экспериментальный аутоиммунный энцефаломиелит (EAE), животную модель MS, индуцированную адоптивным переносом миелиновых олигодендроцитов гликопротеинов (MOG) -специфических Т-клеток у крыс ( Mathey et al., 2007 ). В этой модели анти-NF-антитела, депонированные в узле Ranvier in vivo вместе с комплементом, приводили к повреждению аксонов, Эти наблюдения позволяют предположить, что анти-NF-антитела облегчают аксональную патологию при MS, особенно при хронической прогрессирующей MS. В качестве альтернативы сообщалось, что анти-NF-антитела вторично продуцировались межмолекулярным антигенным распространением эпитопа в MOG-индуцированной, но не индуцированной миелиновым основным белком модели EAE крысы ( Flytzani et al., 2015 ). Однако следует соблюдать осторожность, поскольку даже в оригинальной статье ( Mathey et al., 2007 ) пациенты с другими воспалительными неврологическими заболеваниями также имели анти-NF-антитела с частотой, сходной с RRMS, а в другом сообщении не описано различий в распространенности анти-NF серопозитивность между пациентами с первичным прогрессирующим РС (4,8%) или RRMS (0,6%) и здоровыми контролями (2,0%) (Стич и др., 2016 ).
4 . Комбинированная центральная и периферическая демиелинизация
Демиелинизирующие заболевания обычно поражают ЦНС или ПНС, возможно, потому, что соответствующие аутоантигены существуют только в ЦНС или ПНС. Однако у пациентов с демиелинизацией в ЦНС или ПНС иногда наблюдается демиелинизация в другой нервной системе ( рис. 1 ). Предполагается, что аутоантигены, обычно присутствующие в ЦНС и ПНС, распознаются у этих пациентов. Такое состояние имеет различные диагностические названия; не только CCPD, но также CIDP с вовлечением ЦНС и CIDP с мультифокальной демиелинизацией ЦНС ( Kamm and Zettl, 2012 ). Поскольку в литературе имеются только сообщения о случаях заболевания или небольшая серия исследований таких случаев, в 2012 году мы провели первое общенациональное исследование в Японии, чтобы раскрыть демографические особенности CCPD (Огата и др., 2016 ).
4.1 . Результаты общенационального опроса CCPD
Определение: мы определили CCPD как удовлетворяющий следующим критериям (Ogata et al., 2016).
Критерий поражения ЦНС: поражения высокой интенсивности Т2 в головном мозге, зрительных нервах или спинном мозге при МРТ или отклонения в вызванных зрением потенциалах (VEP).2.
Критерий вовлечения PNS: задержка проводимости, блок проводимости, временная дисперсия или аномалии F-волны, предполагающие периферическую демиелинизирующую невропатию согласно исследованиям нервной проводимости (NCS).
Демографические особенности: CCPD является редким заболеванием; вероятно, менее 0,52% больных РС и 2,8% пациентов с CIDP в Японии, по данным общенационального опроса. Средний возраст начала заболевания составлял 32 года (от 8 до 59 лет). Соотношение мужчин и женщин составило 1: 2,6. Режим начала был острым у 19,4%, подострым у 45,2% и хроническим у 35,5%. Клинические курсы были монофазными у 26,3%, рецидивирующими ремиттирующими у 52,6% и хроническими прогрессирующими у 21,1%.
Неврологические проявления: начало с симптомами ЦНС, такими как нарушение зрения, гемиплегия и сенсорное нарушение гемибоди, наблюдалось примерно у 40%, начало с проявлениями ПНС, такими как слабость и нарушение чувствительности четырех конечностей, примерно у 40%, и начало с проявлениями как ЦНС, так и ПНС примерно в 20%. Наиболее распространенным симптомом / признаком в течение всего курса было нарушение чувствительности (94,9%), вторым наиболее распространенным симптомом / признаком была моторная слабость (92,5%), а третьим было нарушение походки (79,5%). Черепные нервы были поражены в 75,0%, а зрительные нервы были поражены наиболее часто (63,3%), причем приблизительно 50% демонстрируют двустороннее вовлечение. Гипорефлексия и гиперрефлексия были замечены у 65,0% и 22,5% соответственно, а патологические рефлексы — у 45,0%. Нарушение сфинктера присутствовало в 47,4%. Мышечная атрофия и мозжечковая атаксия были обнаружены примерно у 25%. Психические расстройства, судороги и дыхательные расстройства иногда наблюдались.
Результаты лабораторных исследований: у немногих пациентов были общие аутоантитела, и ни один из пациентов не обнаружил антитела против аквапорина 4 (AQP4). Уровни белка в спинномозговой жидкости (CSF) были увеличены на 82,5%, в то время как плеоцитоз присутствовал только на 27,5%, что указывает на альбуминоцитологическую диссоциацию на 57,5%. Олигоклональные полосы IgG (OB) CSF были положительными только у 7,4%, а индекс IgG был повышен у 18,5%.
Магнитно-резонансная томография (МРТ) и электрофизиологические данные.
На МРТ поражения головного мозга, мозжечка, ствола мозга и зрительного нерва были обнаружены в 75,0%, 15,0%, 32,5% и 17,5% соответственно. Обширные поражения (> 3 см в диаметре) наблюдались у 25,0%, в то время как гадолиниевые (Gd) -рассмотренные поражения были обнаружены только у 17,5%. Повреждения спинного мозга были обнаружены у 75,0% из которых 36,7% копили контраст Gd. Продольно обширные повреждения спинного мозга (LESCLs), распространяющиеся на три или более сегмента позвонка, присутствовали в 7,5%. Визуально-вызванные потенциалы (VEP) были аномальными у 71,4%, при двустороннем наблюдении их у 53,3%. В двигательной нервной проводимости исследования (NCS), снижение скорости проводимости двигательного нерва (MCV) и длительная латентность F-волны были наиболее распространенными результатами, которые были признаны в 77,5% и 70,0%, соответственно. У приблизительно половины пациентов были обнаружены аномальная амплитуда потенциала действия сложных мышц, длительное дистальное латентное состояние и снижение частоты появления зубца F. Блок проводимости и временная дисперсия были обнаружены в 27,5% и 40,0% соответственно. В сенсорной NCS сниженный или отсутствующий потенциал действия сенсорного нерва наблюдался у 87,5%, тогда как снижение скорости проводимости по сенсорному нерву наблюдалось у 42,5%.
Ответ на лечение. Пациенты с CCPD чаще всего получали внутривенные или пероральные кортикостероиды, а затем внутривенные иммуноглобулины, что привело к улучшению на 83,3%, 75,0% и 66,7% соответственно. Плазмаферез был проведен у небольшой части пациентов с CCPD , из которых 87,5% улучшились. Напротив интерферон-бета (IFN-β) был эффективен только в 10,0%, и даже усугубил заболевание в 30,0%. На пике болезни 40,0% пациентов с CCPD имели тяжелую инвалидность (≥4 баллов по шкале Хьюза), некоторым из них требовалась искусственная вентиляция легких, в то время как после лечения 65,0% не имели или имели только легкие нарушения (≤1 балла по шкале Хьюза). CCPD Ответ на лечение. Пациенты с CCPD чаще всего получали внутривенные или пероральные кортикостероиды, а затем внутривенные иммуноглобулины, что привело к улучшению на 83,3%, 75,0% и 66,7% соответственно. Плазмаферез был проведен у небольшой части пациентов с CCPD, из которых 87,5% улучшились. Напротив интерферон-бета (IFN-β) был эффективен только в 10,0%, и даже усугубил заболевание в 30,0%. На пике болезни 40,0% пациентов с CCPD имели тяжелую инвалидность (≥4 баллов по шкале Хьюза), некоторым из них требовалась искусственная вентиляция легких, в то время как после лечения 65,0% не имели или имели только легкие нарушения (≤1 балла по шкале Хьюза).
4.2 . Характерные особенности CCPD с антителами против NF155
Кавамура и соавт. (2013) впервые описали высокие частоты антител против NF155 у пациентов с CCPD. Согласно общенациональному исследованию CCPD в Японии, антитела против NF155 были обнаружены в 45% случаев ( Ogata et al., 2016 ). Однако уровни позитивности анти-NF155-антител в CCPD варьируются в разных исследованиях, возможно, отражая методы анализа и используемые виды антигенов. Как упоминалось в следующем разделе, демиелинизирующие поражения ЦНС наблюдались у 8% анти-NF155-позитивных пациентов с CIDP, у которых анти-NF155-антитела сходным образом воздействовали на параноиды ЦНС и ПНС ( Devaux et al., 2016 ). Характерные особенности пациентов с CCPD с антителами против NF155 являются следующими ( Kawamura et al., 2013 ; Ogata et al., 2016). (1) Участие ЦНС и ПНС происходит либо одновременно, либо последовательно с коротким или длинным интервалом. (2) NCS показывает диффузное замедление проводимости с нарушением фокусной проводимости, которое неотличимо от CIDP. (3) Поражение ЦНС в основном характерно для МС, при котором могут развиваться поражения спинного мозга и Gd-усиление поражений, но иногда они атипичны, демонстрируя диффузные поражения белого вещества головного мозга . (4) OB CSF являются отрицательными в большинстве случаев, но количество белка CSF демонстрирует переменную степень увеличения. (5) Комбинированная иммунотерапия, включающая кортикостероиды, IVIg и плазму, полезна как для поражения ЦНС, так и для ПНС. Эти данные свидетельствуют о том, что аутоантитела против NF в параноидах и узлах, но не уплотнены миелином, может нарушать аксоглиальную целостность, приводя к воспалительной демиелинизации как в ЦНС, так и в ПНС.
5 . Хроническая воспалительная демиелинизирующая полирадикулоневропатия
5.1 . Распространенность антипаранодных антител при CIDP и других воспалительных невропатиях
CIDP — это приобретенное иммуноопосредованное заболевание, поражающее периферические нервы. Поскольку CIDP охватывает этиологически гетерогенные условия, точные механизмы CIDP еще предстоит выяснить. Тем не менее, как клеточный, так и гуморальный иммунитет должны играть патогенную роль в CIDP. Недавно было продемонстрировано, что у части пациентов с CIDP имеются аутоантитела к параноидальным белкам, таким как NF155 ( Ng et al., 2012 ; Querol et al., 2014 ; Ogata et al., 2015 ; Devaux et al., 2016 ; Kadoya et al. al., 2016 ), CNTN1 ( Querol et al., 2013 ; Doppler et al., 2015 ;Miura et al., 2015 ) и CASPR1 ( Doppler et al., 2016 ). Каждое из этих аутоантител связано с уникальными особенностями.
Антитела против CNTN1 были обнаружены у 6% пациентов с CIDP, у которых обычно отмечался преклонный возраст, преобладание двигательной активности, агрессивное начало симптомов и раннее вовлечение аксонов ( Querol et al., 2013 ; Doppler et al., 2015 ; Miura et al. , 2015 ). Допплер и соавт. (2016) сообщили о случае CIDP с антителами против CASPR1 с болезненной невропатией. Сыворотки из этого случая связывают не только параноиды, но также некоторые нейроны заднего ганглия, что позволяет предположить, что анти-CASPR1-антитела могут вызывать болезненную невропатию через повреждение нейронов малого заднего ганглия, передающих болевое ощущение ( Doppler et al., 2016). Однако эти результаты должны быть подтверждены крупномасштабными исследованиями.
Противоречивые результаты были получены в отношении присутствия антител против NF186 в CIDP. Одно исследование показало 12% -ную степень позитивности ( Devaux et al., 2012 ), а другие 0% ( Ng et al., 2012 ; Ogata et al., 2015 ). Измерение антител против NF155 с помощью иммуноферментного анализа в двух исследованиях выявило низкие показатели позитивности к человеческому NF155, 2,5% ( Ng et al., 2012 ) и 3,8% ( Querol et al., 2014), хотя 22% -ная позитивность к крысам Сообщалось о NF155 ( Yan et al., 2014 ). Мы разработали более специфический анализ антител с использованием человеческого NF155 и проточной цитометрии и обнаружили, что уровень позитивности анти-NF155-антител у пациентов с CIDP, MS и другими невропатиями и у здоровых контролей составил 18% (9/50), 0% (0/32), 2,5% (1/40), и 0% (0/30) соответственно ( Ogata et al., 2015 ). Все случаи CIDP имели преимущественно антитела IgG4 подкласса ani-NF155, в то время как в одном положительном случае с синдромом Гийена-Барре были антитела IgG1 подкласса против NF155 ( Ogata et al., 2015 ). Следовательно, анти-NF155 антитела подкласса IgG4, по-видимому, специфичны для подгруппы CIDP.
5.2 . Клинические аспекты IgG4 анти-NF155 антител-положительного CIDP
Характерные особенности IgG4-анти-NF155-позитивного CIDP по сравнению с анти-NF155-анти-негативным CIDP следующие: более молодой возраст начала (25,2 ± 10,7 против 47,9 ± 17,0 лет, среднее значение ± SD), более высокая частота падения ноги, Нарушение походки, тремор и дистальный приобретенный демиелинизирующий симметричный (DADS) фенотип нейропатии, более высокие уровни белка CSF (317,0 ± 141,1 против 103,8 ± 75,8 мг / дл) и более выраженное удлинение дистальной части (7,7 ± 1,4 против 6,7 ± 3,3 мс) и задержки F-волны (53,7 ± 16,3 против 42,4 ± 11,4 мс) (Ogata et al., 2015).
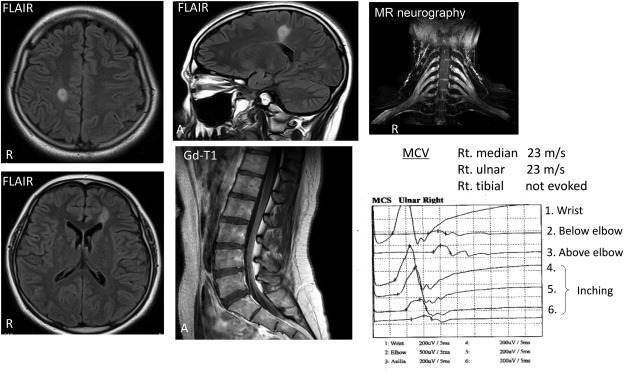
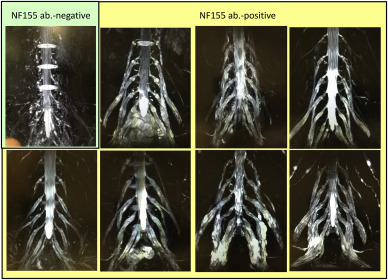
Мы разработали новый метод МРТ-нейрографии с трехмерным усилением сигнала нерва-оболочки с быстрым захватом остальной ткани INKed с помощью релаксационной визуализации (3D SHINKEI) корешков и сплетений позвоночника и выявили, что все семь случаев с антителами IgG4 против NF155 единообразно продемонстрирована выраженная гипертрофия шейного и поясничного отделов позвоночника . Наибольшие диаметры корней среди двусторонних корней C5 – C8 были значительно больше у пациентов с положительными антителами против NF155, чем у пациентов с отрицательными антителами против NF155 (7,7 ± 1,3 против 4,9 ± 2,0 мм) ( Рис. 5 ) ( Ogata et al. ., 2015 ; Hiwatashi et al., 2017 ). Даже проксимальные черепные нервы, такие как глазодвигательные и тройничные нервы также показывают гипертрофию и называется знаком усов ( Franques et al., 2017 ). Эти данные свидетельствуют о том, что появление антител IgG4 против NF155 не ограничивается фенотипом DADS, демонстрирующим дистальную доминантную моторную и сенсорную полиневропатию, а связано с вовлечением проксимального нерва, представляющего типичный фенотип CIDP. Кроме того, у IgG4-анти-NF155-позитивных пациентов иногда развиваются поражения ЦНС, свидетельствующие о демиелинизации (CCPD) (рис. 4) ( Kawamura et al., 2013 ; Ogata et al., 2015 , 2016 ; Devaux et al., 2016 ).
Антитела против NF155 были первоначально обнаружены у части пациентов с CIDP, резистентных к IVIg (Querol et al., 2014). Наши результаты также свидетельствуют о том, что одного только ИГВВ недостаточно для улучшения инвалидности таких пациентов ( Ogata et al., 2015 ). Кортикостероиды в сочетании с IVIg более полезны, чем один только IVIg ( Ogata et al., 2015 ), что совместимо с тем фактом, что кортикостероиды широко используются для лечения заболеваний, связанных со специфическими для заболевания аутоантителами IgG4, такими как пузырчатка ( Hertl et al., 2015 ) и тромботическая тромбоцитопеническая пурпура ( Scully et al., 2012 ). Для устойчивого улучшения, долгосрочного иммуносупрессия ежедневными пероральными кортикостероидами и / или иммунодепрессантами более эффективна, чем повторное внутривенное введение IgG4 в отношении анти-NF155-антителопозитивных CIDP. Важно отметить, что долгосрочное обсервационное исследованиепоказало, что уровни антител против NF155 варьировали параллельно с клиническими и электрофизиологическими изменениями или даже предшествовали им ( Fujita et al., 2018 ), что указывает на патогенную роль самого антитела IgG4 против NF155. Восстановление нервной проводимости путем обмена плазмой с уменьшением титров анти-NF155-антител также совместимо с патогенной ролью анти-NF155-антител IgG4 ( Fujita et al., 2018 ). В небольшой серии случаев с анти-NF155 антителом положительный CIDP, устойчивый к обычнымСообщалось , что иммунотерапияритуксимаб , моноклональное антитело против CD20, нацеленное на В-клетки, полезна для долгосрочного облегчения ( Querol et al., 2015).
5.3 . Нейропатология анти-NF155 антител-положительного CIDP
Случаев вскрытия с положительным анти-NF155 антителом CIDP не было; тем не менее, при гистопатологическом исследовании биоптатов суральных нервов мы впервые выявили субпериневриальный отек и случайную паранодальную демиелинизацию, но не выявили васкулита , воспалительных инфильтратов клеток или луковиц луковицы. Потеря миелинизированного волокна была незначительной даже в течение нескольких лет после начала заболевания ( Ogata et al., 2015 ). Отслойка концевых петель клеток Шванна от аксонов в паранодах, разрушающих септоподобные поперечные полосы, была характерно обнаружена с помощью электронной микроскопии у анти-NF155-позитивных пациентов, но не у серонегативных пациентов с CIDP ( Koike et al., 2017 ; Kuwahara et al., 2018 ).
5.4 . Механизм IgG4 анти-NF155 антител-позитивных CIDP
Сыворотки пациентов с CIDP, положительными к антителам против NF155, специфически связываются с параноидальными областями периферических нервов, что позволяет предположить, что параноиды являются первичными мишенями. Эти сыворотки не реагируют с нейрональной изоформой, NF186 ( Ogata et al., 2015 ), что указывает на то, что антигенные эпитопы должны существовать вокруг внеклеточного домена FN3, который уникален для NF155 ( рис. 2 ). Антитела против NF155 подкласса IgG4 преобладают у всех пациентов с CIDP, которых мы исследовали ( Ogata et al., 2015 ). IgG4 имеет компактную структуру из-за взаимодействия домена CH2 с транс-тяжелой цепью , что приводит к отсутствию доступа к комплементам к домену CH2, которые фиксируют комплементы. Таким образом, IgG4 не может активировать комплемент, потому что он не может связывать C1q (Huijbers et al., 2015 ). Кроме того in vivo IgG4 существует как одновалентный биспецифичный из-за полумолекулярного обмена после разрыва межцепной дисульфидной связи белковой дисульфидизомеразой, экспрессируемой на иммуноцитах и эндотелиальных клетках. В результате IgG4 не усваивает антигены-мишени ( Huijbers et al., 2015 ). Физиологически IgG4 продуцируется хронической антигенной стимуляцией, а IgG4 блокирует связывание аллерген-специфического IgE с аллергенами , тем самым уменьшая аллергическое воспаление. Следовательно, аутоантитела IgG4 также могут препятствовать взаимодействию белок-белок ( Huijbers et al., 2015). В совокупности эти наблюдения позволяют предположить, что первичная роль антител IgG4 против NF155 может заключаться в блокаде взаимодействий между NF155 и CNTN1 / CASPR1, что ведет к нарушению проводимости, что согласуется с патологией слизистой оболочки нервов в IgG4, положительном по антителам против NF155 CIDP, и представляет только отсоединение параноидальной концевой петли с неповрежденными междоузлиями при отсутствии воспаления ( Ogata et al., 2015 ; Koike et al., 2017 ; Kuwahara et al., 2018 ). Восстановление нервной проводимости путем обмена плазмой с уменьшением титров анти-NF155 антител также совместимо с действием IgG4 в качестве блокирующего антитела ( Fujita et al., 2018 ).
6 . Вывод и перспективы на будущее
Благодаря открытию аутоантител против узловых и параноидальных белков у меньшинства пациентов с РС, ХЗП и ХИДП, появляется концепция нодопатии или параноидопатии. Хотя значение анти-NF-антител в хронической прогрессирующей РС требует дальнейших широкомасштабных исследований, аутоантитела IgG4 против параноидальных белков в CIDP связаны с уникальными свойствами, специфичными для каждого состояния. Установление связанных с IgG4 демиелинизирующих состояний вносит вклад в диагностику и стратегию лечения, поскольку неврологические заболевания, связанные с аутоантителами IgG4 , часто бывают невосприимчивы к обычным иммунотерапиям, таким как IVIg.
Механизм, с помощью которого аутоантитела, принадлежащие к одному и тому же подклассу IgG4, могут вызывать каждое специфическое свойство антитела IgG4, еще предстоит выяснить. Например, обширная гипертрофия спинного мозга и выраженное повышение уровня белка CSF, наблюдаемые только в IgG4-положительном CIDP-антителе против NF155, но не в других парано-патопатиях, таких как анти-CNTN1 и анти-CASPR1-положительный CIDP, предполагают сильное воспаление нерва. корни ( Ogata et al., 2015 ), что не может быть адекватно объяснено функциями антител IgG4. Мы обнаружили увеличение количества клеток CFS и провоспалительных цитокинов у IgG4-анти-NF155-положительных пациентов с CIDP (представлено для публикации); следовательно, NF155-специфичные Т-клетки может быть вовлечен в воспаление корня позвоночника и ЦНС. Поскольку отчетливо выражена ассоциация аллелей HLA класса II с анти-NF155-антителом CIDP у европейцев ( Martinez-Marinez et al., 2017 ), необходимы будущие исследования антиген-ограниченных Т-клеток HLA класса II для расшифровки механизма этого условия.
Другим важным вопросом является механизм, с помощью которого возникают антитела IgG4 к узловым и параноидальным белкам. Антитела IgG4 могут блокировать антитела, которые облегчают аллергическое воспаление, препятствуя связыванию аллерген-специфического IgE с аллергенами . Переключение класса IgG4 требует помощи от фолликулярных хелперных Т-клеток типа 2, продуцирующих IL-4, IL-10 и IL-13 . Таким образом, антигены окружающей среды, перекрестно реагирующие с узловыми и параноидальными белками, могут быть важны для изучения в будущем.
Подтверждения
Это исследование было поддержано исследовательским грантом по здравоохранению и трудовым наукам по трудноизлечимым болезням [H29-Nanchitou (Nan) -Ippan-043] от Министерства здравоохранения, труда и социального обеспечения, Япония , в рамках проекта «Практические исследования редких / трудноизлечимых». Болезни »от Японского агентства медицинских исследований и разработок (AMED, 17ek0109115h0003 ), Япония, благодаря исследовательскому гранту от Японского общества рассеянного склероза, исследовательскому гранту от Японского фонда исследований трудноизлечимых болезней, гранту« GlialAssembly » -Помощь за научные исследования в области инноваций (грант MEXT KAKENHI № 25117012 ) отМинистерство образования, культуры, спорта, науки и технологий Японии и грант на научные исследования (A) (грант JSPS KAKENHI № 16H02657 ) Японского общества содействия развитию науки, Япония . Мы благодарим Джереми Аллена, доктора философии, из Edanz Group ( www.edanzediting.com/ac ) за редактирование черновика этой рукописи.
Приложение А. Дополнительные данные
Ниже приведены дополнительные данные к этой статье:
Данные исследований для этой статьи
Данные отсутствуют / Данные не использовались для исследования, описанного в статье. О данных исследований
Рекомендации
Азеведо и др., 2018CJ Азеведо , С.Ю. Чен , С. Хадка , С. Лю , Дж. Корнак , Ю. Ши , Л. Чжэн , С. Л. Хаузер , Д. Пеллетье Атрофия таламуса при рассеянном склерозе: маркер магнитно-резонансной томографии нейродегенерации на протяжении всей болезниЭнн. Neurol. , 83 ( 2018 ) , стр. 223 — 234CrossRefПросмотреть запись в ScopusGoogle ScholarБойл и др., 2001МЕТ Бойл , Е. О. Берглунд , К. К. Мерэй , Л. Вебер , Е. Пелеш , Б. RanschtContactin оркеструет сборку перегородок-подобные переходов на paranode в миелиновых периферических нервахНейрон , 30 ( 2001 ) , с. 385 — 397СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarДэвис и др., 1996JQ Дэвис , С. Ламберт , В. БеннеттМолекулярный состав узла Ранвье: идентификация анкирин-связывающих молекул клеточной адгезии нейрофаскин (муцин + / третий домен FNIII-) и NrCAM в сегментах узлового аксонаJ. Cell Biol. , 135 ( 1996 ) , стр. +1355 — один тысяча триста шестьдесят-семьCrossRefПросмотреть запись в ScopusGoogle ScholarDevaux и др., 2012JJ Devaux , M. Odaka , N. Yuki.Узловые белки являются антигенами-мишенями при синдроме Гийена-Барре.Дж. Перифер. Нерв. Сист. , 17 ( 2012 ) , стр. 62 — 71CrossRefПросмотреть запись в ScopusGoogle ScholarДево и др., 2016JJ Девы , Ю. Миура , Ю. Фуки , Т. Inoue , С. Мансо , М. Belghazi , К. Секигучи , Н. Кокубун , Х. Итикав , AHY Вонг , Н. ЮкиNeurofascin-155 IgG4 , при хронической воспалительной демиелинизирующей полиневропатииНеврология , 86 ( 2016 ) , с. 800 — 807CrossRefПросмотреть запись в ScopusGoogle ScholarДопплер и др., 2015K. Doppler , L. Appeltshauser , K. Wilhelmi , C. Villmann , SD Dib-Hajj , SG Waxman , M. Mäurer , A. Weishaupt , C. SommerРазрушение паранодальной архитектуры при воспалительной невропатии с антиконтактин-1 аутоантителамиJ. Neurol. Neurosurg. Психиатрия , 86 ( 2015 ) , с. 720 — 728CrossRefПросмотреть запись в ScopusGoogle ScholarДопплер и др., 2016K. Doppler , L. Appeltshauser , C. Villmann , C. Martin , E. Peles , HH Krämer , A. Haarmann , M. Buttmann , C. Sommer Аутоантителак контактин-ассоциированному белку 1 (Caspr) у двух пациентов с болезненная воспалительная невропатияBrain , 139 ( 2016 ) , с. 2617 — 2630CrossRefПросмотреть запись в ScopusGoogle ScholarФранки и др., 2017J. Franques , F. Chapon , J. Devaux , S. MathisTeaching Neuro Изображения : гипертрофия черепных нервов в IgG4 anti-neurofascin 155 антител-положительной полиневропатииНеврология , 88 ( 2017 ) , с. e52 , 10.1212 / WNL.0000000000003616CrossRefПросмотреть запись в ScopusGoogle ScholarФиснику и др., 2008LK Fisniku , PAP BREX , DR Альтман , К. А. Miszkiel , ЦИК Бентон , Р. Lanyon , AJ Томпсон , DH Миллеринвалидности и Т2 МРТ поражения: 20-летний период наблюдения пациентов с рецидивом возникновения рассеянного склерозаBrain , 131 ( 2008 ) , с. 808 — 817CrossRefПросмотреть запись в ScopusGoogle ScholarFlytzani et al., 2015S. Flytzani , AO Guerreiro-Cacais , M. N’diaye , M. Lindner , C. Linington , E. Meinl , P. Stridh , M. Jagodic , T. OlssonMOG-индуцированный экспериментальный аутоиммунный энцефаломиелит у видов крыс вызывает анти- -Нейрофаскиновый ответ антител, который генетически регулируетсяJ. Neuroimflamm. , 12 ( 2015 ) , стр. 194 , 10.1186 / s12974-012-0417-2Google ученыйFujita et al., 2018A. Fujita , H. Ogata , R. Yamasaki , T. Matsushita , J. KiraПараллельная флуктуация уровней антител против нейрофасцина 155 с клинико-электро-физиологическими данными у пациентов с хронической воспалительной демиелинизирующей полирадикулоневропатиейJ. Neurol. Sci. , 384 ( 2018 ) , стр. 107 — 112СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarРуководство, 2010Руководство PNSCЕвропейская федерация неврологических обществ / руководство периферического нервного общества по лечению хронической воспалительной демиелинизирующей полирадикулоневропатии: доклад совместной целевой группы Европейской федерации неврологических обществ и периферииДж. Перифер. Нерв. Сист. , 15 ( 2010 ) , стр. 1 — 9Посмотреть запись в ScopusGoogle ScholarHertl et al., 2015М. Hertl , Х. Jedlickova , С. Карпати , Б. Маринович , С. Узун , С. Yayli , Д. Мимуни , Л. Borradori , С. Feliciani , Д. Иоаннидес , П. Жоли , С. Ковалевской , Г. Замбруно , Д. Цилликенс , М.Ф. ЙонкманПузырчатка. Руководство S2 по диагностике и лечению — под руководством Европейского дерматологического форума (EDF) в сотрудничестве с Европейской академией дерматологии и венерологии (EADV)J. Eur. Акад. Dermatol. Venereol. , 29 ( 2015 ) , с. 405 — 414CrossRefПросмотреть запись в ScopusGoogle ScholarХауэлл и др., 2006OW Howell , A. Palser , A. Polito , S. Melrose , B. Zonta , C. Scheiermann , AJ Vora , PJ Brophy , R. ReynoldsНарушение локализации нейрофасканов выявляет ранние изменения, предшествующие демиелинизации и ремиелинизации при рассеянном склерозеBrain , 129 ( 2006 ) , с. 3173 — 3185CrossRefПросмотреть запись в ScopusGoogle ScholarHuijbers и др., 2015М. Huijbers , Л.А. Querol , EH Niks , JJ Plomp , С.М. ван — дер — Maarel , Ф. Граус , Дж Далмау , И. Илла , JJ VerschuurenРасширяющийся поле IgG4-опосредованных аутоиммунных заболеваний неврологическихЕвро. J. Neurol. , 22 ( 2015 ) , с. 1151 — 1161CrossRefПросмотреть запись в ScopusGoogle ScholarХиваташи и др., 2017А. Хиваташи , О. Тогао , К. Ямашита , К. Кикучи , Х. Огата , М. Йонейама , Дж. Кира , Х. ХондаОценка хронической воспалительной демиелинизирующей полиневропатии: 3D-сигнал оболочки нерва усиливается при быстром растрескивании ткани в покое приобретение изображений для улучшения релаксации (3D SHINKEI)Евро. Radiol. , 27 ( 2017 ) , стр. 447 — 453CrossRefПросмотреть запись в ScopusGoogle ScholarКадоя и др., 2016М. Кадоя , К. Кайда , Х. Койке , Х. Таказаки , Х. Огата , К. Моригучи , Дж. Симидзу , Э. Нагата , С. Такидзава , А. Чиба , Р. Ямасаки , Дж. Кира , Г. Собуэ , К. IkewakiIgG4 антинейрофацин 155 антитела при хронической воспалительной демиелинизирующей полирадикулоневропатии: клиническое значение и диагностическая применимость традиционного анализаJ. Neuroimmunol. , 301 ( 2016 ) , с. 16 — 22СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarКамм и Цеттл, 2012C. Kamm , UK ZettlАутоиммунные нарушения, затрагивающие как центральную, так и периферическую нервную системуAutoimmun. Rev. , 11 ( 2012 ) , с. 196 — 202СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarКавамура и др., 2013Н. КАВАМУРА , Р. Ямасаки , Т. Ёнекава , Т. Мацусита , С. Кусуноки , С. Нагаяма , Ю. Фукуда , Х. Огата , Д. Matsuse , Х. Мерэй , Дж КираАнти-neurofascin антитела у пациентов с комбинированная центральная и периферическая демиелинизацияНеврология , 81 ( 2013 ) , с. 714 — 722CrossRefПросмотреть запись в ScopusGoogle ScholarKoike et al., 2017Х. Койке , М. Кадоя , К. Кайда , С. Икеда , Ю. Кавагашира , М. Иидзима , Д. Като , Х. Огата , Р. Ямасаки , Н. Мацукава , Дж. Кира , М. Кацуно , Г. SobueПаранодальная диссекция при хронической воспалительной демиелинизирующей полиневропатии с антителами против нейрофаскин-155 и против контактина-1J. Neurol. Neurosurg. Психиатрия , 88 ( 2017 ) , с. 465 — 473CrossRefПросмотреть запись в ScopusGoogle ScholarКрибель и др., 2012М. Kriebel , Дж Wuchter , С. Тринкс , Х. VolkmerNeurofascin: переключение между нейрональной пластичности и стабильностиInt. J. Biochem. Cell Biol. , 44 ( 2012 ) , с. 694 — 697СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarКувахара и др., 2018М. Кувахара , Х. Сузуки , Н. Ока , Х. Огата , С. Янагимото , С. Садакане , Ю. Фукумото , М. Ямана , Ю. Юхара , К. Йошикава , М. Морикава , С. Кавай , М. Оказаки , Т. Цудзимото , Дж. Кира , С. КусунокиЭлектронно-микроскопическая аномалия и терапевтическая эффективность при хронической воспалительной демиелинизирующей полиневропатии с антителом против нейрофаскина 155 иммуноглобулина G4Мышечный нерв , 57 ( 2018 ) , с. 498 — 502Посмотреть запись в ScopusGoogle ScholarЛи и др., 2006Д. К. Ли , У. Held , Дж Petkau , М. Даумер , Ф. Barkhof , Ф. Фазекас , JA Франк , Л. Каппос , Д. Миллер , И. Н. Саймон , И. С. Волинский , М. Филиппи , Сильвия Лоури Центр MS Research.МРТ Т2 поражения при рассеянном склерозе: плато взаимосвязь с клинической инвалидностьюНеврология , 66 ( 2006 ) , с. 1384 — 1389CrossRefПросмотреть запись в ScopusGoogle ScholarМартинес-Маринез и др., 2017Л. Мартинес-Маринез , М. Синта Ллейкса , Г. Бора-Карникеро , А. Кортезе , Дж. Дево , А. Силес , Й. Раджабалли , А. Мартинес-Пиньейру , А. Карвахаль , Дж. Пардо , Э. Дельмонт , С. Attarian , Дж Диас-Маньера , И. Callegari , Е. Marchioni , Д. Franciotta , Л. Бенедетти , Г. Лория , О. де ла Калле Мартин , С. Хуарес , И. Илла , Л. QuerolАнти-NF155 хронические воспалительные демиелинизирующие полирадикулоневропатия прочно ассоциируется с HLA-DRB15J. Neuroinflammation , 14 ( 2017 ) , p. 224 , 10.1186 / s12974-017-0996-1Google ученыйМатей и др., 2007EK Mathey , T. Derfuss , MK Storch , KR Williams , K. Hales , DR Woolley , A. Al-Hayani , SN Davies , MN Rasband , T. Olsson , A. Moldenhauser , S. Velhin , R. Hohlfeld , E. Meiml , C. LiningtonNeurofascin как новая мишень для опосредованного аутоантителами повреждения аксоновJ. Эксп. Med. , 204 ( 2007 ) , с. 2363 — 2372CrossRefПросмотреть запись в ScopusGoogle ScholarМиура и др., 2015Ю. Миура , JJ Дев , Ю. Фуки , С. Мансо , М. Belghazi , AHY Вонг , Н. ЮкиContactin 1 IgG4 сопоставляет хроническую воспалительную демиелинизирующую полиневропатию с сенсорной атаксиейBrain , 138 ( 2015 ) , с. 1484 — 1491CrossRefПросмотреть запись в ScopusGoogle ScholarНг и др., 2012JKM Нг , J. Malotka , Н. Каваками , Т. Derfuss , М. Khademi , Т. Олссон , С. Linington , М. Одака , Б. Tackenberg , Х. Prüss , Ю.М. Schwab , Хармс , LH Хармс , С. Соммер , М. Н. Расбанд , Я. Эшед-Айзенбах , Э. Пелес , Р. Hohlfeld , Н. Юки , К. Dornmair , Е. МайнлNeurofascin в качестве мишени для аутоантител в периферических невропатийНеврология , 79 ( 2012 ) , с. 2241 — 2248CrossRefGoogle ScholarОгата и др., 2015Х. Огата , Р. Ямасаки , А. Хиваташи , Н. Ока , Н. Кавамура , Д. Мацусе , М. Кувахара , Х. Сузуки , С. Кусуноки , Й. Фудзимото , К. Икезоэ , Х. Кишида , Ф. Танака , Т. Мацусита , Х. Мурай , Дж. КираХарактеристика IgG4 антинейрофацин 155 антител положительной полинейропатииЭнн. Clin. Перев. Neurol. , 2 ( 2015 ) , с. 960 — 971CrossRefПросмотреть запись в ScopusGoogle ScholarОгата и др., 2016Х. Огата , Д. Мацусе , Р. Ямасаки , Н. Кавамура , Т. Мацусита , Т. Йонекава , М. Хиротани , Х. Мурай , Дж. КираОбщенациональное исследование комбинированной центральной и периферической демиелинизации в ЯпонииJ. Neurol. Neurosurg. Психиатрия , 87 ( 2016 ) , с. 29 — 36Посмотреть запись в ScopusGoogle ScholarПедраса и др., 2001Л. Педраса , Дж. К. Хуан , Д.Р.КолманОрганизационные принципы аксоглиального аппаратаНейрон , 30 ( 2001 ) , с. 335 — 344СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarПиллаи и др., 2009А. М. Пиллаи , С. Текстон , А.Л. Pribisko , Г. Ченг — младший , ДЛ Дапри , М.А. Бхатпространственно — временная абляция миелинизирующих глий конкретные Neurofascin (NfasNF155) у мышей показывает постепенную потерю paranodal axoglial переходов и сопутствующую дезорганизацию аксонов доменовJ. Neurosci. Местожительство , 87 ( 2009 ) , с. 1773 — 1793CrossRefПросмотреть запись в ScopusGoogle ScholarПолман и др., 2011CH Polman , SC Reingold , B. Banwell , M. Clanet , JA Cohen , M. Filippi , K. Fujihara , E. Havrdova , M. Hutchinson , L. Kappos , FD Lublin , X. Montalban , P. O’Connor , М. Сандберг-Вольхейм , А. Дж. Томпсон , Э. Ваубант , Б. Weinshenker , JS WolinskyДиагностические критерии рассеянного склероза: пересмотр критериев Макдональда 2010 годаЭнн. Neurol. , 69 ( 2011 ) , с. 292 — 302CrossRefПросмотреть запись в ScopusGoogle ScholarQuerol et al., 2013L. Querol , G. Nogales-Gadea , R. Rojas-Garcia , E. Martinez-Hernandez , J. Diaz-Manera , X. Suárez-Calvet , M. Navas , J. Araque , E. Gallardo , I. IllaAntibodies на контактин-1 при хронической воспалительной демиелинизирующей полиневропатииЭнн. Neurol. , 73 ( 2013 ) , стр. 370 — 380CrossRefПросмотреть запись в ScopusGoogle ScholarQuerol et al., 2014Л. Кверол , Г. Ногалес-Гадеа , Р. Рохас-Гарсия , Дж. Диас-Манера , Дж. Пардо , А. Ортега-Морено , М. Дж. Седано , Э. Галлардо , Дж. Берчиано , Р. Блеса , Дж. Далмау , I. IllaNeurofascin IgG4 антитела в CIDP ассоциируют с отключением тремора и плохой ответ на IVIgНеврология , 82 ( 2014 ) , с. 879 — 886CrossRefПросмотреть запись в ScopusGoogle ScholarQuerol et al., 2015L. Querol , R. Rojas-García , J. Diaz-Manera , J. Barcena , J. Pardo , A. Ortega-Moreno , MJ Sedano , L. Seró-Ballesteros , A. Carvajal , N. Ortiz , E. Gallardo , I. IllaРитуксимаб в устойчивом к лечению CIDP с антителами против параноидальных белковNeurol. Neuroimmunol. Neuroinflammation , 2 ( 2015 ) , p. e149CrossRefПросмотреть запись в ScopusGoogle ScholarСкалли и др., 2012М. Скалли , Б. Дж. Хант , С. Бенджамин , Р. Лизнер , П. Роуз , Ф. Пейванди , Б. Чунг , С. Дж. Мачин , Британский комитет по стандартам в гематологииРуководство по диагностике и лечению тромботической тромбоцитопенической пурпуры и других тромботических микроангиопатийBr. J. Haematol. , 158 ( +2012 ) , стр. 323 — 335CrossRefПросмотреть запись в ScopusGoogle ScholarШерман и др., 2005DL Шерман , С. Тэйт , С. Мелроуз , С. Мелроуз , Р. Джонсон , Б. Зонт , Ф. Суд , ВБ Маклин , С. Мика , AJH Смит , Д. Ф. Коттрелл , PJ БраяNeurofascins требуется установить аксоны доменов для сальтаторного проводимостьНейрон , 48 ( 2005 ) , с. 737 — 742СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarStathopoulos и др., 2015P. Stathopoulos , H. Alexopoulos , MC DalakasАутоиммунные антигенные мишени в узле Ранвье при демиелинизирующих расстройствахТуземный Преподобный Нейрол. , 11 ( 2015 ) , стр. 143 — 156CrossRefПросмотреть запись в ScopusGoogle ScholarСтич и др., 2016О. Стич , С. Перера , Б. Бергер , С. Яриус , Б. Вильдеманн , А. Баумгартнер , С. РауэрРаспространенность антител к нейрофашину-155 у пациентов с рассеянным склерозомJ. Neurol. Sci. , По ремонту 364 ( +2016 ) , стр. 29 — 32СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarTait et al., 2000S. Tait , F. Gunn-Moore , JM Collinson , J. Huang , C. Lubetzki , L. Pedraza , DL Sherman , DR Colman , PJ BrophyМолекула адгезии клеток олигодендроцитов в месте сборки параноидального аксоглиального соединенияJ. Cell Biol. , В 150 ( две тысячи ) , стр. 657 — 666CrossRefПросмотреть запись в ScopusGoogle ScholarТакстон и др., 2011C. Такстон , А. М. Пиллаи , А. Л. Прибиско , Дж. Л. Дюпри , М. БхатУзлы Ранвье выступают в качестве барьеров, ограничивающих вторжение фланкирующих параноидальных доменов в миелиновых аксонахНейрон , 69 ( 2011 ) , с. 244 — 257СтатьяСкачать PDFПосмотреть запись в ScopusGoogle ScholarЯн и др., 2014W. Yan , T. Nguyen , N. Yuki , Q. Ji , C. Yiannikas , JD Pollard , EK MatheyАнтитела к нейрофашину усугубляют адоптивный перенос экспериментального аутоиммунного невритаJ. Neuroimmunol. , 277 ( 2014 ) , с. 13 — 17СтатьяСкачать PDFПосмотреть запись в ScopusGoogle Scholar











