АССОЦИАЦИЯ РНК ВГС В ТКАНИ МОЗГА
В большинстве сообщений, подтверждающих наличие ВГС в ЦНС, использовались основанные на ПЦР подходы для выявления вирусных геномов в мозге и спинномозговой жидкости (CSF) [14–21]. Однако обнаружение только вирусной РНК не отражает активных сайтов репликации и может просто представлять вирусный носитель из периферии. Совсем недавно несколько авторов сообщили о РНК HCV с отрицательной цепью, репликативном промежуточном соединении, в ЦНС, предполагающем репликацию вируса [15, 16, 22]. Тем не менее, многие исследования включают небольшое количество пациентов, что затрудняет определение частоты HCV в ткани головного мозга. Недавнее исследование количественно определило уровни РНК ВГС в нескольких образцах из мозга и печени пациентов, инфицированных ВГС [19], продемонстрировав низкое количество РНК ВГС в тканях головного мозга в 1000–10 000 раз по сравнению с печенью, что согласуется с легкими невропатологиями, наблюдаемыми в ВГС -инфицированные пациенты. Таким образом, необходима осторожность при интерпретации физиологической значимости геномов РНК HCV в ткани мозга, где вирусная РНК может быть результатом заражения крови, а не прямым доказательством репликации вируса. Существуют некоторые доказательства генетического разнообразия между вирусными штаммами, выделенными из ткани мозга. , РВМС, сыворотка и печень.
В биопсии от того же пациента; Radkowskiet al. Заметил что последовательности NS3 HCV, выделенные из различных областей мозга, были аналогичны последовательностям, выделенным из лимфатических узлов, но дифференцированных от сывороточного вируса, что предполагает независимую эволюцию вируса в мозге [15]. В этом исследовании не удалось обнаружить РНК HCV с отрицательной цепью в сыворотке, что привело авторов к выводу, что вирусные последовательности, обнаруженные в мозге, не были результатом заражения крови [15]. Точно так же изменчивость во внутреннем рибосомном сайте входа (IRES) HCV была зарегистрирована в ткани головного мозга у двух пациентов, инфицированных HCV, по сравнению с последовательностями печени [20]. Совсем недавно в исследовании 13 пациентов, инфицированных ВГС, из которых у четырех обнаруживались сигналы ВГС в ткани головного мозга, использовался анализ полиморфизма однонуклеотидных соединений для выявления специфической для мозга мутации, которая составляла приблизительно 10% последовательностей ВГС в мозжечке и мозговом веществе, тогда как эта мутация было невозможно обнаружить в печени и плазме одних и тех же пациентов [19]. Взятые вместе, эти исследования подтверждают доказательства того, что ВГС может реплицироваться в головном мозге, что ставит вопрос о том, какие типы клеток в ЦНС поддерживают инфекцию ВГС.
Инфекция ВГС ассоциируется с иммунными реакциями в мозге.
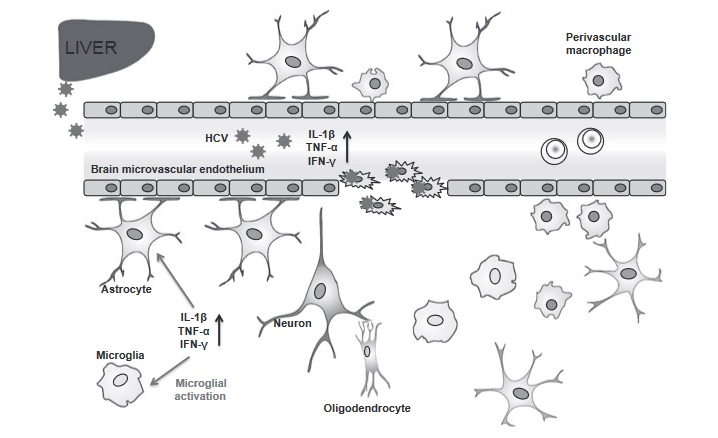
Недавние исследования показали, что инфекция HCV связана с воспалительными реакциями в головном мозге. Метаболиты в мозге холин, креатин и инозит были значительно увеличены у пациентов, инфицированных ВГС, по сравнению со здоровыми пациентами [23, 24], но у пациентов с низким уровнем усталости уровень холина был выше, чем у пациентов с тяжелой усталостью. Тем не менее, эти результаты предполагают активацию микроглии и, возможно, астроциты у HCV-инфицированных пациентов с усталостью [24]. Недавнее исследование неопытных пациентов с легкой хронической инфекцией ВГС выявило активацию микроглии и макрофагов головного мозга с использованием комбинации протонной магниторезонансной спектроскопии и позитронно-эмиссионной томографии (ПЭТ) с лигандом для нейровоспаления, которое не наблюдалось у серонегативных субъектов ВГС [25]. ]. Эта иммунактивация была связана с виремией ВГС и измененным метаболизмом мозга, демонстрируя измененные соотношения базального ганглиемиоинозитола / креатинина и холина / креатина у пациентов, инфицированных ВГС [25], предполагаемых биомаркеров воспаления и активации глиальных клеток [23,26]. Это наблюдение было зарегистрировано в группе из 22 пациентов, инфицированных ВГС, 15 из которых лечились пегилированным интерфероном и рибавирином, и 7 пациентов не получали лечения ВГС-положительного контроля [27]. В группе, получавшей лечение, пациенты, которые ответили на терапию, имели более низкие измерения церебральных метаболитов (снижение количества инкретина и миоинозитола), чем нереагировавшие или не получавшие контроль, а также снижение метаболитов, связанных с улучшенной нейрокогнитивной эффективностью [27]. Дальнейшее исследование посмертной ткани показало, что ткани головного мозга у людей, инфицированных HCV, значительно повышали уровни провоспалительных цитокинов IL-1, TNF-a, IL-12 и IL-18 [28], что может объяснить активацию глиальных клеток, о которой сообщалось в несколько исследований.
Астроглиоз и демиелинизация были зарегистрированы в редких случаях инфекции HCV с тяжелой невропатологией [17,28,29]; однако этого не наблюдается у большинства пациентов. Эти результаты демонстрируют, что более высокая вирусная нагрузка и более низкие нейрокогнитивные характеристики коррелируют с повышенной активацией иммунитета в ЦНС у HCV-инфицированных лиц; необходимы дальнейшие широкомасштабные исследования, чтобы выяснить, в какой степени это явление встречается при хроническом гепатите С.
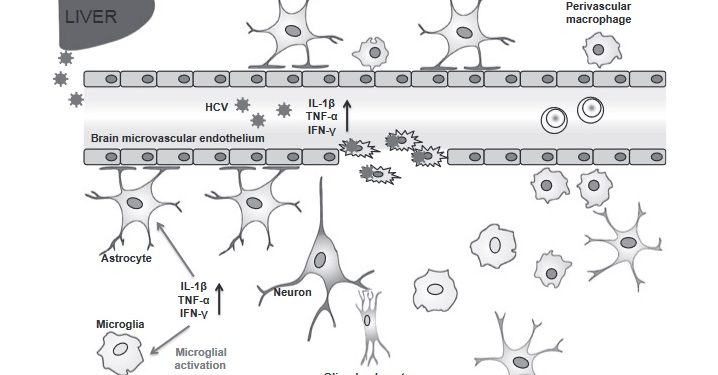
Эти исследования были первыми, чтобы продемонстрировать продуктивный HCV entry в не печеночных клетках, которые не были спроектированы для экспрессии вирусных рецепторов [37]. Однако эти результаты вряд ли соответствуют инфицированию HCV нейронов in vivo. Нейроэпителиомы представляют собой периферические опухоли, происходящие из нейроэпителия, происходящего из нервного гребня, которые представляют собой менее дифференцированный аспект нейральной линии [38] и вряд ли соответствуют любому типу клеток в нормальной ЦНС. в том же исследовании нейрональные клеточные линии не поддерживали проникновение HCV [33]. Однако экспрессия SR-BI, CD81, клаудина-1 и окклюдина в клетках нейроэпителиомы свидетельствует о том, что экспрессия рецептора HCV не является исключительной для гепатоцитов, и инфекция может не ограничиваться исключительно печенью. Недавние исследования показали, что микрососудистые эндотелиальные клетки мозга (BMEC ), основной компонент крови / мозгового барьера, поддерживают инфекцию HCV in vitro [39]. Две независимо полученные линии микрососудистых эндотелиальных клеток головного мозга, hCMEC / D3 и HBMEC, экспрессировали все факторы проникновения HCV и поддерживали проникновение псевдочастиц HCV и заражение HCV. Кроме того, иммунохимическое окрашивание срезов человеческого мозга показало, что микрососудистый эндотелий может экспрессировать все четыре рецептора, необходимые для проникновения HCV. Примечательно, что экспрессия SR-BI была ограничена эндотелием микрососудов головного мозга [33], что позволяет предположить, что тропизм HCV к мозгу может быть ограничен этими клетками. HCVpp экспрессирует разнообразные гликопротеины, инфицированные BMEC, и проникновение нейтрализуется антирецепторными и анти-HCV E2-антителами, демонстрируя путь входа acommon к пути, который сообщается для гепатоцитов [33]. Инфекция HCVpp была ограничена эндотелиальными клетками, происходящими из мозга, с эндотелиальными клетками выделенный из синусоид печени или эндотелия пупочной вены, не способных поддержать инфекцию HCV. Важно, что BMEC был пермиссивным для HCV, происходящего из клеточной культуры, показывая распространение инфекции и высвобождение частиц, которые были инфекционными для клеток гепатомы Huh-7. Вирусная инфекция сохранялась в клетках Huh-7, тогда как инфекция снижалась в BMEC через 120 часов и была связана с цитопатическими эффектами, что указывает на острую литическую инфекцию по сравнению с хронической инфекцией, наблюдаемой в клетках гепатомы. Апоптоз наблюдался в культурах BMEC, инфицированных HCV, и активность эндотелиального барьера снижалась после заражения; это было отменено добавлением HCV-положительной сыворотки крови пациента [39]. Эндотелиальные клетки гематоэнцефалического барьера (ГЭБ) отличаются от нормальных клеток в других частях тела в ряде аспектов. Плотные соединения в эндотелии мозга являются более сложными, чем соединения периферического эндотелия, что приводит к эпителиально-подобной полярности [40]. Эти плотные соединения исключают попадание крупных, водорастворимых веществ в мозг из кровотока. Прохождение крупных и липофильных веществ в мозг через ГЭБ обычно происходит через рецептор-опосредованный эндоцитоз, а некоторые вещества являются транспортируемыми через транспорт белками, такими как транспортер глюкозы GLUT-1 [40]. Микрососудистые эндотелиальные клетки мозга окружены концевыми ножками астроцитов и перицитами, которые помогают поддерживать барьерную целостность [40] (рис. 1). Наши исследования in vitro, показывающие апоптоз BMEC, инфицированных HCV, позволяют предположить, что HCV может нарушать BBBintegrityin vivo. Это может позволить приток воспалительных цитокинов и вируса к паренхиме головного мозга, что может привести к относительно легким неврологическим симптомам, наблюдаемым у пациентов. Репликация HCV и сборка инфекционных частиц в BMEC позволяет предположить, что мозг может способствовать патогенезу HCV через прямую вирусную инфекцию BBB (рис. 2), что поднимает вопросы о потенциальной эффективности методов лечения, в настоящее время разрабатываемых, таких как протеаза и ингибиторы полимеразы [41], так как они могут достигать низких уровней в мозгу из-за экспрессии эффективных насосов drugefflux в ГЭБ, таких как P-гликопротеин. При доставке этих лекарств в ЦНС могут возникнуть трудности, аналогичные тем, что отмечались при ВИЧ-инфекции, когда резервуары инфекции развиваются в таких местах с иммунным статусом, как мозг [42].
ВЫВОДЫ
Гепатит С является членом Flaviviridae, в состав которого входят ряд нейровирулентных вирусов, в том числе вирус японского энцефалита, вирус Западного Нила и вирус тикборнеэнцефалита [54]. Неврологические симптомы, связанные с инфекцией ВГС, были зарегистрированы много раз; однако было неясно являются ли эти симптомы функцией заболевания печени периферическим воспалением или прямой инфекцией ЦНС. Обнаружение РНК ВГС в мозге вместе с доказательствами свидетельствующими о независимой вирусологии в ЦНС, позволяет предположить что неврологические симптомы, о которых сообщают пациенты могут быть результатом прямой инфекции мозга. Последние достижения в области инструментов, доступных для изучения ВГС, позволили исследователям решить вопрос о том, реплицируется ли ВГС в клетках, происходящих из мозга. Недавнее наблюдение, что ВГС может реплицироваться в клетках мозга и дотирующих клеток и что нейровоспаление является особенностью инфекции ВГС, может обеспечить механизм для неврологические симптомы наблюдаются у значительного числа инфицированных пациентов.