О широко распространенной эпидемии вируса Зика (флавивируса, переносимого комарами) сообщалось с 2015 года в Южной и Центральной Америке. Серьезной проблемой, связанной с инфекцией, является значительный рост случаев микроцефалии у плодов, рожденных от матерей, инфицированных вирусом Зика (Mlakar et al., 2016 ). Исследователи, изучающие обезьян, показали, что одно заражение вирусом Зика защищает животное от будущих инфекций. Нейтрализующие антитела выявляются на 21 день после заражения. Повторное заражение через 10 недель после первоначальной инокуляции не привело к обнаруживаемой репликации вируса, что свидетельствует об успешном защитном иммунитете против вируса (Dudley et al., 2016). Они также обнаружили, что небеременные животные могут избавиться от вируса в течение 10 дней после заражения, однако вирус сохранялся в крови беременных обезьян в течение 35–70 дней (Dudley et al., 2016 ). Одно из возможных объяснений сохранения вируса во время беременности заключается в том, что иммунная система матери была нарушена, и она просто не могла избавиться от вируса так быстро, как небеременная. Однако у беременного животного (женщины) все же есть определенный уровень иммунитета. И интерфероны типа I, и интерфероны типа III, по-видимому, индуцируются вирусными инфекциями Зика, и интерфероны обладают способностью ограничивать репликацию вируса Зика в клетках трофобласта человека (Bayer et al., 2016 ; Quicke et al., 2016). Другое объяснение, более провокационная гипотеза заключается в том, что персистенция вируса указывает на внутриутробную инфекцию, и то, что они наблюдали в материнской сыворотке, было выделением вируса плодом обратно в кровь матери (Driggers et al., 2016 ) . Мы не можем окончательно утверждать, что персистенция вируса не отражает внутриутробную инфекцию или что у небеременных животных (людей) персистентность не обнаружена, поскольку возможно, что вирус Зика может сохраняться в иммунных клетках (Hazlett and Hendricks, 2010 ). Однако анализ клинических данных показывает, что в большинстве случаев вирусу может потребоваться ~ 5 недель для достижения плода (Noronha et al., 2016 ; Soares de Souza et al., 2016 ; Yuan et al., 2017a).). Следовательно, вирус, обнаруженный у беременной обезьяны в течение 35 дней после заражения, вряд ли обратный поток от плода обратно в кровоток матери.
Секреция вируса в экзосоме может быть центральным элементом его иммунного уклонения.
Тогда почему длительное сохранение вируса наблюдается только во время беременности? Ранее мы предположили, что вирус Зика может скрываться в экзосоме, которая образует щит против иммунной системы матери (Zhang et al., 2017 ). Доказано, что вирус гепатита С, еще один флавивирус, может передаваться через экзосомы и использовать путь аутофагии для передачи вируса, таким образом избегая опосредованных антителами иммунных ответов (Ramakrishnaiah et al., 2013 ; Longatti, 2015 ; Shrivastava et al., 2015 ) . Подобно вирусу гепатита С, вирус Зика может инфицировать клетки трофобласта, проникая в эндоплазматический ретикулум трофобласта и становясь своего рода грузом экзосомы плаценты (Adibi et al., 2016 ; Zhang et al.,2017 ), который тесно связан с процессом «секреторной аутофагии». В отличие от деградационной аутофагии (слияние с лизосомами) секреторная аутофагия может приводить к секреции или изгнанию вирусных частиц вместо их деградации (рис.Взаимодействие с другими людьми(Фигура 1)1) (Chahar et al., 2015 ; Pompuak et al., 2015 ; Carneiro, Travassos, 2016 ).фигура 1
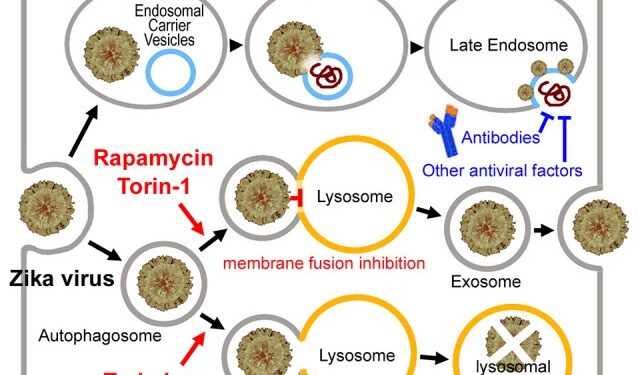
Предполагаемый путь проникновения вируса Зика и путь экзосом в клетке трофобласта. В случае вируса Зика после связывания с рецептором вирус проникает в раннюю эндосому через эндоцитозный процесс. Через несколько минут вирусная частица преимущественно сливается с мембраной везикулы эндосомного носителя (ECV). Однако в течение короткого времени вирусные нуклеокапсиды остаются захваченными в просвете ECV, пока ECV не сливается обратно с мембраной поздней эндосомы. Затем высвобождается нуклеокапсид. В качестве альтернативы вирус может проникнуть в аутофагосому и затем подвергнуться деградации путем слияния с лизосомой или стать своего рода грузом экзосомы плаценты, блокируя слияние аутофагосома-лизосома. Экзосома может защитить вирус от иммунной системы матери. Нейтрализующие антитела или другие противовирусные факторы не могут воздействовать на вирус, внедренный в экзосому. Торин 1 или рапамицин индуцирует агрегацию экзосом с внедренным вирусом, если стадия слияния лизосом была заблокирована. В то время как беклин 1 или трегалоза восстанавливает нарушенную стадию слияния, что приводит к лизосомной деградации вируса.
Роль аутофагии в проникновении и репликации флавивирусов
Роль аутофагии в проникновении и репликации флавивирусов хорошо изучена. В целом вирус настраивает белки аутофагии для эффективного проникновения вируса (Li et al., 2012 ; Dong and Levine, 2013 ; Jackson, 2015 ). Для вируса гепатита С аутофагия необходима для инициации, но не для поддержания репликации вируса (Dreux et al., 2009 ). Для вируса денге проникновение, репликация и трансляция вируса связаны с аутофагическими путями (Panyasrivanit et al., 2009 ). Инфекция вирусом Зика сопровождается обнаружением большого количества двойных мембранных аутофагосом (Hamel et al., 2015 ; Souza et al., 2016 ; Lennemann and Coyne,2017 ). В то время как сообщалось о совместном обнаружении белка оболочки вируса и маркерного белка аутофагии LC3 (цитозольная легкая цепь 3, ассоциированная с микротрубочками) (Hamel et al., 2015 ). Таким образом, некоторые ингибиторы образования аутофагосом (такие как 3-метиладенин и вортманнин) сильно снижают количество вирусных копий в некоторых линиях клеток (Nour et al., 2013 ; Hamel et al., 2015 ). Однако некоторые противоположные отчеты предполагают, что роль аутофагии при флавивирусных инфекциях противоречива (Li et al., 2016 ; Rolfe et al., 2016 ). ATG16L2 (родственный аутофагии 16-подобный 2) был идентифицирован среди 30 наиболее подавляемых генов в нервных стволовых клетках человека после заражения вирусом Зика (Rolfe et al., 2016). Транскрипт LC3 также подавлялся вирусной инфекцией Зика в клетках мозга мышей (Li et al., 2016 ). Однако в этих двух противоположных отчетах анализ экспрессии генов проводился через 56–72 ч после инокуляции вируса, что является поздней стадией заражения. Снижение некоторых генов, связанных с аутофагией, на поздних стадиях инфекции не означает, что аутофагия подавлялась на ранних стадиях инфекции или на начальных этапах.
Истощение белка ATG5, связанного с аутофагией, не влияет на репликацию вируса Западного Нила в некоторых клеточных линиях (Vandergaast and Fredericksen, 2012 ). В некоторых других сообщениях даже указывалось, что уровни репликации флавивирусов были увеличены в клетках с дефицитом аутофагии. Например, репликация вируса Западного Нила была увеличена в клетках эмбриональных фибробластов мыши, лишенных ATG5 (Kobayashi et al., 2014 ). Для вируса японского энцефалита либо истощение ATG7, либо дефицит ATG5 приведет к более высоким уровням репликации вируса в клетках эмбриональных фибробластов мыши (Sharma et al., 2014). Однако эти результаты не означают, что аутофагия напрямую подавляет репликацию вируса. Аутофагия может играть положительную роль на ранних стадиях инфекции; однако он становится дисфункциональным, когда неправильно свернутые белки накапливаются на поздних стадиях. Клетки с дефицитом аутофагии могут быть очень восприимчивы к гибели клеток, вызванной вирусом (Sharma et al., 2014 ; Martín-Acebes et al., 2015 ). Следовательно, в этих чувствительных клетках была обнаружена более высокая вирусная нагрузка.
Инфекция флавивирусом подавляет слияние аутофагосом и лизосом
В случае вируса денге сразу после заражения усиливались базальный и активированный аутофагические потоки. Однако во время установленной вирусной репликации базальный и активируемый Torin 1 аутофагический поток снижался из-за блокировки образования аутофагических пузырьков и снижения способности аутофагической деградации (Metz et al., 2015 ). На поздних стадиях инфицирования вирусом Денге количество аутофагических пузырьков увеличивалось в результате неэффективного слияния аутофагосом с лизосомами, хотя активность лизосом увеличивалась (Metz et al., 2015 ). Подобный дефект слияния аутофагосома-лизосома может также возникать при инфицировании вирусом Зика, поскольку многие гены, необходимые для слияния лизосом, подавлялись инфекцией вируса Зика (Li et al., 2016), такие как RAB7 (член суперсемейства Rab GTPase) (Pankiv et al., 2010 ) и гены класса C Vacuolar protein sorting (Vps) / HO motypic fusion и Protein Sorting (HOPS) , связывающий комплекс ( Vps16, Vps18, Vps33 ) ( Wurmser et al., 2000 ). Если стадия слияния лизосом была заблокирована, активация образования аутофагосом может вызвать агрегацию экзосом с вирусом, встроенным в Zhang et al. ( 2017 ). Это предположение подтверждается тем фактом, что торин 1 (классическая механистическая мишень рапамицина mTOR-зависимого активатора аутофагии) значительно усиливает репликацию вируса Зика (Hamel et al., 2015 ), а лечение рапамицином значительно усиливает репликацию вируса Денге (Lee et al. ,2013 ; Чу и др., 2014 ). Из-за нарушения слияния аутофагосома-лизосома вирус Зика может стать грузом экзосомы плаценты, кроме разложения в лизосоме, что может быть центральным в его иммунном уклонении, как это наблюдается у беременных животных (рис. Взаимодействие с другими людьми(Фигура 11).
Трегалоза может быть идеальным лекарством с высокой безопасностью
Трегалоза индуцирует образование аутофагосом по mTOR-независимому пути и восстанавливает нарушенное лизосомное слияние (Ejlerskov et al., 2013 ). Ранее сообщалось о роли трегалозы в аутофагии при некоторых других заболеваниях. Например, дефект слияния аутофагосома-лизосома наблюдался у мышей с моделью дегенерации двигательных нейронов на модели бокового амиотрофического склероза (БАС). Интересно, что, как и флавивирусные инфекции, рапамицин оказывает неблагоприятное воздействие на прогрессирование болезни БАС (Zhang et al., 2011 ). Напротив, трегалоза спасала стадию нарушенного слияния, что приводило к агрегированной аутофагической деградации мотонейронов. Трегалоза способна ослабить дефект аутофагического потока и улучшить течение болезни БАС (Zhang et al., 2014; Юань и др., 2017b ). Помимо БАС, аналогичный блокад пути деградации аутофагии-лизосомы также был зарегистрирован на мышиной модели таупатии человека. Стимуляция аутофагии трегалозой снижает агрегаты тау и улучшает выживаемость нейронов в коре головного мозга и стволе мозга (Schaeffer et al., 2012 ). Трегалоза также увеличивает способность макрофагов к деградации и считается средством лечения атеросклеротических сосудистых заболеваний (Sergin et al., 2017 ). Терапевтические эффекты трегалозы при вирусных инфекциях недавно были доказаны, что трегалоза оказывает сильное ингибирующее действие на репликацию цитомегаловируса человека и сильно ингибирует распространение вируса, предположительно, активируя деградационную аутофагию (Belzile et al., 2015).
Как обсуждалось в нашем предыдущем анализе (Yuan et al., 2017a ), перенос вируса Зика через плаценту может занять много времени. Вирусу может потребоваться около 5 недель, чтобы достичь плода (или более 12 недель, если заражение происходит на ранних сроках беременности). Люди могут предположить, что если большая часть вируса Зика будет уничтожена до того, как достигнет плода, частота возникновения микроцефалии может значительно снизиться. Трегалоза способствует слиянию аутофагосомы и лизосомы и предотвращает проникновение вируса в экзосому и, следовательно, вызывает деградацию вируса или делает вирус доступным для иммунной системы матери (рис.Взаимодействие с другими людьми(Фигура 1). Следовательно, лечение трегалозой может помочь избавиться от вируса в течение 5 недель. Таким образом, трегалоза может быть полезна при раннем инфицировании вирусом Зика. Однако трегалоза не может предотвратить микроцефалию, вызванную вирусом Зика, на поздних стадиях инфекции, когда вирус уже достиг плода. Учитывая, что иммунная система матери потратит более 10 дней на очистку от вируса, лечение трегалозой следует применять как можно скорее после заражения.
Во время беременности, когда количество лекарственных препаратов-кандидатов чрезвычайно ограничено, а планка для клинического утверждения чрезвычайно высока, люди должны быть очень осторожны при тестировании любых потенциальных методов лечения, которые могут быть использованы при беременности у человека. Трегалоза — невосстанавливающий дисахарид, обладающий стабильными химическими свойствами и множественными защитными эффектами для организмов и биологических макромолекул (Richards et al., 2002 ). Это своего рода еда, но не лекарство, и не вызывает серьезных побочных эффектов. Трегалоза в эффективных внутриклеточных концентрациях не влияет на развитие плода мыши или крысы и не проявляет тератогенного эффекта (Richards et al., 2002 ; Eroglu et al., 2003). Однако клинических испытаний для оценки его эмбриотоксичности или тератогенности для человека по-прежнему нет. Таким образом, только после тщательных токсикологических испытаний на людях лечение трегалозой может быть использовано в качестве многообещающего лечения беременных женщин, инфицированных вирусом Зика.
Будущее клиническое применение
Оптимальная дозировка трегалозы для человека требует клинических исследований. В экспериментах на мышах вода, содержащая 2% трегалозу, давалась мышам без ограничений , и эти пероральные приемы показали значительный терапевтический эффект (Schaeffer et al., 2012 ; Zhang et al., 2014 ). Вопрос о том, следует ли применять аналогичные методы лечения трегалозой для людей, требует дальнейших исследований. FDA не дает рекомендаций по этому сахару. Было бы хорошо следовать рекомендациям ВОЗ и ограничить потребление всех сахаров до 50 г в день (46). Нормальный дневной объем питьевой воды для человека составляет около 1 500–2 500 мл. Два процента трегалозы означают 30–50 г надень. Таким образом, рекомендации ВОЗ могут быть осуществимы. Однако беременные женщины также потребляют другие сахара из своего рациона. Высокое потребление матерью свободного сахара во время беременности связано с повышенным риском многих заболеваний у потомства, таких как атопическая астма и аллергическая астма (Bédard et al., 2017 ; Torjesen, 2017 ). Соответствующая пероральная доза требует дальнейших исследований.
Тем не менее, большая часть трегалозы расщепляется на глюкозу трегалазой на слизистой оболочке кишечника (Richards et al., 2002 ), пероральное введение может быть не очень эффективным методом. Альтернативным вариантом может быть инъекция трегалозы (Echigo et al., 2012 ; Sergin et al., 2017 ), хотя испытания на модели макаки-резус следует проводить до перехода к клиническим испытаниям на людях.